M81 Остеопороз без патологического перелома, МКБ-10
- M81.0 Постменопаузный остеопороз
- M81.1 Остеопороз после удаления яичников
- M81.2 Остеопороз, вызванный обездвиженностью
- M81.3 Постхирургический остеопороз, вызванный нарушением всасывания
- M81.4 Лекарственный остеопороз
- M81.5 Идиопатический остеопороз
- M81.6 Локализованный остеопороз [Лекена]
- M81.8 Другие остеопорозы
- M81.9 Остеопороз неуточненный
Отредактировано: 05.10.2025
Остеопороз
Определение
Остеопороз – это метаболическое заболевание скелета, при котором происходит снижение костной массы и нарушение микроархитектоники костной ткани, что приводит к повышенной хрупкости костей и риску переломов даже при минимальной травме [1]. По определению Всемирной организации здравоохранения (ВОЗ) остеопороз характеризуется низкой минеральной плотностью кости (МПК) в сочетании со структурными изменениями костной ткани [2, 3]. В клинической практике заболевание рассматривается прежде всего как проблема профилактики переломов, а не только снижения МПК: переломы лежат в основе инвалидизации, утраты самостоятельности и увеличения смертности у пациентов [4, 5].
Несмотря на то, что остеопороз чаще ассоциируется с пожилыми женщинами, примерно треть остеопоротических переломов приходится на мужчин старшего возраста. Наиболее тяжелое осложнение – перелом шейки бедра – сопровождается высоким уровнем летальности (до 24% в течение первого года), утратой мобильности и значительным снижением качества жизни [2].
По происхождению выделяют первичный и вторичный остеопороз, что отражает наличие либо отсутствие явных причин, приводящих к снижению костной массы [1]:
- Первичный остеопороз развивается как самостоятельное заболевание без иной выявленной причины снижения прочности скелета. Наиболее распространенная форма – постменопаузальный остеопороз, который составляет до 95% случаев у женщин и около 80% – у мужчин старше 50 лет. К редким вариантам первичного остеопороза относят идиопатический остеопороз (у женщин до менопаузы и мужчин моложе 50 лет) и ювенильный остеопороз (у детей и подростков до 18 лет).
- Вторичный остеопороз развивается на фоне сопутствующих заболеваний или терапии, влияющих на метаболизм кости (например, длительная терапия системными глюкокортикоидами, андрогенодепривационная терапия, прием цитостатиков, ингибиторов ароматазы и др.) В структуре остеопороза вторичный вариант составляет около 5% у женщин и до 20% у мужчин [6].
Этиология и патогенез
Остеопороз – полиэтиологическое заболевание, в развитии которого участвуют как генетические, так и средовые факторы [1]. Формирование скелета в детстве и подростковом возрасте связано с костным моделированием (образованием кости de novo), тогда как после завершения роста основным процессом является ремоделирование – сбалансированная резорбция старой костной ткани остеокластами и ее восстановление остеобластами [2]. Ключевую роль в регуляции этих процессов играют системы Wnt-склеростин и RANK/RANKL/OPG, определяющие активность остеобластов и остеокластов [1, 7]. Остеоциты – наиболее многочисленные клетки костной ткани – выполняют роль механосенсоров. Остеоциты через систему канальцев реагируют на механическую нагрузку и микроповреждения, инициируя локальное ремоделирование и обеспечивая соответствие прочности кости ее функциональным требованиям [2, 8].
После достижения пика костной массы (20-30 лет) ее уровень остается относительно стабильным до 35-40 лет, после чего начинается постепенное снижение [1]. У женщин потеря минеральной плотности кости ускоряется в пери- и постменопаузе из-за дефицита эстрогенов, что смещает баланс ремоделирования в сторону резорбции [1]. Однако снижение уровня эстрогенов – лишь один из факторов: существенное влияние оказывают также фосфорно-кальциевый обмен, витамин D, паратиреоидный гормон, гормон роста, тиреоидные гормоны, кальцитонин и глюкокортикоиды [1].
К факторам риска, способствующим ускоренной потере костной массы и увеличению вероятности переломов, относятся [1-2]:
- генетическая предрасположенность и особенности пиковой костной массы,
- эндокринные нарушения (преждевременная менопауза, гипогонадизм),
- дефицит витамина D и кальция,
- низкий индекс массы тела (менее 20 кг/м²) и выраженная потеря массы тела,
- иммобилизация,
- хронические заболевания (ревматоидный артрит, воспалительные заболевания кишечника, хроническая болезнь печени и почек),
- прием лекарственных препаратов (глюкокортикоиды, ингибиторы ароматазы, препараты для андрогенной депривации),
- вредные привычки (курение, употребление алкоголя более трех порций в день).
Таким образом, патогенез остеопороза связан с нарушением регуляции ремоделирования кости и смещением равновесия в сторону резорбции. Это приводит к снижению МПК, нарушению микроархитектоники и повышенной хрупкости костей, что клинически проявляется переломами даже при минимальной травме.
Клиническая картина
Остеопороз долгое время может протекать бессимптомно, и первые проявления заболевания зачастую связаны уже с переломами костей [1, 2]. До возникновения патологического перелома заболевание не имеет специфических клинических симптомов.
Переломы при остеопорозе
Для остеопороза наиболее характерны переломы:
- позвонков (компрессионные переломы тел позвонков),
- проксимального отдела бедренной кости,
- дистального отдела предплечья (перелом лучевой кости в типичном месте),
- проксимального отдела плечевой кости,
- таза.
В то же время переломы костей кистей, стоп и лицевого скелета, как правило, не связаны с остеопорозом [9].
Ранее остеопоротические переломы определялись как «низкоэнергетические» или «фрагильные» – возникающие при минимальной травме (например, падении с высоты собственного роста). Однако показано, что переломы, возникшие и при более значительной травме (например, падение с лестницы), имеют ту же связь со сниженной минеральной плотностью кости и такой же прогностический риск последующих низкоэнергетических переломов. Исключение составляют травмы экстремального характера (падение с большой высоты) и переломы, связанные с локальной патологией (например, опухолью) [10].
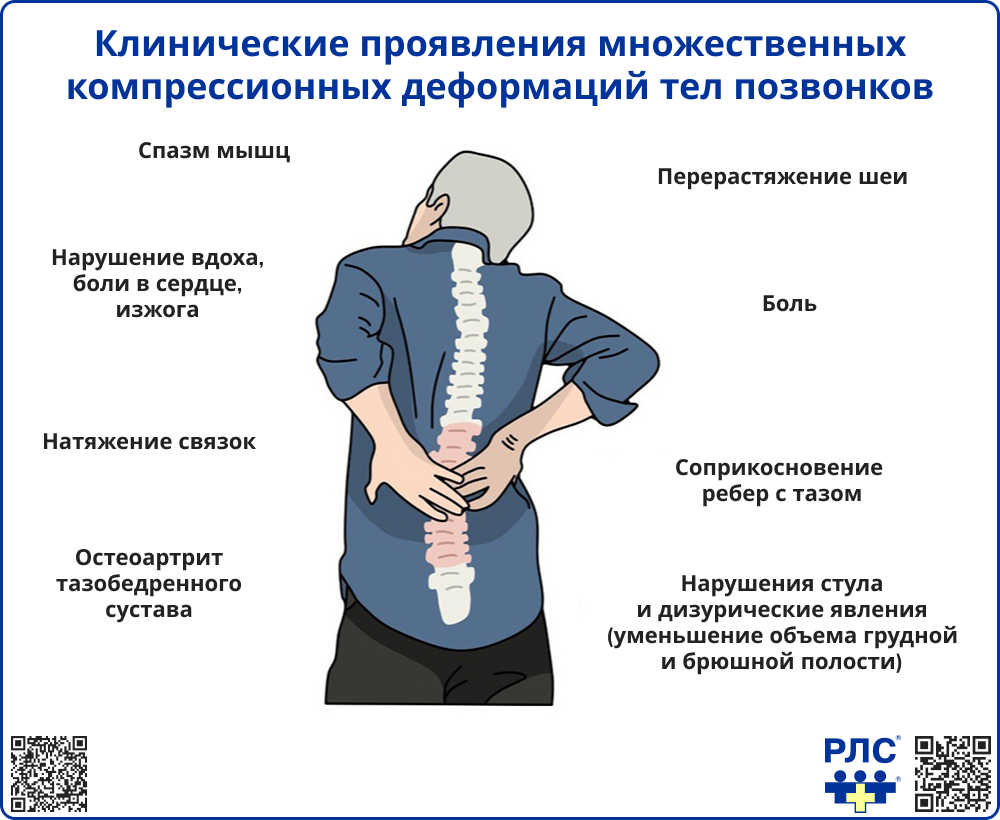
Особое место занимают компрессионные переломы тел позвонков. Они могут сопровождаться болью в спине, чувством усталости, ограничением подвижности. Такие переломы часто остаются недиагностированными: по оценкам, около 2/3 таких переломов не выявляется из-за отсутствия яркой симптоматики или ошибочной связи симптомов с хроническими заболеваниями спины (например, с остеоартрозом) [1, 2]. Диагноз нередко устанавливается случайно – при проведении рентгенографии или КТ по другому поводу.
Клинические признаки скрытых переломов позвонков
Косвенно заподозрить компрессионные переломы позвоночника можно по следующим признакам:
- снижение роста пациента,
- появление выраженного грудного кифоза («сутулости»),
- уменьшение расстояния между нижними ребрами и гребнями подвздошных костей [11].
Диагностика
Диагноз остеопороза устанавливается на основании совокупности клинических, инструментальных и лабораторных данных [1, 2].
Критерии установления диагноза включают:
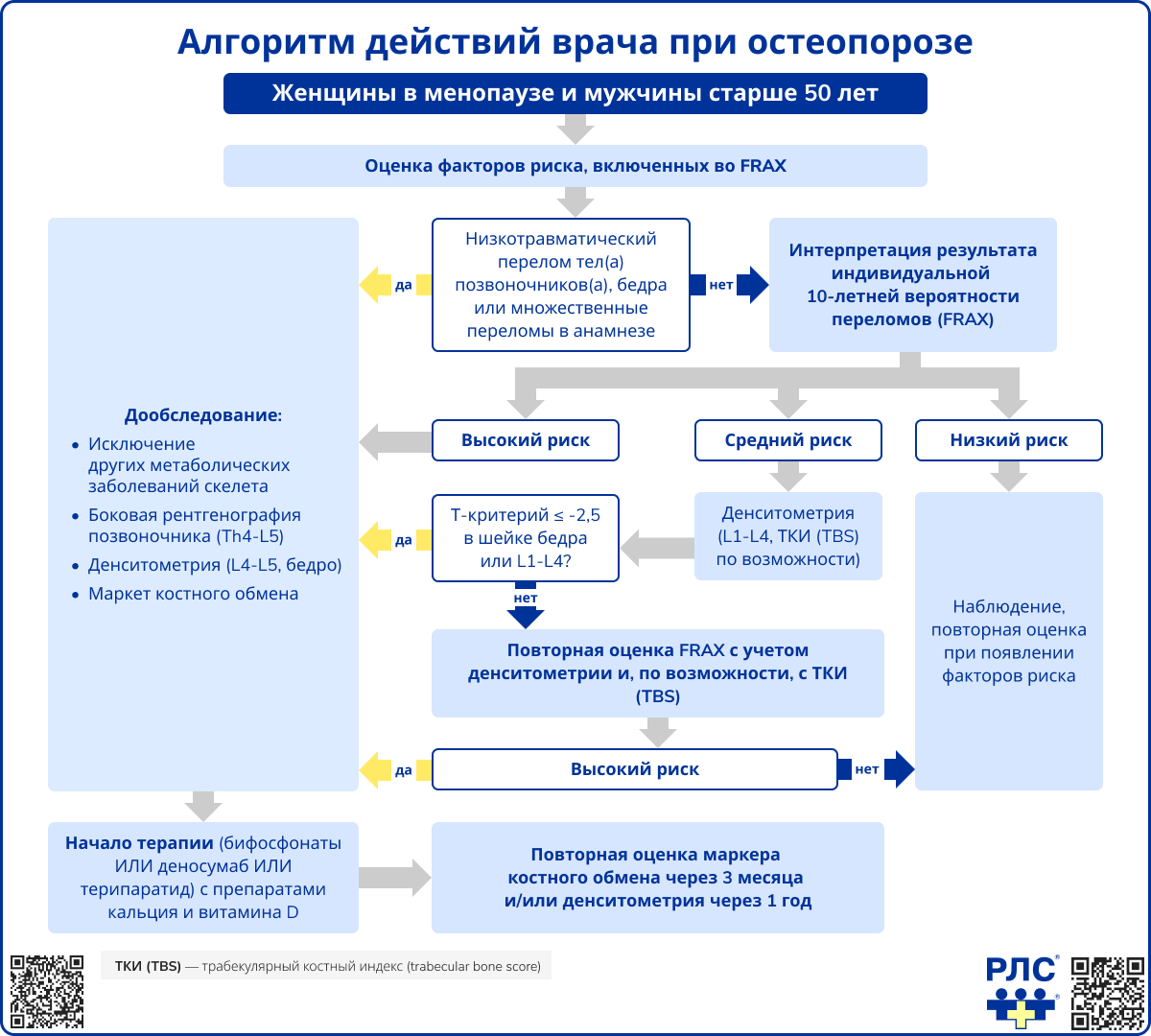
- Наличие патологических переломов крупных костей (бедренной кости, тел позвонков, множественных переломов) в анамнезе или при обследовании, независимо от показателей денситометрии или FRAX (при исключении других заболеваний скелета);
- Высокая индивидуальная 10-летняя вероятность основных патологических переломов (результат оценки FRAX соответствует установленному в Российской Федерации порогу вмешательства и/или превышает его), независимо от минеральной плотности кости;
- Снижение МПК по данным двухэнергетической рентгеноденситометрии (DXA): T-критерий ≤ –2,5 SD в шейке бедренной кости, и/или проксимальном отделе бедра и/или поясничных позвонках (L1-L4) у женщин в постменопаузе и мужчин старше 50 лет.
Жалобы и анамнез
Остеопороз длительно протекает бессимптомно и проявляется при развитии патологического перелома. Поэтому при сборе жалоб и анамнеза целесообразно оценивать индивидуальный 10-летний риск остеопоротических переломов с помощью алгоритма FRAX (Fracture Risk Assessment Tool). Этот инструмент рекомендуется применять у женщин в постменопаузе и мужчин старше 50 лет [12, 13].
При проведении опроса с использованием алгоритма FRAX врач уточняет наличие переломов в анамнезе наряду с другими факторами риска. Если у пациента ранее имели место патологические переломы крупных костей скелета, то устанавливается диагноз «остеопороз» и назначается лечение независимо от результатов рентгеноденситометрии или оценки по FRAX (при условии исключения других заболеваний скелета). Это связано с тем, что переломы при минимальной травме отражают нарушение микроархитектоники и снижение прочности кости. Они являются значимым предиктором повторных переломов позвонков и других костей (HR ≈ 1,4-1,9) [14, 15]. Таким образом, факт перелома на фоне минимальной травмы является достаточным основанием для постановки диагноза остеопороза и начала терапии.
Физикальное обследование
Пациентам группы риска (женщины в постменопаузе и мужчины старше 50 лет) рекомендуется проводить физикальное обследование для выявления клинических признаков и осложнений остеопороза [1].
Обследование включает:
- измерение роста (сравнение с максимальным зарегистрированным ростом, приблизительно в возрасте 25 лет, или с предыдущими измерениями),
- оценку формы грудной клетки и осанки,
- осмотр задней поверхности спины на наличие кожных складок,
- проверку расстояния между анатомическими ориентирами (реберными дугами и гребнями подвздошных костей).
К физикальным признакам компрессионных переломов позвонков относятся:
- Снижение роста ≥2 см в течение последних 1-3 лет или суммарное уменьшение ≥4 см с молодого возраста;
- Симптом «лишней кожи» – появление складок на спине и боках;
- Уменьшение расстояния между нижними ребрами и подвздошными гребнями до величины, сопоставимой с шириной двух пальцев;
- Невозможность полностью распрямиться – при попытке стать у стены сохраняется расстояние между затылком и стеной;
- Кифоз грудного отдела позвоночника, сопровождающийся «сутулостью»;
- Вторичные изменения фигуры: относительное укорочение туловища при кажущемся удлинении конечностей, выпячивание передней брюшной стенки.
При физикальном осмотре рекомендуется также оценивать наличие симптомов, указывающих на возможные вторичные причины остеопороза (например, признаки эндокринных нарушений, хронических воспалительных заболеваний, последствий продолжительной терапии глюкокортикоидами).
Лабораторные методы
Лабораторные методы исследования не применяются для постановки диагноза первичного остеопороза, но играют важную роль в исключении вторичных причин, дифференциальной диагностике и оценке безопасности и эффективности терапии.
К базовым исследованиям, рекомендуемым при впервые установленном диагнозе и при неэффективности терапии, относят [1]:
- общий кальций в крови,
- креатинин с расчетом скорости клубочковой фильтрации,
- неорганический фосфор,
- щелочная фосфатаза (ЩФ),
- глюкоза крови,
- общий анализ крови.
Эти исследования позволяют исключить другие заболевания, сопровождающиеся повышенной хрупкостью костей, и выявить противопоказания к назначению отдельных групп препаратов (например, гипокальциемия – противопоказание к терапии бисфосфонатами и деносумабом; гиперкальциемия и высокая ЩФ – противопоказание к терипаратиду).
При первичном остеопорозе общий анализ крови, как правило, не имеет специфических изменений. Однако выявление анемии или повышенной СОЭ должно насторожить врача в отношении других заболеваний, способных снижать прочность костной ткани, и послужить поводом для поиска вторичного остеопороза.
В диагностике остеопороза также применяется исследование биохимических маркеров костного ремоделирования. В клинической практике наибольшее значение имеют N-терминальный пропептид проколлагена I типа (P1NP) – маркер костеобразования, и С-концевой телопептид коллагена I типа (CTX) – маркер костной резорбции [1]. Эти показатели отличаются стабильностью, хорошей воспроизводимостью и рекомендуются для рутинного применения.
Для корректного мониторинга достаточно определять один маркер, но всегда в одной лаборатории, в одно и то же время суток, на одном типе анализатора и с использованием одинаковых тест-систем.

Определение биохимических маркеров костного ремоделирования показано в следующих ситуациях [1]:
- До начала терапии остеопороза и через 3 месяца от старта – для ранней оценки эффективности лечения и приверженности лечению (ожидается изменение уровня маркера не менее чем на 30%).
- У женщин в постменопаузе с остеопенией – как дополнительный фактор риска (высокие значения предсказывают более быструю потерю костной массы).
- При отсутствии возможности проведения рентгеноденситометрии поясничного отдела позвоночника и проксимального отдела бедренной кости – маркеры могут служить суррогатным критерием эффективности терапии.
Клиническая интерпретация биохимических маркеров костного ремоделирования основывается на их динамике в процессе терапии. Снижение CTX при терапии бисфосфонатами коррелирует с увеличением МПК и уменьшением риска переломов, что подтверждено клиническими исследованиями [16, 20]. Повышение P1NP на фоне терапии терипаратидом служит предиктором прироста МПК [21].
Важно учитывать, что до 50% случаев неэффективности лечения остеопороза связано с низкой приверженностью пациентов к терапии, и именно поэтому мониторинг маркеров костного ремоделирования может служить объективным показателем соблюдения пациентом назначенной терапии [1].
Маркеры костного ремоделирования не используются для постановки первичного диагноза остеопороза, так как не обладают достаточной специфичностью. Биомаркеры не используются в качестве самостоятельного инструмента для прогнозирования индивидуального риска переломов или для единоличного выбора метода терапии, их роль – мониторинг ответа на лечение и выявление динамики ремоделирования. Еще одним ограничением маркеров костного ремоделирования является то, что после перелома они закономерно повышаются, и этот эффект может сохраняться до 6 месяцев, что следует учитывать при интерпретации результатов.
Рентгенография позвоночника
Стандартная рентгенография грудного и поясничного отделов позвоночника (Th4-L5) в боковой проекции проводится для выявления компрессионных переломов у пациентов с болями в спине, снижением роста, приемом глюкокортикоидов, сахарным диабетом 2 типа или переломами другой локализации.
Получение боковых рентгенограмм требует соблюдения ряда технических правил:
- пациент располагается на левом боку,
- сколиотическое искривление выпрямляется специальными поролоновыми валиками так, чтобы линия, проведенная по остистым отросткам, шла параллельно столу,
- при рентгенографии грудного отдела используется специальный режим дыхания,
- при съемке поясничного отдела пациент задерживает дыхание,
- рекомендуется применять кассеты со специальными выравнивающими экранами для повышения качества изображения.
Соблюдение этих условий повышает точность диагностики и позволяет достоверно выявлять компрессионные переломы. Последние часто протекают бессимптомно или проявляются неспецифическими болями в спине, поэтому активное их выявление имеет ключевое значение: до 20% пациентов, испытавших патологический перелом тела позвонка, перенесут второй перелом уже в течение следующего года [22, 23]. Особенно высок риск у больных, длительно принимающих глюкокортикоиды (более 3 месяцев) или страдающих сахарным диабетом 2 типа.
Компрессионным переломом тела позвонка считается снижение его высоты в переднем, среднем или заднем отделах на 20% и более по сравнению с другими отделами того же позвонка. В клинической практике используется градация тяжести деформации (0-3 степень) [24-25]:
- 0 степень – отсутствие деформации,
- 1 степень – начальная деформация, снижение высоты тела позвонка на 20%,
- 2 степень – средняя деформация, снижение на 20-40%,
- 3 степень – тяжелая деформация, снижение более чем на 40%.
Такой подход позволяет объективно оценить выраженность деформации и динамику изменений при повторных исследованиях.
При сомнениях в интерпретации рентгенограмм используют КТ, МРТ или сцинтиграфию.
Двухэнергетическая рентгеноденситометрия
Двухэнергетическая рентгеноденситометрия (DXA) остается «золотым стандартом» диагностики остеопороза и мониторинга эффективности терапии [1, 2]. Метод позволяет количественно оценить минеральную плотность кости и отнести пациента к одной из диагностических категорий по критериям ВОЗ.
При DXA оцениваются следующие показатели:
- Костный минеральный компонент (BMC, bone mineral content) – отражает количество минерализованной ткани (г) при сканировании костей, обычно рассчитывается на единицу длины пути сканирования (г/см).
- Минеральная плотность кости (BMD, bone mineral density) – показывает количество минерализованной ткани в единице площади (г/см²).
В клинической практике результаты сравниваются с референсными базами данных, используются два критерия:
- T-критерий – стандартное отклонение выше или ниже среднего показателя пика костной массы у молодых женщин 20-29 лет (NHANES III). Применяется для женщин в постменопаузе и мужчин старше 50 лет.
- Z-критерий – стандартное отклонение от среднего уровня МПК у лиц аналогичного возраста и пола. Используется у женщин до менопаузы, мужчин моложе 50 лет и у детей.
DXA поясничного отдела позвоночника и проксимального отдела бедренной кости назначается пациентам со «средней» вероятностью переломов по FRAX (оранжевая зона), когда решение о лечении остается неопределенным. При этом рекомендуется устанавливать диагноз остеопороз и назначать терапию при Т-критерии ≤ –2,5 в шейке бедренной кости или в целом в проксимальном отделе бедренной кости и/или в поясничных позвонках (L1-L4).
Кроме того, DXA используется для оценки эффективности проводимой терапии, а также динамики состояния МПК у пациентов с ранее установленным остеопорозом и перерывом в лечении с временным интервалом не менее 12 месяцев от первого исследования.

Трабекулярный костный индекс (TBS, trabecular bone score) рассчитывается на основе стандартных денситометрических изображений поясничного отдела позвоночника и отражает качество трабекулярной микроархитектоники [1]. TBS можно интегрировать в алгоритм FRAX, что повышает его чувствительность для выявления пациентов с высоким риском переломов. Для клинической практики он используется как дополнительный фактор риска, хотя самостоятельного порога вмешательства пока не имеет.
Использование FRAX
Алгоритм FRAX (Fracture Risk Assessment Tool) применяется для расчета индивидуальной 10-летней вероятности перелома бедренной кости и основных патологических переломов (позвонки, бедренная, плечо, лучевая кость) [12]. Он учитывает:
- возраст,
- пол,
- индекс массы тела,
- анамнез переломов,
- наследственность (перелом бедра у родителей),
- курение,
- употребление алкоголя,
- прием глюкокортикоидов,
- наличие ревматоидного артрита и др.
При необходимости в расчет может быть включена минеральная плотность кости в шейке бедра.
В России определены пороговые значения («точки вмешательства»), при которых рекомендуется назначать терапию остеопороза. Если рассчитанная по FRAX вероятность переломов достигает или превышает порог вмешательства, лечение показано независимо от результатов рентгеноденситометрии.
Если переломов в анамнезе нет, решение о терапии принимается по результатам FRAX в сочетании с клиническими факторами риска.
- Пациентам с высокой индивидуальной 10-летней вероятностью переломов по FRAX лечение назначается даже при нормальной МПК.
- Для пациентов, у которых выявлен остеопороз по T-критерию (≤–2,5), лечение рекомендовано независимо от значения FRAX.
Алгоритм характеризуется рядом ограничений: например, он не учитывает дозу глюкокортикоидов, количество выкуриваемых сигарет и алкоголя, а также не отражает влияние сахарного диабета 2 типа. Также он не может быть применен у молодых людей и детей, не учитывает МПК поясничного отдела позвоночника и не валидирован у пациентов, получающих активное лечение остеопороза (если терапия была прекращена более 2 лет назад – считается допустимым).
При приеме глюкокортикоидов ≥7,5 мг/сут (в пересчете на преднизолон) ≥3 месяцев рекомендуется увеличить рассчитанный риск переломов [1]:
- бедренной кости – на 20%,
- основных переломов – на 15%.
У пациентов с сахарным диабетом 2 типа предлагается:
- отметить «да» для фактора риска «ревматоидный артрит»,
- при возможности – включать в расчет трабекулярный костный индекс, который лучше отражает нарушение качества костной ткани при диабете,
- альтернативно – снижать T-критерий на 0,5 SD или условно увеличивать возраст пациента на 10 лет.
Иные диагностические исследования
Помимо стандартной двухэнергетической рентгеноденситометрии, существуют дополнительные остеоденситометрические технологии, обладающие высокой точностью и воспроизводимостью [1]. Однако их использование ограничено, так как получаемые значения не эквивалентны T-критериям DXA и не могут быть напрямую использованы для диагностической классификации остеопороза.
Количественная компьютерная томография (ККТ) позволяет проводить трехмерное измерение МПК и определять количество минерализованной костной ткани на единицу объема (г/см³). Метод измеряет общую МПК трабекулярной кости в позвоночнике и суммарную проекционную (кортикальной слой и губчатое вещество) в бедренной кости (г/см2) и может быть использована для определения прочности кости. Это делает его полезным для прогнозирования риска переломов тел позвонков у женщин в постменопаузе. Вместе с тем ККТ сопровождается значительно более высокой лучевой нагрузкой по сравнению с DXA.
Периферическая ККТ (пККТ) применяется для исследования костной ткани предплечья или большеберцовой кости; варианты высокого разрешения (HR-pQCT) позволяют дополнительно оценить объемную плотность, микроархитектонику и костную структуру. Установлено, что такие измерения могут быть использованы для прогнозирования риска переломов бедренной кости у женщин, однако убедительных данных об их прогностической ценности для мужчин не получено.
Периферическая DXA исследует МПК в области предплечья, пальцев или пяточной кости и может использоваться для оценки риска переломов у женщин в постменопаузе. Однако этот метод не имеет достаточной прогностической силы в отношении мужчин и не применяется для постановки диагноза остеопороза или мониторинга эффективности терапии. Его преимущество заключается в низкой лучевой нагрузке, но результаты периферической DXA всегда должны быть подтверждены аксиальной денситометрией.
Количественная ультразвуковая денситометрия (КУЗД, QUS) не измеряет МПК напрямую. Она оценивает скорость распространения ультразвуковой волны (SOS) или широкополосное ослабление ультразвука (BUA) в пяточной, большеберцовой кости, надколеннике и других зонах. Комплексные параметры, основанные на этих измерениях, могут использоваться в клинической практике. Валидизированные ультразвуковые приборы для исследования пяточной кости позволяют прогнозировать риск переломов позвонков и бедренной кости у женщин в постменопаузе, а также риск бедренных и внепозвоночных переломов у мужчин 65 лет и старше. Преимуществом метода является отсутствие лучевой нагрузки, что делает его удобным инструментом для скрининга, однако для постановки диагноза остеопороза он не применяется.
Лечение
Лечение остеопороза включает комплекс мероприятий, направленных на снижение риска переломов, улучшение качества жизни и увеличение выживаемости пациентов [1, 2]. В терапии применяются медикаментозные и немедикаментозные методы, диетотерапия, коррекция факторов риска и, при необходимости, хирургическое вмешательство.
Препараты для лечения остеопороза условно делятся на:
- антирезорбтивные (бисфосфонаты (БФ), деносумаб), которые подавляют костную резорбцию,
- анаболические (терипаратид), стимулирующие костеобразование.
Эффективность терапии оценивается по снижению частоты переломов, а также косвенно по ряду суррогатных критериев, таких как изменение минеральной плотности кости и маркеров костного ремоделирования.
Бисфосфонаты
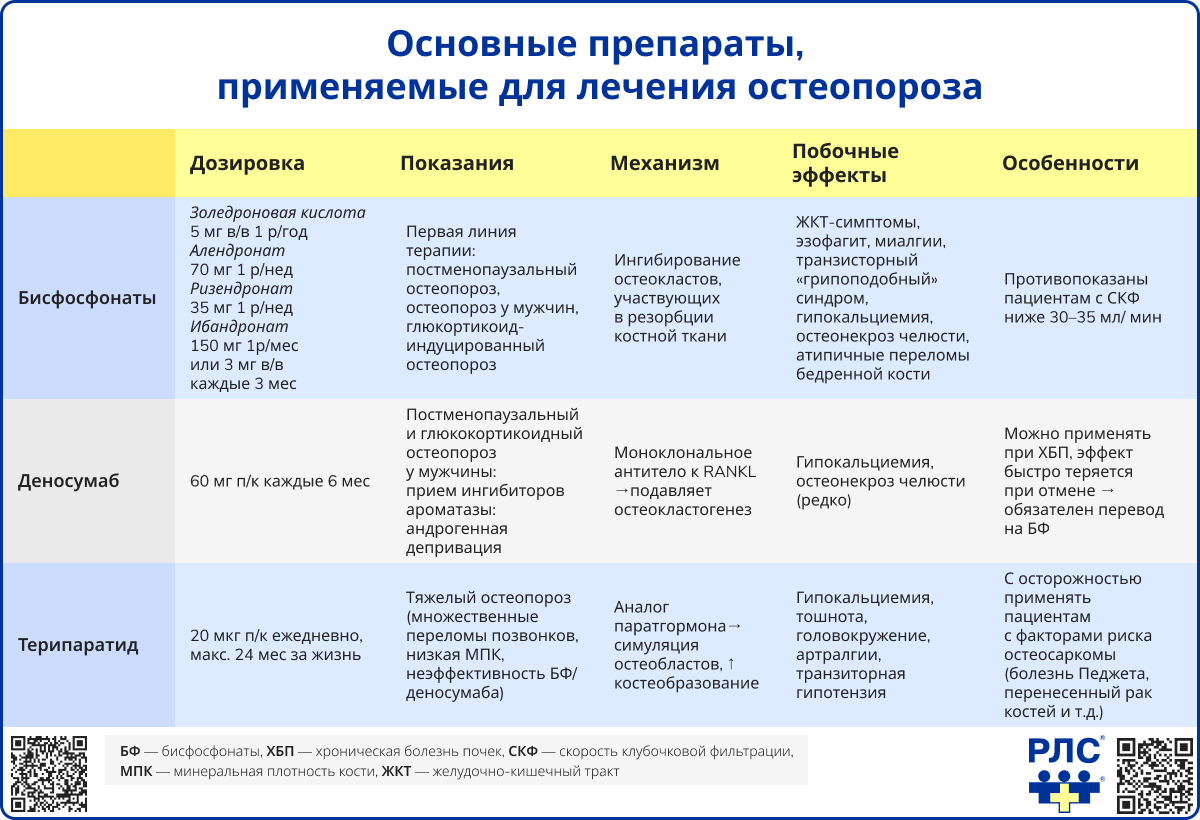
Препараты первой линии (алендроновая кислота, ризедроновая кислота, ибандроновая кислота и золедроновая кислота) снижают риск переломов позвонков и бедренной кости, увеличивают МПК у женщин в постменопаузе, мужчин и пациентов с глюкокортикоидным остеопорозом. Наиболее выраженную противопереломную эффективность демонстрирует золедроновая кислота, способная снижать риск переломов уже в течение первого года лечения.
Золедроновая кислота применяется в различных режимах дозирования:
- 5 мг 1 раз в год – для предупреждения новых переломов и улучшения выживаемости после хирургического лечения перелома проксимального отдела бедренной кости (минимум через две недели после операции);
- 5 мг 1 раз в 24 месяца – для профилактики снижения МПК у женщин в постменопаузе с остеопенией;
- 5 мг 1 раз в 18 месяцев – для профилактики переломов у женщин старше 65 лет.
Противопоказанием является снижение скорости клубочковой фильтрации менее 30-35 мл/мин. К возможным нежелательным явлениям относятся:
- желудочно-кишечные симптомы,
- миалгии,
- транзиторный «гриппоподобный синдром» при внутривенном введении.
Длительное применение (более 3-5 лет) связано с риском остеонекроза челюсти и атипичных переломов бедра.
Средняя продолжительность лечения бисфосфонатами составляет 3 года для внутривенных форм и 5 лет для пероральных. При высоком риске переломов терапия может продолжаться до 10 лет (для алендроновой кислоты).
Деносумаб
Деносумаб – это препарат моноклональных антител к RANKL, вводится подкожно по 60 мг 1 раз в 6 месяцев. Препарат продемонстрировал высокую эффективность в снижении риска переломов позвонков на 68%, бедренной кости на 40% и внепозвоночных переломов на 20% по сравнению с плацебо. Деносумаб используется у женщин в постменопаузе, мужчин с остеопорозом, при глюкокортикоидном остеопорозе, а также у пациентов, получающих терапию ингибиторами ароматазы по поводу рака молочной железы или андрогенной депривации по поводу рака предстательной железы. Дополнительным преимуществом является возможность применения у пациентов с хронической болезнью почек.
К преимуществам деносумаба относится его способность подавлять костную резорбцию как в трабекулярной, так и в кортикальной костной ткани, а также отсутствие необходимости коррекции дозы при нарушении функции почек, поскольку его клиренс не зависит от почечного пути элиминации. Он оказался более эффективным по приросту МПК, чем бисфосфонаты, и может назначаться после терапии БФ или терипаратидом.
Побочные эффекты деносумаба включают:
- гипокальциемию (особенно при дефиците витамина D или хронической болезни почек),
- остеонекроз челюсти,
- атипичные переломы бедра.
Продолжительность лечения деносумабом может составлять до 10 лет, при этом наблюдается стабильный прирост МПК.
После отмены деносумаба его эффект быстро утрачивается, что сопровождается повышением риска множественных переломов позвонков, поэтому необходимо назначение БФ для предотвращения эффекта отмены.
Терипаратид
Терипаратид – анаболический препарат (рекомбинантный паратиреоидный гормон), назначаемый в дозе 20 мкг 1 раз в сутки подкожно. Рекомендован пациентам с тяжелым остеопорозом (множественные переломы позвонков, выраженное снижение МПК, неэффективность антирезорбтивной терапии). В отдельных исследованиях, особенно среди пациентов с глюкокортикоидным остеопорозом, терипаратид продемонстрировал более выраженное снижение риска вертебральных переломов по сравнению с бисфосфонатами. Максимальная продолжительность терапии – 24 месяца, после чего обязательно назначение антирезорбтивных препаратов (БФ или деносумаб) для закрепления эффекта, так как терипаратид не накапливается в костной ткани и его действие обратимо.
Другие препараты
Стронция ранелат ранее применялся в лечении остеопороза, но в настоящее время не рекомендован из-за повышенного риска сердечно-сосудистых осложнений и тромбоэмболий.
Продолжительность и мониторинг медикаментозного лечения
Пациентам с остеопорозом без патологических переломов, при достижении клинического эффекта (повышение МПК до –2,0 SD по Т-критерию в шейке бедренной кости и отсутствие новых переломов), рекомендуется временно прекратить терапию бисфосфонатами на 1-2 года с последующим динамическим наблюдением.
При неэффективности проводимой терапии остеопороза (при появлении нового перелома, снижении МПК ≥4% в бедре или ≥5% в позвонках по данным двух последовательных измерений, а также при отсутствии значимого снижения маркеров костной резорбции (<30% изменений)) рекомендуется рассмотреть вопрос о смене терапии.
Пациентам с высоким риском переломов (множественные переломы, тяжелое снижение МПК) рекомендуется длительное непрерывное лечение, без перерывов.
После отмены деносумаба или терипаратида показано назначение антирезорбтивной терапии (бисфосфонаты), поскольку их эффект обратим.
Мониторинг эффективности и безопасности терапии остеопороза включает регулярную клиническую оценку, предусматривающую контроль роста и массы тела, выявление новых переломов и регистрацию побочных эффектов [2]. Инструментальный контроль минеральной плотности костной ткани с помощью DXA рекомендуется проводить с интервалом 2-3 года. Для оценки комплаенса и раннего прогнозирования эффективности лечения могут применяться биохимические маркеры костного ремоделирования. У пациентов, не получающих специфическую терапию, повторную оценку риска переломов с использованием алгоритма FRAX целесообразно выполнять каждые 3-10 лет.
Сопутствующая терапия
Все препараты для лечения остеопороза назначаются в комбинации с препаратами кальция (500-1000 мг/сут) и колекальциферола (не менее 800 МЕ/сут).
Метаанализы показали, что прием кальция и витамина D в общей популяции не снижает риск переломов, однако у пациентов с остеопорозом или дефицитом эти нутриенты являются обязательными [26]. Прием кальция сверх рекомендуемых доз повышает риск камней в почках и, возможно, сердечно-сосудистых осложнений [2].
Рутинное определение уровня витамина D у здоровых не рекомендуется, но показано у лиц с риском его дефицита (хронические болезни почек и печени, мальабсорбция, перенесенная бариатрическая операция, остеомаляция, остеопороз с переломами) [2].
Хирургическое лечение
Хирургическое вмешательство является обязательным при патологических переломах проксимального отдела бедренной кости. Госпитализация в специализированное отделение и хирургическое лечение должны быть выполнены в сроки до 48 часов с момента поступления для пациентов с переломом шейки бедра и до 72 часов – для пациентов с чрезвертельным переломом.
Раннее оперативное лечение (остеосинтез или эндопротезирование) повышает выживаемость, снижает риск осложнений и способствует более быстрой реабилитации.
Противопоказаниями к срочному оперативному вмешательству являются:
- острый инфаркт миокарда,
- инсульт,
- тяжелая пневмония с необходимостью ИВЛ,
- острые хирургические заболевания,
- кома,
- сахарный диабет с декомпенсацией углеводного обмена,
- хроническая или острая гнойная инфекция в зоне предполагаемого разреза,
- выраженные когнитивные и психические нарушения,
- терминальные стадии болезней, исключающие восстановление двигательной активности.
После хирургического лечения пациентам показано назначение специфической антиостеопоротической терапии, а также выполнение мероприятий по профилактике падений.
После хирургического лечения перелома рекомендована ранняя активизация пациентов (желательно уже на 1-2 сутки после операции) и лечение остеопороза или другого заболевания скелета, приведшего к перелому для предупреждения новых переломов и улучшения прогноза реабилитации.
Немедикаментозное лечение и диетотерапия
Немедикаментозные меры являются неотъемлемой частью комплексного лечения остеопороза. Для взрослых рекомендуется модификация образа жизни для профилактики переломов. Важно поддерживать индекс массы тела выше 20, исключить курение и чрезмерное употребление алкоголя. Крайне важна профилактика падений – регулярные физические упражнения (на равновесие, силовые и аэробные нагрузки, тренировка гибкости) [2].
Рекомендуется [1, 2]:
- Достаточное поступление кальция с пищей (1000-1200 мг/сут, преимущественно из молочных продуктов, листовой зелени, орехов, рыбы с костями);
- Коррекция дефицита витамина D (солнечная инсоляция, прием препаратов);
- Адекватная физическая активность (упражнения с отягощением, ходьба, плавание). По данным метаанализов, программы прогрессивных силовых тренировок (приседания, выпады, отжимания) в течение не менее 8 месяцев повышают МПК в области шейки бедренной кости и улучшают функциональные показатели [27]. Балансировочные упражнения и тренировки координации у пожилых снижают риск падений на 24% и частоту хотя бы одного падения – на 13% [28];
- Профилактика падений (устранение бытовых рисков, использование тростей или ходунков при необходимости, коррекция зрения и слуха);
- Отказ от курения и ограничение употребления алкоголя.
Менопаузальная гормональная терапия
Менопаузальная гормональная терапия (МГТ) одобрена для профилактики постменопаузального остеопороза, а также для лечения вазомоторных симптомов (приливы, ночная потливость) и вульвовагинальной атрофии, ассоциированной с менопаузой. Женщинам с сохраненной маткой МГТ назначается только в комбинации с прогестагенами для профилактики гиперплазии и рака эндометрия [1].
В исследовании WHI (Women’s Health Initiative) было показано, что назначение МГТ в течение 5 лет снижает риск переломов позвонков и бедренной кости на 34%, а внепозвоночных переломов – на 23% [29].
WHI показало, что применение стандартных доз конъюгированных эквин эстрогенов (КЭЭ) в комбинации с медроксипрогестероном в течение 5 лет увеличивает риск ишемической болезни сердца, инсульта, инвазивного рака молочной железы, тромбоза глубоких вен и тромбоэмболии легочной артерии [29]. Однако последующий анализ данных продемонстрировал, что у женщин младше 60 лет, начавших терапию в первые 10 лет постменопаузы, риск ИБС не повышается, а абсолютные риски инсульта, тромбоэмболии и рака молочной железы остаются низкими [30]. Более того, у женщин после гистерэктомии, получавших только эстрогены (КЭЭ 0,625 мг/сут), в исследовании WHI отмечено снижение риска рака молочной железы, ИБС и общей смертности при семилетнем наблюдении [30].
МГТ рекомендована женщинам младше 60 лет и/или в течение первых 10 лет после наступления менопаузы [1]. В этот период соотношение пользы и риска наиболее благоприятно, и МГТ может рассматриваться в качестве терапии первой линии. Рекомендуется назначать минимально эффективные дозы, со снижением дозы по мере увеличения возраста и ежегодной оценкой пользы и рисков. Начало МГТ у женщин старше 60 лет, как правило, не рекомендуется из-за изменения соотношения пользы и рисков. Продолжительность терапии строго не ограничена, если сохраняются показания и терапия переносится хорошо.
Мета-анализы и наблюдательные исследования показывают, что при использовании трансдермальных форм МГТ риск тромбоэмболии и ишемического инсульта ниже, чем при пероральном приеме [31]. Это делает трансдермальные формы предпочтительными для женщин с повышенным сосудистым риском.
Список литературы
- Клинические рекомендации Российской ассоциации эндокринологов, Общественной организации «Российская ассоциация по остеопорозу», Ассоциации ревматологов России, Ассоциации травматологов-ортопедов России, Ассоциации гинекологов-эндокринологов России, Общероссийской общественной организации «Российская ассоциация геронтологов и гериатров» «Остеопороз», М: 2021.
- Morin, S. N., Leslie, W. D., & Schousboe, J. T. (2025). Osteoporosis: A Review. JAMA, Published online June 30, 2025. doi:10.1001/jama.2025.6003
- World Health Organization.Guidelines for preclinical evaluation and clinical trials in osteoporosis. Published in1998. https://iris.who.int/bitstream/handle/10665/42088/9241545224_eng.pdf
- Siris ES, Adler R, Bilezikian J, et al. The clinical diagnosis of osteoporosis: a position statement from the National Bone Health Alliance Working Group. Osteoporos Int. 2014;25(5):1439-1443. doi:10.1007/s00198-014-2655-z
- LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022;33(10):2049-2102. doi:10.1007/s00198-021-05900-y
- Cosman F, de Beur S, LeBoff M, de Beur SJ, Tanner B Clinician’s Guide to Prevention and Treatment of Osteoporosis. National Osteoporosis Foundation. 1150 17th St., NW, Suite 850, Washington, DC 20036, Release Date: April 1, 2014
- Everts V, Jansen IDC, de Vries TJ. Mechanisms of bone resorption. Bone. 2022;163:116499. doi:10.1016/j.bone.2022.116499
- Hughes JM, Castellani CM, Popp KL, et al. The central role of osteocytes in the four adaptive pathways of bone’s mechanostat. Exerc Sport Sci Rev. 2020;48(3):140-148. doi:10.1249/JES.0000000000000225
- Warriner AH, Patkar NM, Curtis JR, et al. Which fractures are most attributable to osteoporosis? J Clin Epidemiol. 2011;64(1):46-53. doi:10.1016/j.jclinepi.2010.07.007
- Mackey DC, Lui LY, Cawthon PM, et al; Study of Osteoporotic Fractures (SOF) and Osteoporotic Fractures in Men Study (MrOS) Research Groups. High-trauma fractures and low bone mineral density in older women and men. JAMA. 2007;298(20):2381-2388. doi:10.1001/jama.298.20.2381
- Morin SN, Feldman S, Funnell L, et al; Osteoporosis Canada 2023 Guideline Update Group. Clinical practice guideline for management of osteoporosis and fracture prevention in Canada: 2023 update. CMAJ. 2023;195(39):E1333-E1348. doi:10.1503/cmaj.221647
- Beaudoin C, Moore L, Gagné M, et al. Performance of predictive tools to identify individuals at risk of non-traumatic fracture: a systematic review, meta-analysis, and meta-regression. Osteoporos Int. 2019;30(4):721-740. doi:10.1007/s00198-019-04919-6
- Lesnyak O, Ershova O, Belova K et al. Epidemiology of fracture in the Russian Federation and the development of a FRAX model. Arch Osteoporos. 2012;7(1-2):67-73. doi:10.1007/s11657-012-0082-3.
- Kanis JA, Johansson H, McCloskey EV, et al. Previous fracture and subsequent fracture risk: a meta-analysis to update FRAX. Osteoporos Int. 2023;34(12):2027-2045. doi:10.1007/s00198-023-06870-z
- Vandenput L, Johansson H, McCloskey EV, et al. A meta-analysis of previous falls and subsequent fracture risk in cohort studies. Osteoporos Int. 2024;35(3):469-494. doi:10.1007/s00198-023-07012-1
- Ravn P, Hosking D, Thompson D et al. Monitoring of Alendronate Treatment and Prediction of Effect on Bone Mass by Biochemical Markers in the Early Postmenopausal Intervention Cohort Study1. The Journal of Clinical Endocrinology & Metabolism. 1999;84(7):2363-2368. doi:10.1210/jcem.84.7.5847.
- Fink E, Cormier C, Steinmetz P, Kindermans C, Le Bouc Y, Souberbielle J. Differences in the Capacity of Several Biochemical Bone Markers to Assess High Bone Turnover in Early Menopause and Response to Alendronate Therapy. Osteoporosis International. 2000;11(4):295-303. doi:10.1007/pl00004183.
- Bauer D, Black D, Garnero P et al. Change in Bone Turnover and Hip, Non-Spine, and Vertebral Fracture in Alendronate-Treated Women: The Fracture Intervention Trial. J Bone Miner Res. 2004;19(8):1250-1258. doi:10.1359/jbmr.040512.
- Delmas P, Recker R, Chesnut C et al. Daily and intermittent oral ibandronate normalize bone turnover and provide significant reduction in vertebral fracture risk: results from the BONE study. Osteoporosis International. 2004;15(10). doi:10.1007/s00198-004-1602-9.
- Reginster J, Gieschke R. Clinical Utility of a Pharmacostatistical Model for Ibandronate in Postmenopausal Osteoporosis. CDM. 2006;7(7):827-836. doi:10.2174/138920006778520624.
- Krege J, Lane N, Harris J, Miller P. PINP as a biological response marker during teriparatide treatment for osteoporosis. Osteoporosis International. 2014;25(9):2159-2171. doi:10.1007/s00198-014-2646-0.
- Bauer D, Garnero P, Hochberg M et al. Pretreatment Levels of Bone Turnover and the Antifracture Efficacy of Alendronate: The Fracture Intervention Trial. J Bone Miner Res. 2005;21(2):292-299. doi:10.1359/jbmr.051018.
- Seibel M, Naganathan V, Barton I, Grauer A. Relationship Between Pretreatment Bone Resorption and Vertebral Fracture Incidence in Postmenopausal Osteoporotic Women Treated With Risedronate. J Bone Miner Res. 2003;19(2):323-329. doi:10.1359/jbmr.0301231.
- Genant H, Wu C, van Kuijk C, Nevitt M. Vertebral fracture assessment using a semiquantitative technique. J Bone Miner Res. 1993;8(9):1137-1148. doi:10.1002/jbmr.5650080915.
- Genant H.K., Jergas M. Assessment of prevalent and incident vertebral fractures in osteoporosis research. Osteoporosis Int. 2003;14(3):43–55.
- Zhao JG, Zeng XT, Wang J, Liu L. Association between calcium or vitamin D supplementation and fracture incidence in community-dwelling older adults: a systematic review and meta-analysis. JAMA. 2017;318(24):2466-2482. doi:10.1001/jama.2017.19344
- Ponzano M, Rodrigues IB, Hosseini Z, et al. Progressive resistance training for improving health-related outcomes in people at risk of fracture: a systematic review and meta-analysis of randomized controlled trials. Phys Ther. 2021;101(2):pzaa221. doi:10.1093/ptj/pzaa221
- Sherrington C, Fairhall NJ, Wallbank GK, et al. Exercise for preventing falls in older people living in the community. Cochrane Database Syst Rev. 2019;1(1):CD012424. doi:10.1002/14651858.CD012424.pub2
- Baber R, Panay N, Fenton A. 2016 IMS Recommendations on women’s midlife health and menopause hormone therapy. Climacteric. 2016;19(2):109-150. doi:10.3109/13697137.2015.1129166.
- Rossouw JE, Anderson GL, Prentice RL, et al. Writing Group for the Women’s Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principle results from the Women’s Health Initiative randomized controlled trial. JAMA. 2002;288(3):321-333.
- T.J. de Villiers, J.E. Hall, J.V. Pinkerton, S. Cerdas Perez, M. Rees, C. Yang, D.D. Pierroz Revised global Consensus Statement on Menopausal Hormone Therapy. J. Climacteric 2016 19:4; 313-315
Автор статьи
Статьи по теме Ревматология
Статьи по теме Эндокринология
Болезни в статье:
- S72.0 Перелом шейки бедра
- N95 Нарушения менопаузы и другие нарушения в околоменопаузном периоде
- E55 Недостаточность витамина D
- E83.5 Нарушения обмена кальция
- M06.9 Ревматоидный артрит неуточненный
- K50-K52 Неинфекционный энтерит и колит
- K70-K77 Болезни печени
- N18 Хроническая почечная недостаточность
- S52.5 Перелом нижнего конца лучевой кости
- S42 Перелом на уровне плечевого пояса и плеча
- S32 Перелом пояснично-крестцового отдела позвоночника и костей таза
- S62 Перелом на уровне запястья и кисти
- S92 Перелом стопы, исключая перелом голеностопного сустава
- S02 Перелом черепа и лицевых костей
- M15-M19 Артрозы
- E83.5.0* Гиперкальциемия
- D50-D89 КЛАСС III Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм
- E10-E14 Сахарный диабет
- M87 Остеонекроз
- C50 Злокачественные новообразования молочной железы
- C61 Злокачественное новообразование предстательной железы
- N20 Камни почки и мочеточника
- I21 Острый инфаркт миокарда
- R40.2 Кома неуточненная
- N90.5 Атрофия вульвы
- N85 Другие невоспалительные болезни матки, за исключением шейки матки
- C54 Злокачественное новообразование тела матки
- I20-I25 Ишемическая болезнь сердца
- I82 Эмболия и тромбоз других вен
- I26 Легочная эмболия
Оцените статью:
- Остеопороз
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
остеопороз
системный остеопороз, остеопороз, остеопорозом, связанным с иммобилизацией, выраженный остеопороз, Остеопороз, обусловленный иммобилизацией, Остеопороз, обусловленный длительной иммобилизацией, иммобилизованных пациентов с остеопорозом,, остеопорозом, иммобилизационным остеопорозом, остеопорозе, установленным диагнозом остеопороза,


