- Эпидемиология
- Анатомия пищевода
- Сужения пищевода
- Отделы и сегменты пищевода
- Кровоснабжение пищевода
- Лимфатические образования пищевода
- Иннервация пищевода
- Гистологическое строение стенки пищевода
- Международная классификация опухолей пищевода
- Предрасполагающие факторы возникновения рака пищевода
- Предраковые заболевания
- Пищевод Барретта — облигатный предрак
- Пути распространения рака пищевода
- Диагностика рака пищевода
- Клиническая картина
- Методы комплексной диагностики рака пищевода
- Классификация рака пищевода
- Анатомические области и части
- Регионарные лимфатические узлы
- TNM клиническая классификация
- Классификация сторожевого лимфатического узла
- Хирургическое лечение
C15 Злокачественное новообразование пищевода, МКБ-10
- C15.0 Шейного отдела пищевода
- C15.1 Грудного отдела пищевода
- C15.2 Абдоминального отдела пищевода
- C15.3 Верхней трети пищевода
- C15.4 Средней трети пищевода
- C15.5 Нижней трети пищевода
- C15.8 Поражение пищевода, выходящее за пределы одной и более вышеуказанных локализаций
- C15.9 Пищевода неуточненное
Отредактировано: 02.04.2024
д.м.н., проф. Стилиди И.С.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Эпидемиология. Анатомия пищевода. Иннервация пищевода. Гистологическое строение стенки пищевода. Международная классификация опухолей пищевода. Предрасполагающие факторы возникновения рака пищевода. Предраковые заболевания. Пути распространения рака пищевода. Диагностика рака пищевода. Методы комплексной диагностики рака пищевода. Классификация рака пищевода. Методы лечения больных раком грудного отдела пищевода. Морфологическое исследование удаленного органокомплекса. Оперативные доступы. Варианты эзофагопластики. Пути проведения трансплантата. Пищеводно-желудочный анастомоз и уровень его формирования. Результаты лечения. Симптоматические эндоскопические пособия. Симптоматические операции. Хирургическое лечение злокачественной пищеводной фистулы. Комбинированное лечени
Эпидемиология
Рак пищевода занимает 6 место в структуре заболеваемости злокачественными опухолями в мире. В 2000 г. было зарегистрировано 412 тыс. случаев заболевания. В том же году от рака пищевода умерло 337 тыс. человек, что составляет 5,4% от общего количества смертей от всех злокачественных опухолей. Примерно 80% всех случаев заболевания диагностируются в развивающихся странах, а доминирующей гистологической формой патологии является плоскоклеточный рак. Аденокарцинома встречается, за редким исключением, только в индустриально развитых странах.
Для заболеваемости раком пищевода характерна выраженная географическая вариабельность. Самая высокая заболеваемость (>150 на 100 тыс. населения) отмечена в Иране и других странах т.н. Каспийского пояса (в некоторых районах Туркменистана, Казахстана, Каракалпакии, прилегающих к Каспийскому морю), в центральных районах и на севере Китая. Кроме того, высокая заболеваемость регистрируется в Южной Америке и некоторых регионах Африки, причем в этих регионах заболеваемость очень высока без гендерных ограничений.
Показатели смертности от рака пищевода близки к показателям заболеваемости. Причиной этого феномена является исключительно неблагоприятный прогноз заболевания. 5-летняя популяционная выживаемость раком пищевода колеблется от 5% в Европе до 10% в США и не имеет тенденции к улучшению.
В России рак пищевода составляет 3% всех злокачественных новообразований и занимает 14 место в структуре онкозаболеваемости. В структуре смертности — 7 место для мужчин и 13 для женщин. Стандартизованный показатель заболеваемости составляет 6,7 на 100 тыс. населения. Соотношение мужчин и женщин — 3:1. Наиболее высокая заболеваемость раком пищевода зарегистрирована в возрастном интервале от 50 до 60 лет.
За последнее десятилетие в мире отмечено снижение заболеваемости раком пищевода с 3,4 до 2,8 на 100 тыс. населения. Подобная тенденция зарегистрирована также и в России. Однако в ряде развитых стран за последние годы наметился рост заболеваемости аденокарциномой нижнегрудного отдела пищевода (по данным ряда регистров, составляет более 40% всех случаев рака пищевода). В то же время, по данным отечественных авторов, в 93% случаев встречается плоскоклеточный рак.
Анатомия пищевода
Пищевод — полая мышечная трубка, соединяющая глотку с желудком. Начинается пищевод продолжением глотки на уровне СVI и дуги перстневидного хряща. Расстояние от верхних передних резцов до начала пищевода 15–18 см (т.н. “рот пищевода”). Длина пищевода зависит от конституционального типа и составляет в среднем 26 см (23–29 см). В отличие от общего строения пищеварительной трубки, пищевод не имеет брыжейки и серозной оболочки. На всем протяжении пищевод окружен рыхлой соединительной тканью и может свободно смещаться в продольном и поперечном направлениях. Так, во время дыхательных движений пищевод смещается на несколько миллиметров от своей оси, а при глотании — на высоту тела позвонка.
Сужения пищевода
Первое сужение расположено у места перехода глотки в пищевод (“рот пищевода”), второе — у места пересечения с дугой аорты, третье — между ножками диафрагмы. Между перечисленными сужениями имеются два расширения. Некоторые авторы выделяют четвертое сужение, которое образуется за счет давления на переднюю стенку пищевода левого главного бронха.
Два сужения — вход в пищевод и вход в желудок — являются истинно физиологическими, в то время как аортальное и бронхиальное являются результатом механической компрессии стенки пищевода соседними анатомическими структурами.
Отделы и сегменты пищевода
Согласно клинико-анатомической классификации пищевод разделен на 5 отделов: шейный, верхнегрудной, среднегрудной, нижнегрудной и брюшной.
Клиницисты дополнительно различают сегменты пищевода: трахеальный, аортальный, бронхиальный, подбронхиальный, ретроперикардиальный, наддиафрагмальный, внутридиафрагмальный, брюшной или абдоминальный.
Чаще рак возникает в среднегрудном отделе пищевода (66,2%). В нижнегрудном и брюшном отделах опухоли встречаются в 24,3% случаев. Относительно редкой является локализация в верхнегрудном и шейном отделах — 9,5%.
Кровоснабжение пищевода
Артерии пищевода
Источники артериального кровоснабжения пищевода, их количество и топография вариабельны. Учитывая этот факт, целесообразно отдельно рассмотреть сосудистую анатомию шейного, грудного и абдоминального отделов. Необходимо также отметить сегментарный принцип артериального кровоснабжения пищевода.
Основными артериями, участвующими в кровоснабжении шейного отдела пищевода являются ветви правой и левой нижних щитовидных артерий из системы щито-шейного ствола (tr. thyrocervicalis). Артерий обычно 2–3, они проходят кпереди от возвратных гортанных нервов и делятся на более мелкие ветви. Также к шейному отделу пищевода могут отходить ветви от a. thyreoidea ima и непосредственно от общей сонной и начальных отделов подключичной артерий.
Кровоснабжение верхнегрудного отдела пищевода осуществляется в основном из правой и левой нижних щитовидных артерий, а также непосредственно из щито-шейного ствола и, частично, мелкими ветвями от правой и левой подключичных артерий. Следовательно, основными артериями верхней трети пищевода являются те же нижние щитовидные артерии. Они располагаются на правой и левой стенках пищевода и на уровне ThII-ThIII распадаются на мелкие ветви, которые проникают в стенку органа.
Артерии средней трети грудного отдела пищевода отходят от бронхиальных и первой, реже второй, правой межреберной артерий. Количество и степень развития бронхиальных артерий непостоянны. Ветви к средней трети пищевода одинаково часто отходят от правых и от левых бронхиальных артерий, либо возникают из их общего ствола. Иногда к этому отделу пищевода подходят короткие пищеводные артерии непосредственно от дуги аорты.
Нижнегрудной отдел пищевода
Из всех отделов наиболее скудное кровоснабжение получает нижнегрудной, в основном — от 2–5 собственно пищеводных артерий (верхних средних и нижних), начинающихся непосредственно от нисходящего отдела грудной аорты, а также от ветвей третьей, четвертой, пятой и шестой правых межреберных артерий. Средние пищеводные артерии отходят от передней полуокружности аорты на уровне ThVI-ThVII, они крайне непостоянны и играют роль дополнительных источников кровоснабжения. Наиболее часто встречается нижняя пищеводная артерия. Она отходит от переднеправой поверхности аорты на уровне позвонков ThVIII-ThIX. Ниже отхождения нижней пищеводной артерии к пищеводу обычно не подходит ни одна из ветвей аорты.
Источниками артериального кровоснабжения внутридиафрагмального и абдоминального отделов пищевода являются ветви левой желудочной и левой нижней диафрагмальной артерий, а иногда и веточки добавочной артерии к левой доле печени. Между этими артериями имеются в той или иной степени выраженные соустья.
Вены пищевода
Венозное кровообращение пищевода отличается от артериального. Принято различать внутриорганную или собственную венозную систему, представленную венозными сплетениями и сетями, и экстраорганную, в виде наружных венозных стволов. Венозные сети находятся на всем протяжении пищевода, в то время как венозные сплетения расположены в местах физиологических сужений. Важной частью венозного кровообращения пищевода является подслизистая венозная сеть, в пределах которой расположены крупные венозные сплетения.
Из интрамурального венозного сплетения по перфорантным венозным стволикам кровь сбрасывается в наружное венозное сплетение и далее в более крупные вены, как правило, сопровождающие одноименные артерии.
От шейного и, частично, от верхнегрудного отделов пищевода отток крови осуществляется во внутренние яремные, верхние и нижние щитовидные вены, а также в венозное сплетение щитовидной железы. Кровь от верхне- и среднегрудного отделов пищевода оттекает в непарную и полунепарную вены, т.е. в систему ВПВ и, кроме того, через анастомозы с диафрагмальными венами — в систему НПВ. Венозная кровь от нижней трети грудного отдела пищевода и от абдоминального отдела посредством анастомозов с венами желудка и селезенки в систему воротной вены.
Таким образом, в нижнем отделе пищевода венозное кровообращение представлено важнейшей сетью межсистемных (кава-кавальных и порто-кавальных) анастомозов.
Лимфатические образования пищевода
Лимфатическая система пищевода представлена внутриорганными лимфатическими сплетениями, грудным лимфатическим протоком и лимфатическими узлами. Все исследователи отмечают наличие богатой слизисто-подслизистой лимфатической сети, а также разветвленной сети лимфатических сосудов между циркулярными и продольными слоями мышц.
Топография интрамуральных лимфатических сплетений играет существенную роль в лимфодинамике пищевода. С практической точки зрения важным является наличие прямой связи внутристеночных лимфатических образований пищевода с лимфатической системой желудка.
Особый интерес представляют:
— пути оттока лимфы от стенки различных отделов пищевода;
— топография лимфатических узлов;
— связь лимфатической системы пищевода и соседних органов — желудка, легких, трахеи, щитовидной железы и др.
Отводящие лимфатические сосуды формируются из слияния отдельных стволиков перечисленных выше интрамуральных сетей. Отток лимфы по этим сосудам возможен как в краниальном, так и в каудальном направлениях.
В лимфатических сосудах имеются клапаны, регулирующие направление тока лимфы. По отводящим лимфатическим сосудам часть лимфы оттекает в регионарные лимфатические узлы, а часть — непосредственно в грудной лимфатический проток. Учитывая расположение пищевода в трех анатомических областях (шея, грудь и живот), различные отделы пищевода имеют собственные регионарные лимфатические узлы.
Иннервация пищевода
Нервная регуляция пищевода представлена сложной системой. Выявлено наличие множества связей между правыми и левыми блуждающими нервами, а также наличие тесной связи иннервации пищевода и соседних анатомических структур.
Различают экстрамуральную (внеорганные нервы) и интрамуральную (внутристеночные сплетения и нервные волокна) части нервной системы пищевода. Вегетативная нервная система регулирует функцию пищевода посредством иннервации гладкой и поперечной мускулатуры, работы желез и поддержания тонуса сосудов. Иннервирующие пищевод стволы относятся к смешанному типу и содержат афферентные и эфферентные волокна. Основными источниками иннервации пищевода являются блуждающие нервы и пограничные стволы симпатических нервов. Симпатическая и парасимпатическая нервные системы являются функциональными антагонистами.
Гистологическое строение стенки пищевода
Стенка пищевода состоит из четырех оболочек:
1) слизистая;
2) подслизистая;
3) мышечная
4) адвентиция.
Слизистая оболочка состоит из трех слоев:
а) эпителиальная выстилка;
б) собственная пластинка, лежащая под эпителиальной выстилкой;
в) мышечная пластинка слизистой.
Эпителиальная выстилка представлена неороговевающим многослойным плоским эпителием, который располагается на собственной пластинке слизистой. В глубоких слоях эпителия происходит деление клеток. При этом клетки, смещаясь к просвету органа, теряют свою способность к делению и слущиваются в просвет пищевода.
Собственная пластинка слизистой состоит из рыхлой волокнистой соединительной ткани, которая с одной стороны выполняет опорную функцию по отношению к эпителию, а с другой — соединяет его с мышечной пластинкой. Собственная пластинка слизистой оболочки подводит кровеносные и лимфатические сосуды близко к эпителию.
Мышечная пластинка слизистой — третий самый наружный слой слизистой, который обеспечивает ограниченные локальные движения слизистой оболочки.
Подслизистая основа слизистой оболочки соединяет слизистую оболочку с мышечной и состоит из рыхлой соединительной ткани, содержащей сплетения более крупных кровеносных сосудов. В подслизистой основе располагается небольшое количество желез, которые называются железами пищевода. Вблизи желудка, в собственной пластинке, встречаются единичные железы аналогичные железам кардиального отдела желудка, их называют кардиальными железами.
Мышечная оболочка в верхней части пищевода представляет собой поперечно-полосатую мышечную ткань, которая распространяется сюда с глотки. Однако уже в средней части пищевода начинают появляться гладкомышечные волокна, которые замещают поперечно-полосатые, и в нижней части пищевода практически вся мышечная оболочка состоит из гладкомышечной ткани.
Внутренний мышечный слой является циркулярным, а наружный — продольным. Поперечно-полосатая мышечная ткань пищевода иннервируется в основном парасимпатическими волокнами блуждающего нерва, поэтому проглатывание пищи является частично непроизвольным рефлекторным актом, который запускается при стимуляции эфферентных нервных окончаний, расположенных преимущественно в задней стенке глотки.
Адвентиция пищевода образована рыхлой соединительной тканью, связывающей пищевод с соседними органами.
Международная классификация опухолей пищевода
Опухоли пищевода подразделяются на доброкачественные и злокачественные. И те, и другие могут быть эпителиального и неэпителиального происхождения.
Международная гистологическая классификация опухолей пищевода и желудка 1990 г.
1. Эпителиальные опухоли
1.1. Доброкачественные опухоли
1.1.1. Плоскоклеточная папиллома
1.1.2. Вирусная бородавка
1.1.3. Аденома
1.2. Злокачественные опухоли
1.2.1. Плоскоклеточный рак
1.2.2. Веррукозная (плоскоклеточная карцинома)
1.2.3. Веретеноклеточная карцинома
1.2.4. Аденокарцинома
1.2.5. Железисто-плоскоклеточная карцинома
1.2.6. Мукоэпидермоидная карцинома
1.2.7. Аденоиднокистозная карцинома (цилиндрома)
1.2.8. Мелкоклеточная карцинома
1.2.9. Низкодифференцированная карцинома
1.2.10. Другие
2. Неэпителиальные опухоли
2.1. Доброкачественные
2.1.1. Лейомиома
2.1.2. Липома
2.1.3. Сосудистые опухоли
2.1.4. Нейрогенные опухоли
2.1.4.1. Зернистоклеточная опухоль
2.1.4.2. Другие
2.2. Злокачественные опухоли
2.2.1. Лейомиосаркома
2.2.2. Саркома Капоши
2.2.3. Другие
3. Смешанные опухоли
3.1. Карциносаркома
3.2. Злокачественная меланома
3.3. Другие
3.3.1. Карциноидная опухоль
3.3.2. Злокачественная лимфома
4. Вторичные опухоли
5. Опухолеподобного изменения
5.1. Фиброваскулярный (фиброзный) полип
5.2. Кисты
5.2.1. Врожденные кисты
5.2.2. Ретенционные кисты
5.3. Воспалительный полип
5.4. Гликогеновый акантоз
5.5. Диффузный лейомиоматоз
5.6. Желудочная гетеротопия
6. Эпителиальные нарушения (предраки)
6.1. Дисплазия и карцинома in situ в плоскоклеточном эпителии
6.2. Пищевод Барретта
6.3. Дисплазия в цилиндрическом эпителии (при пищеводе Барретта)
Предрасполагающие факторы возникновения рака пищевода
Частота возникновения рака пищевода зависит от особенностей образа жизни и питания населения страны или области.
Предрасполагает к развитию рака пищевода употребление горячей, острой и грубой пищи с недостатком витаминов (ретинол, рибофлавин) и микроэлементов (медь, цинк, железо), особенно в сочетании с курением и употреблением крепких спиртных напитков. В ряде случаев возникновению злокачественных новообразований в пищеводе способствуют высокая минерализация и засоленность питьевой воды.
Врожденные аномалии — тилоз (гиперкератоз ладоней и стоп) и синдром Пламмера-Винсона (железодефицитная анемия, атрофия слизистых, гипохлоргидрия, дисфагия) — также признаны предрасполагающими факторами.
Предраковые заболевания
К ним относят хронический эзофагит, рубцовые стриктуры, язвы, полипы и пищевод Барретта. Особое место занимает дисплазия. Слабовыраженные диспластические изменения могут нарастать вплоть до возникновения carcinoma in situ. Инвазивный рак пищевода может развиваться как через стадию рака in situ, так и непосредственно из очагов дисплазии.
Пищевод Барретта — облигатный предрак
Пищевод Барретта — приобретенное патологическое состояние, характеризующееся метапластическим замещением плоскоклеточного эпителия пищевода на железистый с формированием структур, соответствующих слизистой оболочке желудка, нередко — с явлениями кишечной метаплазии.
Пищевод Барретта развивается у 20% пациентов с хроническим гастроэзофагеальным рефлюксом. Риск злокачественной трансформации составляет более 50%. Почти все аденокарциномы пищевода развиваются из пищевода Барретта. К предрасполагающим факторам относятся: грыжа пищеводного отверстия диафрагмы и хронический гастроэзофагеальный рефлюкс.
Пути распространения рака пищевода
- Местный — прорастание стенки пищевода с врастанием в прилежащие структуры (гортань, трахею, бронхи, паренхиму легких, блуждающие и возвратные гортанные нервы, магистральные сосуды, перикард, сердце и т.д.).
- Гематогенное метастазирование (печень, легкие, почки и надпочечники, кости).
- Лимфогенное метастазирование — основной путь распространения для рака пищевода.
Высокий потенциал лимфогенного метастазирования рака пищевода является следствием строения лимфоаппарата пищевода. Уже при инвазии опухолью подслизистого слоя у 40% пациентов выявляются метастазы в регионарные лимфатические узлы. Прорастание мышечного слоя влечет за собой метастатическое поражение лимфоузлов в 80% случаев.
Лимфа по сосудам проходит через барьер лимфатических узлов. В соответствии с классификацией Японского общества по изучению рака желудка и пищевода (1976) каждая группа таких лимфоузлов обладает собственным номером и названием.
А. Интраабдоминальные лимфатические узлы
1) правые паракардиальные лимфатические узлы
2) левые паракардиальные лимфатические узлы
3) лимфатические узлы малой кривизны желудка
4) лимфатические узлы большой кривизны желудка
4s — лимфатические узлы вдоль левой желудочно-сальниковой артерии и коротких артерий желудка (левая группа)
4d — лимфатические узлы вдоль правой желудочно-сальниковой артерии
5) супрапилорические лимфатические узлы (правая группа)
6) субпилорические лимфатические узлы
7) лимфатические узлы левой желудочной артерии
8) лимфатические узлы общей печеночной артерии
9) чревные лимфатические узлы (у начальных отделов левой желудочной артерии, селезеночной и общей печеночной артерии)
10) лимфатические узлы ворот селезенки
11) лимфатические узлы селезеночной артерии
12) лимфатические узлы гепатодуоденальной связки
13) ретропанкреатодуоденальные лимфатические узлы
14) лимфатические узлы в корне брыжейки тонкой кишки (в области начального отдела верхне-брыжеечной артерии и вены)
15) лимфатические узлы средней толстокишечной артерии
16) парааортальные лимфатические узлы
Б. Интраторакальные и шейные лимфатические узлы
100) латеральные шейные лимфатические узлы
101) шейные параэзофагеальные лимфатические узлы
102) глубокие шейные лимфатические узлы
103) позадиглоточные лимфатические узлы
104) надключичные лимфатические узлы
105) верхние торакальные параэзофагеальные лимфатические узлы
106) торакальные паратрахеальные лимфатические узлы
107) бифуркационные лимфатические узлы
108) среднегрудные параэзофагеальные лимфатические узлы
109) лимфатические узлы ворот легких
110) нижнегрудные параэзофагеальные лимфатические узлы
111) диафрагмальные лимфатические узлы
112) задние медиастинальные лимфатические узлы
Частота обнаружения метастазов в различных анатомических группах лимфатических узлов связана также с локализацией опухоли в пищеводе (рис. 1).
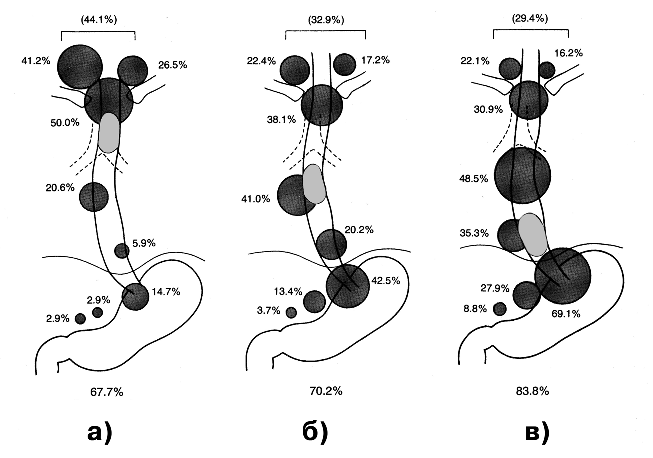
Рисунок 1. Частота метастазирования в регионарные лимфатические узлы при раке шейного (а), среднегрудного (б) и нижнегрудного (в) отделов пищевода
Так, опухоли средне- и верхнегрудного отделов наиболее часто метастазируют в лимфоузлы средостения и надключичной области. Метастазы в перигастральных и забрюшинных лимфатических коллекторах чаще встречаются при поражении нижнегрудного отдела. Тем не менее вследствие указанных выше особенностей строения интрамуральной лимфатической сети при любом уровне поражения пищевода метастазы могут обнаруживаться в самых различных группах лимфоколлекторов. “Прыгающие метастазы” (skip metastasis) по данным различных авторов зафиксированы в 30% случаев. Доказана также возможность ретроградного тока лимфы. Поэтому при раке пищевода не удается создать хотя бы приблизительную схему этапности лимфогенного метастазирования, похожую на таковую при раке желудка. И каждая группа регионарных лимфатических узлов, с крайне высокой степенью вероятности, может служить мишенью для поражения опухолевыми клетками.
Диагностика рака пищевода
Клиническая картина
Как правило, первым и основным симптомом рака пищевода является дисфагия.
Выделяют 4 степени дисфагии:
1 степень — затруднено прохождение по пищеводу твердой пищи;
2 степень — полужидкой пищи;
3 степень — жидкости;
4 степень (полная дисфагия) — абсолютная обтурация просвета пищевода.
Часто затруднение прохождения пищи по пищеводу сопровождается гиперсаливацией.
В последующем, по мере прогрессивного развития опухолевого процесса в клинической картине проявляются: боли за грудиной и в межлопаточной области (не связанные с приемом пищи), осиплость, а также симптомы, связанные с формированием злокачественной пищеводной фистулы. Последние свидетельствуют о выходе опухоли за пределы стенки органа.
В терминальной фазе заболевания присоединяются различные проявления метастатического процесса в других органах (печень, легкие, кости и т.д.).
Клинические симптомы доброкачественных опухолей, неопухолевых заболеваний и рака пищевода практически идентичны. В связи с этим диагностика заболеваний пищевода должна базироваться на комплексном обследовании.
Методы комплексной диагностики рака пищевода
- Рентгенография пищевода и желудка.
- Эндоскопическое исследование пищевода, желудка и трахеобронхиального дерева.
- УЗКТ органов брюшной полости, забрюшинного пространства и шейнонадключичных зон.
- РКТ органов грудной полости и средостения.
- МРТ средостения и шеи.
- Эндосонография пищевода и желудка.
- ПЭТ.
- Морфологическое исследование.
Рентгенография пищевода и желудка
Всем больным проводится рентгеноскопия и рентгенография в прямой и в двух косых проекциях в вертикальном положении с использованием взвеси бария сульфата (см. рис. 2б на цветной вклейке). Исследование позволяет выявить поражение стенки пищевода и определить его протяженность, уровень, а также степень обтурации просвета пищевода.
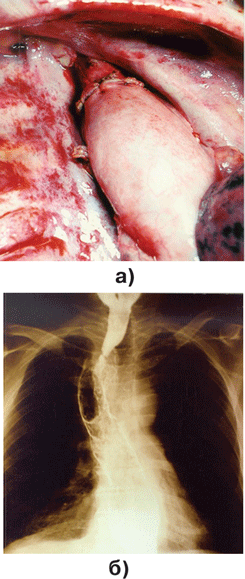
Рисунок 2. Формирование пищеводно-желудочного анастомоза в куполе правой плевральной полости (а) и рентгенограмма контрастированного пищеводно-желудочного анастомоза (б)
Эндоскопическое исследование пищевода, желудка и трахеобронхиального дерева
Определяются уровень и протяженность опухолевого поражения пищевода, проксимальная граница его от передних резцов в сантиметрах и распространение на смежные структуры (глотка, гортань и желудок). Чрезвычайно важной и информативной следует признать процедуру окраски слизистой пищевода 2% раствором Люголя, что позволяет выявить либо исключить отсевы на непораженной первичной опухолью слизистой. Этот факт в значительной мере может повлиять на хирургическую тактику.
В отечественной литературе выделяют узловую, инфильтративную, инфильтративно-язвенную и смешанную формы роста опухоли.
Трахеобронхоскопия, включая ларингоскопию, определяет взаимосвязь первичной опухоли с нижними отделами воздухоносных путей — сдавление трахеи и бронхов извне, а также прорастание опухолью слизистой оболочки данных структур. Это исследование дает возможность косвенно судить о состоянии регионарного лимфатического аппарата. При необходимости рекомендуется использовать в сочетании щипцовую и пункционную биопсии, эксцизионную и брашпиопсию.
УЗКТ
Задачей УЗКТ органов брюшной полости, забрюшинного пространства и шейно-надключичных зон является выявление метастатического поражения лимфоузлов в соответствующих анатомических областях, а также отдаленных метастазов в печени и почках.
МРТ, РКТ
Задачи РКТ и МРТ — выявление распространения опухоли пищевода на соседние анатомические структуры (аорта, позвоночник, легкие, сердце и т.д.) и метастатического поражения шейных и медиастинальных лимфатических узлов и паренхимы легких.
Внутриполостная эхография (эндосонография)
Позволяет оценить глубину инвазии опухолью стенки пищевода с возможным внеорганным ее распространением, а также состояние параэзофагеальных и перигастральных лимфоузлов.
ПЭТ
Используется для стадирования заболевания и планирования тактики лечения на основании оценки состояния лимфатических узлов и выявления рецидива заболевания.
Классификация рака пищевода
Главная цель системы стадирования злокачественных опухолей заключается в прогнозировании выживаемости на основании высоко значимых параметров анатомического распространения опухоли. Стадирование, кроме того, суммирует информацию, определяющую адекватную тактику лечения. Последнее, 6 издание UICC TNM классификации 2002 г. (Sobin L.H., Witekind Ch., 2002) базируется на критериях Т, N и M, прогрессия которых связана с ухудшением показателей выживаемости. Классификация применима только для рака и предусматривает обязательную морфологическую верификацию опухоли и ее гистологический тип. Основные положения UICC TNM системы стадирования 2002 г. приведены ниже.
Анатомические области и части
1. Шейный отдел пищевода (С15.0): начинается от уровня нижнего края перстневидного хряща и заканчивается на уровне яремной вырезки. Дистальная граница около 18 см от верхних резцов.
2. Внутригрудной отдел пищевода:
а) верхнегрудной отдел (С15.3): начинается от уровня яремной вырезки и заканчивается на уровне бифуркации трахеи. Дистальная граница около 24 см от верхних резцов;
б) среднегрудной отдел (С15.4): занимает верхнюю половину дистанции между бифуркацией трахеи и пищеводно-желудочным переходом. Дистальная граница около 32 см от верхних резцов;
в) нижнегрудной отдел (С15.5): около 8 см длиной (включая абдоминальный отдел) — занимает нижнюю половину дистанции между бифуркацией трахеи и пищеводно-желудочным переходом. Дистальная граница около 40 см от верхних резцов.
Регионарные лимфатические узлы
Регионарными лимфоузлами для шейного отдела пищевода считаются шейные, включая надключичные. Для внутригрудного отдела пищевода — медиастинальные и перигастральные лимфоузлы, исключая чревные.
TNM клиническая классификация
В новой UICC TNM классификации рака пищевода 2002 г. по сравнению с предыдущей, 1997 г., идентификаторы анатомической распространенности опухоли и стадирование изменены не были.
Критерий Т — первичная опухоль:
Tx — недостаточно данных для оценки первичной опухоли;
T0 — опухоль не определяется;
Tis — преинвазивная карцинома;
T1 — опухолевая инфильтрация распространяется до подслизистого слоя;
T2 — опухолевая инфильтрация распространяется до мышечного слоя;
T3 — опухолевая инфильтрация распространяется до адвентиции;
T4 — опухолевая инфильтрация распространяется на смежные с пищеводом структуры.
Критерий N — регионарные лимфатические лимфоузлы:
Nx — недостаточно данных для оценки регионарных лимфоузлов;
N0 — отсутствие метастазов в регионарных лимфоузлах;
N1 — наличие метастазов в регионарных лимфоузлах.
Критерий М — отдаленные метастазы:
Mx — недостаточно данных для оценки отдаленных метастазов;
M0 — отсутствие отдаленных метастазов;
M1 — наличие отдаленных метастазов;
Для опухолей верхнегрудного отдела пищевода:
M1a — метастазы в шейных лимфоузлах;
M1b — другие отдаленные метастазы.
Для опухолей среднегрудного отдела пищевода:
M1a — в классификации не определены;
M1b — метастазы в нерегионарных лимфоузлах и отдаленных органах.
Для опухолей нижнегрудного отдела пищевода:
M1a — метастазы в чревных лимфоузлах;
M1b — другие отдаленные метастазы.
рN — оценивается после гистологического исследования не менее 6 медиастинальных лимфоузлов.
G — гистопатологическая дифференцировка:
G — недостаточно данных для оценки степени дифференцировки опухоли;
G1 — высокодифференцированный рак;
G2 — умеренно дифференцированный рак;
G3 — низкодифференцированный рак;
G4 — недифференцированный рак.
R — резидуальная опухоль (оценивается после проведенного лечения):
Rx — недостаточно данных для оценки резидуальной опухоли;
R0 — резидуальная опухоль отсутствует;
R1 — резидуальная опухоль определяется только микроскопически;
R2 — резидуальная опухоль определяется макроскопически.
Таблица 1
Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | T1 | N0 | M0 |
| Стадия IIa | T2 | N0 | M0 |
| T3 | N0 | M0 | |
| Стадия IIb | T1 | N1 | M0 |
| T2 | N1 | M0 | |
| Стадия III | T3 | N1 | M0 |
| T4 | Любая N | M0 | |
| Стадия IVa | Любая T | Любая N | M1a |
| Стадия IVb | Любая T | Любая N | M1b |
В шестом издании классификации UICC TNM введены новые понятия:
Сторожевой лимфатический узел — ближайший к первичной опухоли лимфатический узел. Индикация сторожевого лимфоузла проводится путем лимфографии или при радиоизотопном исследовании.
Классификация сторожевого лимфатического узла
pNx (sn) — сторожевой лимфоузел не оценивался;
pN0 (sn) — отсутствие метастазов в сторожевом лимфоузле;
pNx (sn) — наличие метастазов в сторожевом лимфоузле.
Изолированные опухолевые клетки в лимфатических узлах и отдаленных органах — это отдельные опухолевые клетки или группы клеток размером не более 0,2 мм. Индикация изолированных опухолевых клеток проводится путем стандартной микроскопии, иммуногистохимическими и молекулярными методами исследования. Изолированные опухолевые клетки не обладают метастатической активностью, не инвазируют стенку кровеносных и лимфатических сосудов. Наличие изолированных опухолевых клеток классифицируется как N0 или M0.
pN0 — гистологически верифицированные лимфогенные метастазы отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток не проводились;
pN0 (i-) — гистологически верифицированные лимфогенные метастазы отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 (i+) — гистологически верифицированные лимфогенные метастазы отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток положительные;
pN0 (mol-) — гистологически верифицированные лимфогенные метастазы отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 (mol+) — гистологически верифицированные лимфогенные метастазы отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток положительные.
При исследовании сторожевых лимфоузлов на наличие изолированных опухолевых клеток используется следующая классификация:
pN0 (i-)(sn) — гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 (i+)(sn) — гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, гистологические тесты на наличие изолированных опухолевых клеток положительные;
pN0 (mol-)(sn) — гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток отрицательные;
pN0 (mol+)(sn) — гистологически верифицированные метастазы в сторожевом лимфатическом узле отсутствуют, иммуногистохимические и молекулярные тесты на наличие изолированных опухолевых клеток положительные.
Хирургическое лечение
Низкая чувствительность к существующим химиопрепаратам, паллиативный и кратковременный эффект лучевой терапии делают хирургическое вмешательство основным методом в лечении больных раком грудного отдела пищевода.
Эволюция хирургии рака пищевода
В 1883 г. русский анатом И.И. Насилов обосновал на трупах внеплевральный доступ к пищеводу через заднее средостение с резекцией паравертебральных участков ребер. В 1900 г. В.Д. Добромыслов разработал в эксперименте на собаках трансплевральный доступ и выполнил циркулярную резекцию пищевода с последующим анастомозом “конец в конец”. F. Torek в 1913 г. из доступа по Добромыслову произвел в клинике чресплевральную резекцию грудного отдела пищевода при раке. Операция закончилась формированием эзофагостомы на шее и гастростомы на передней брюшной стенке. В том же году M. Denk в эксперименте на собаках разработал трансхиатальный (чрезбрюшинный или абдомино-цервикальный) доступ для резекции пищевода без вскрытия плевральных полостей. В 1929 г., использовав чрезбрюшинный (трансхиатальный) доступ, А.Г. Савиных под спинномозговой анестезией выполнил больному раком кардии гастрэктомию с резекцией 2,5 см пищевода и сформировал эзофаго-еюноанастомоз в средостении. В 1933 г. T. Ohsawa применил левосторонний косой торако-абдоминальный доступ при резекции кардии и нижнегрудного отдела пищевода с одномоментным внутригрудным анастомозом. В 1941 г. J. Garlock сообщил о своем удачном опыте подобных операций. 1946 г. — I. Lewis резецировал пищевод из комбинированного лапаротомного и правостороннего торакотомного доступа. В 1981 г. в Японии Y. Sannohe впервые продемонстрировал возможность радикального лечения больных раком пищевода, разработав и применив одномоментную трансторакальную экстирпацию пищевода с антеторакальным проведением желудочного трансплантата на шею с 3-зональной лимфодиссекцией (билатеральной шейной, расширенной медиастинальной и абдоминальной — 3F).
В СССР первые успешные операции при раке пищевода по методу Добромыслова—Торека описаны в 1945 г. В.И. Казанским, а первые чресплевральные резекции пищевода из торако-абдоминального доступа с одномоментным внутригрудным анастомозом выполнил Б.В. Петровский в 1946 г. В последующем появились сообщения об операциях при раке пищевода и кардиоэзофагеального перехода, выполненных в клиниках, руководителями которых являлись А.А. Вишневский, Б.С. Розанов, Е.Л. Березов, А.Н. Бакулев, П.А. Куприянов, Ф.Г. Углов и др.
Неудовлетворенность многоэтапными вмешательствами (операция Добромыслова—Торека) заставила хирургов совершенствовать оперативный метод и перейти к резекции пищевода с одномоментной эзофагопластикой. Такое вмешательство обладает бесспорными преимуществами с точки зрения косметического эффекта, функциональности и качества жизни пациентов. Кроме того, сравнительный анализ эффективности одномоментных и многоэтапных операций показал преимущество первых по показателям послеоперационной летальности (6,6%), завершенности лечения (98%) и отдаленным результатам (33% 5-летней выживаемости).
Литература
Давыдов М.И. Одномоментные операции в хирургическом и комбинированном лечении рака пищевода: Дис. ...докт. мед. наук.- М., 1988.
Давыдов М.И. и др. ...Анналы хирургии.- 1997.- № 1.- С. 46–53.
Akiyama H. Surgery for carcinoma of the esophagus.- Year Book Medical, 1990.
Altorki N.K. et al. ...J. thoracic cardiovasc. surg.- 1997.- V. 113 (3).- P. 538–544.
Bonavina L. ...Br. j. surg.- 1995.- V. 82 (1).- P. 98–110.
Collard J.M. ...Hepatogastroenterology.- 1995.- V. 42 (2).- P. 619–627.
Collard J.M. et al. ...Ann. thorac. surg.- 1995.- V. 60 (2).- P. 260–266.
Fujita H. et al. Prognostic factors in esophageal cancer: Retrospective evaluation of extended radical lymphadenectomy and adjuvant therapy//Diseases of the esophagus.- 1995.
Garlock F.J. et al. ...Ann. surg.- 1954.- V. 139.- P. 19–34.
Ide H. et al. Evaluation of lymph node dissection for thoracic esophageal cancer based on preoperative staging. In recent advances in diseases of the esophagus/ Eds. Peracchia A. Monduzzi. Editor selected papers of the VI World congress of the ISDE, 1995.- P. 377–383.
Isono K. et al. ...Dis. esophagus.- 1994.- V. 7.- P. 147–150.
Isono K. et al. ...Oncology.- 1992.- V. 48.- P. 411–420.
Japanese research society for esophageal carcinoma: Report of treatment results of esophageal carcinoma in Japan (1979–1982) № 10, National cancer center, Tokyo, 1990.
Kato H. ...Annales chirurgiae et gynaecologiae.- 1995.- V. 84 (2).- P. 193–199.
Kitamura M. et al. Optimal extent of lymph node dissection for thoracic esophageal cancer — is two field node dissection acceptable/Materials of the VII World congress of the International society for diseases of the esophagus, 1–4 september 1998.
Lewis I. ...Br. j. surg.- 1946.- V. 34.- P. 18–31.
Sato T. et al. Color atlas of surgical anatomy for esophageal cancer.- Springer-Verlag, 1992.
Segalin A. et al. ...Ann. thor. surg.- 1989.- V. 48 (2).- P. 267–271.
Siewert J.R. et al. ...Arch. chir.- 1985.- V. 366.- P. 233–239.
Siewert J.R. et al. ...Dis. esophagus.- 1992.- V. 5.- P. 91–97.
Siewert J.R. et al. ...Br. j. surg.- 1993.- V. 80.- P. 1015–1018.
Skinner D.B. ...Amer. j. surg.- 1980.- V. 139 (6).- P. 810–814.
Skinner D.B. et al. ...J. thorac. cardiovasc. surg.- 1983.- V. 85.- P. 59–71.
Takahashi T. et al. ...World j. surg.- 1995.- V. 19.- P. 565–569.
Watanabe H. Current results of the three-field versus two-field esophageal resection/Consensus lectern of the VII World congress of the International society for diseases of the esophagus, 1–4 september 1998.
Описание проверено экспертом
Оцените статью:
- Рак пищевода
- Стенозирующий рак пищевода
- Карцинома пищевода
- Опухоли пищевода
Пищевод Барретта
Рассказываем о причинах, симптомах и диагностике этого состояния. Кроме того, материал содержит информацию о методах лечения, включая эндоскопическую резекцию и радиочастотную абляцию.
Опубликовано на сайте: 11.05.24 | Обновлено на сайте: 11.05.24
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).




