- Эпидемиология и факторы риска экзокринного рака ПЖ
- Молекулярно-генетические и биологические особенности рака ПЖ
- Патологическая анатомия и особенности клинического течения злокачественных опухолей ПЖ
- Клинико-патологические особенности опухолей эндокринного происхождения
- Диагностика злокачественных опухолей ПЖ
C25 Злокачественное новообразование поджелудочной железы, МКБ-10
- C25.0 Головки поджелудочной железы
- C25.1 Тела поджелудочной железы
- C25.2 Хвоста поджелудочной железы
- C25.3 Протока поджелудочной железы
- C25.4 Островковых клеток поджелудочной железы
- C25.7 Других частей поджелудочной железы
- C25.8 Поражение поджелудочной железы, выходящее за пределы одной и более вышеуказанных локализаций
- C25.9 Поджелудочной железы неуточненное
Отредактировано: 02.04.2024
Эпидемиология и факторы риска экзокринного рака ПЖ
Экзокринные микроскопические формы рака абсолютно преобладают среди злокачественных опухолей органов билиопанкреатодуоденальной области. Относительная частота поражения экзокринным раком головки ПЖ среди других локализаций рака органов билиопанкреатодуоденальной области — 54–77,3% (Nakase A. et al., 1977; Блохин Н.Н. и др., 1982; Лапкин К.В. и др., 1991). По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, среди 1173 больных раком органов билиопанкреатодуоденальной зоны, наблюдавшихся с 1990 по 2002 гг., экзокринный рак ПЖ диагностирован у 765 (65,2%) пациентов.
Заболеваемость раком ПЖ как зависимая, так и независимая от возраста, неравномерна в различных странах мира. В странах Южной Европы, большинстве стран Азиатско-Тихоокеанского региона заболеваемость составляет 2,2–6 ежегодно выявляемых новых больных на 100 тыс. населения. В странах Северной Европы и среди небелого населения США заболеваемость достигает 11–12,5 человек на 100 тыс. населения. Среди белого населения США заболеваемость существенно ниже. Средний возраст заболевших раком ПЖ мужчин — 63–64 года, женщин — 68–69 лет. В среднем мужчины болеют раком ПЖ в 1,5–2 раза чаще, чем женщины. Особенная разница в заболеваемости среди мужчин и женщин отмечена в возрастных группах до 50 лет, в старших возрастных группах эта диссоциация уменьшается. Смертность по причине рака ПЖ в зависимости и независимо от возраста умерших больных демонстрирует похожие географические корреляции. Уровень смертности по причине рака ПЖ высок в Дании, Швеции, Финляндии, Ирландии, среди не белого населения США. В Германии, Норвегии, Великобритании колеблется от 8 до 10 мужчин и от 5 до 7 женщин на 100 тыс. мужского и женского населения соответственно. Аналогичный показатель среди мужчин и женщин Сингапура, Гонконга, Австралии, Испании, Португалии, Греции, Югославии — 4–6 человек на 100 тыс. мужского и женского населения в год (Tominaga S. et al., 1998).
В России заболеваемость раком ПЖ в 2000 г. составила 9,1 на 100 тыс. населения: среди мужчин — 10,1 (на 100 тыс. мужского населения), среди женщин — 8,2 (на 100 тыс. женского населения). В 2000 г. в России раком ПЖ заболело 13146 человек, что составило 2,9% из всех заболевших в этом году злокачественными новообразованиями. Абсолютное число заболевших по сравнению с 1990 г. выросло на 2 тыс., что однако не является статистически достоверным. В структуре заболеваемости населения России злокачественными новообразованиями в 2000 г. частота рака ПЖ и у мужчин, и у женщин занимала 11 место (среди мужчин — 3,2%; среди женщин — 2,7%). Уровень заболеваемости раком ПЖ среди мужчин в России уступает уровню заболеваемости раком легкого (24,5%), желудка (12,7%), кожи (8,6%), простаты (5,4%), ободочной кишки (4,9%), прямой кишки (4,7%), гемобластозами (4,7%), раком мочевого пузыря (4,4%), почки (3,5%), гортани (3,2%). Уровень заболеваемости раком ПЖ среди женщин в России уступает уровню заболеваемости РМЖ (19,3%), кожи (12,7%), желудка (8,9%), ободочной кишки (6,6%), тела матки (6,5%), шейки матки (5,3%), РЯ (5%), прямой кишки (4,8%), легкого (4,4%), гемобластозами (4,2%). Среди злокачественных новообразований органов пищеварения в России на рак ПЖ приходится 10,4%, что соответствует 4 ранговому месту после опухолей желудка, ободочной и прямой кишки. Средний возраст заболевших раком ПЖ мужчин в России — 63 года, женщин — 69 лет. Соотношение заболевших мужчин и женщин — 1,3.
В России ежегодно от рака ПЖ умирает 13 тыс. человек, т.е. столько же, сколько ежегодно регистрируется новых случаев рака ПЖ. В структуре смертности населения России от злокачественных новообразований относительная частота рака ПЖ, как причины смерти, среди мужчин — 4,1% (6 место); среди женщин — 4,7% (8 место). Уровень смертности по причине рака ПЖ среди мужчин уступает уровню смертности по причине рака легкого (30,8%), желудка (15,4%), прямой кишки (4,8%), ободочной кишки (4,6%), предстательной железы (4,1%), а среди женщин уступает уровню смертности по причине РМЖ (16,4%), желудка (14,1%), ободочной кишки (8,2%), легкого (6,6%), прямой кишки (6,5%), РЯ (5,5%), шейки матки (4,7%). Средний возраст умерших: для мужчин — 64 года, для женщин — 70 лет. Очевидно, рак ПЖ — одна из главных причин смерти больных онкологического профиля (Давыдов М.И., Аксель Е.М., 2002).
Точно не установлено, являются ли видимый рост заболеваемости и различия в заболеваемости раком ПЖ в разных странах истинными или кажущимися, т.е. обусловленными различиями в уровне диагностики.
Роль в канцерогенезе рака ПЖ имеют ранее называвшиеся факторы риска: табакокурение, длительное употребление кофе, пищи богатой животными жирами, алкоголя, наличие сахарного диабета, хронического панкреатита, холецистэктомия по поводу желчнокаменной болезни в анамнезе, профессиональные токсические воздействия, связанные с нефтепереработкой и бумагоделательным производством. Но разные авторы оценивают их противоречиво. Среди вышеуказанных факторов только табакокурение дает статистически значимое увеличение риска заболеваемости раком ПЖ (коэффициент относительного риска 1,52; 90%, доверительный интервал 1,26–1,83) (Tominaga S. et al., 1998). По данным R. Doll и соавт. (1994), полученным на основе эпидемиологического анализа, среди 34 тыс. курящих английских врачей, имеется трехкратное повышение риска заболевания среди выкуривающих не менее 25 сигарет в день на протяжении нескольких лет. Попытка оценить риск развития рака ПЖ в зависимости от потребляемого кофе на основании дескриптивного эпидемиологического метаанализа в Японии в середине 90-х гг. привела к следующему результату. Кривая, демонстрирующая риск развития рака ПЖ в зависимости от ежедневной дозы употребляемого кофе, имела U-образную форму. Самый низкий относительный риск (коэффициент относительного риска для мужчин — 0,18; для женщин — 0,53) был обнаружен среди лиц, эпизодически употребляющих кофе в небольших количествах. Более высокие показатели относительного риска развития рака ПЖ обнаружены среди не употребляющих кофе вообще и среди употребляющих кофе в количестве 5 и более чашечек в день (Nishi M. et al., 1996). Очевидно, подобные эпидемиологические данные пока не могут убедительно свидетельствовать о том или ином экзогенном агенте, как действительном факторе риска развития рака ПЖ.
Факт, что заболеваемость раком ПЖ и смертность от рака ПЖ среди белых американцев значительно ниже по сравнению с заболеваемостью и смертностью негров и японцев, постоянно и длительно проживающих в США, позволяет предположить, что по меньшей мере, воздействие диеты и факторов окружающей среды на заболеваемость раком ПЖ не столь существенно (Tominaga S. et al., 1998).
Сочетание хронического панкреатита, сахарного диабета 1 типа и экзокринного рака ПЖ некоторыми авторами интерпретируется как причина и следствие. Не отрицая в целом роль хронического воспаления ПЖ в развитии экзокринных форм рака ПЖ, современные данные молекулярной генетики и биологии, скорее, свидетельствуют о параллельном, синхронном и автономном развитии указанных заболеваний.
Сообщается о развитии рака ПЖ в качестве второй метахронной опухоли при первично-множественной форме рака. Относительный риск развития рака ПЖ после рака легкого для мужчин составлял 1,3 при 95% доверительном интервале (ДИ) 1,0–1,6 и для женщин — 2,5 при 95% доверительном интервале 1,9–3,2. Повышенный риск был также установлен после опухолей головы и шеи (ОР 1,8; 95% ДИ 1,2–2,5) и мочевого пузыря только у женщин (ОР 1,5; 95% ДИ 1,1–2,0). У мужчин риск развития рака ПЖ статистически значимо увеличен при наличии рака предстательной железы (ОР 1,2; 95% ДИ 1,1–1,3). Риск первичной множественности для рака ПЖ возрастает после табакозависимых форм опухолей, особенно среди женщин (Аксель Е.М. и др., 2001; Neugut A.I. et al., 1995).
Молекулярно-генетические и биологические особенности рака ПЖ
При большинстве опухолей генетические дефекты носят множественный характер. Считается, что наиболее важны в процессе канцерогенеза мутации на ранних этапах. Более поздние мутации уже не играют существенной роли в инициации опухолевого роста, но могут ускорять его прогрессирование. Процесс озлокачествления является многоэтапным, сопровождается комплексным повреждением генов. Классическая двухэтапная теория канцерогенеза (Knudson A.G., 1971) подразумевает переход из гетерозиготного в гомозиготное состояние генов-супрессоров опухолевого роста. Согласно “двухударной”, или двухэтапной, модели канцерогенеза на первом этапе происходит мутация в соматической или половой клетке, что приводит к образованию клетки с высоким риском злокачественной трансформации. Если мутация произошла в половой клетке, то такая мутация наследуется из поколения в поколение, и все соматические клетки последующих поколений несут эту мутацию (семейные, наследственные формы рака). Второй “удар”, этап генетических изменений под воздействием тех или иных причин происходит уже в соматической клетке ткани-мишени опухоли в виде мутации альтернативного гена в гомологичной хромосоме, т.е. происходит “потеря гетерозиготности” и переход в гомозиготное состояние. Последнее обеспечивает полную инактивацию гена-супрессора опухолевого роста, что является началом инициации злокачественного процесса, т.е. малигнизацией клетки. При спорадических, ненаследственных формах развития опухолей оба этапа, “удара” генетических изменений происходят в соматических клетках тканей-мишеней опухолей. При этом спорадические формы рака обусловлены утратой одного аллеля и мутацией второй копии гена, либо гомозиготной делецией гена. Таким образом, канцерогенный эффект генов-супрессоров может проявиться лишь при наличии гомозиготных мутаций, полностью инактивирующих их функции.
Принято полагать, что бóльшая часть опухолей органов билиопанкреатодуоденальной зоны по молекулярно-генетическим механизмам относится к группе спорадических, ненаследственных, форм. Меньшая часть — к наследственным, семейным формам опухолей.
Все бóльшую роль в канцерогенезе отводят эпигенетическим воздействиям, изменениям экспрессии генов без каких-либо их структурных изменений — функциональным мутациям. В частности, важнейшим механизмом канцерогенеза считается аномальное метилирование (деметилирование) участков (CpG-островков) генов-супрессоров (Залетаев Д.В., 2003).
При раке ПЖ выражена цитогенетическая гетерогенность опухоли: отмечены множественные структурные и количественные изменения. В целом обнаружено более 500 хромосомных аномалий. Наиболее часто вовлеченными в структурные перестройки хромосомами являются: 1, 3, 6, 7, 8, 11, 12, 17, 19 и цепи 1q12, 1q21, 3q11, 6p21, 6q21, 7q11, 7q22, 7q32, 11q13, 13cen, 14cen, 17cen, 17q11, 17q21, 19q13 (Gorunova L. et al., 1998). Возможна гиперамплификация определенных генов, в результате чего в опухоли появляются сверхчисленные микрохромосомы (double-minute). Приблизительно у трети больных экзокринным раком ПЖ в ядрах опухолевых клеток содержится диплоидный набор хромосом, у 2/3 — анеуплоидия. Последняя, по мнению некоторых исследователей, ассоциируется с худшим прогнозом (Bottger T.C. et al., 1994; Geer R.G. et al., 1993). По мнению других, плоидность хромосом не ухудшает прогноз при раке ПЖ: 33% больных, живущих без рецидива заболевания после хирургического удаления опухоли ПЖ, имели анеуплоидию (Park C.S. et al., 1996).
Мутации онкогена K-ras отмечены в 71–100% случаев опухолей ПЖ. Наиболее часто мутации (83–100%) отмечаются в 12 кодоне и носят характер трансцизий гуанина на аденин (49%), гуанина на тимин (39%), гуанина на цитозин (12%). Кроме указанного кодона, точковые мутации могут затрагивать 13 и 61 кодоны гена. Онкоген K-ras кодирует G-протеин, контролирующий аденилатциклазу, т.е. имеет прямое отношение к трансдукции внешних сигналов под влиянием факторов роста и дифференцировки клеток. Измененные ras-протеины не способны инактивироваться и оказывают стимулирующее действие на клетку автономно. Высокотехнологичные молекулярные исследования, основанные на применении ПЦР и ее модификаций у больных раком ПЖ, обнаружили высокую частоту мутаций онкогена K-ras в клетках опухоли (87%), в биоптатах из лимфоузлов (42%), печени (76,5%), периферической крови (у 50% больных до удаления опухоли и у 100% — к концу мобилизации панкреатодуоденального комплекса) (Nomoto S. et al., 1996). Специфичность мутации онкогена K-ras ограничена — мутантный онкоген обнаруживается и при доброкачественных изменениях в ПЖ (гиперплазия протокового эпителия).
Мутации гена опухолевой супрессии p53 выявлены у 70% больных раком ПЖ. Анализ частоты мутаций p53 в опухоли ПЖ: всего 8 из 30 клеточных линий опухоли содержали этот мутантный ген (Redston M.S. et al., 1994).
Обнаружена повышенная частота недостаточной экспрессии Fhit-протеина клетками рака ПЖ по сравнению с протоковым эпителием неизмененной ПЖ (Sorio C. et al., 1999).
Попытка оценить прогностическую роль факторов ангиогенеза при протоковой аденокарциноме ПЖ путем сопоставления продолжительности жизни больных после хирургического удаления опухоли ПЖ, экспрессии PD-ECGF и VEGF-протеинов и внутриопухолевой микрососудистой плотности выявила следующее. Экспрессия PD-ECGF-протеина была положительной у 75%, а экспрессия VEGF-протеина — у 67,5% больных раком ПЖ. Медиана продолжительности жизни была достоверно короче в указанных группах с положительной экспрессией факторов ангиогенеза, хотя многофакторный анализ показал, что внутриопухолевая микрососудистая плотность и VEGF-экспрессия были независимыми факторами (Ikeda N. et al., 1999).
Отчасти нашла свое объяснение и столь характерная для протоковой аденокарциномы ПЖ периневральная инвазия. Выделен белок GDNF, который является продуктом экспрессии c-ret-протоонкогена, присутствующего во всех линиях клеток человеческого рака ПЖ. Экспрессия GDNF также имеет место в клетках человеческой глии. Указанный белок индуцирует миграцию опухолевых клеток, а антитела к GDNF угнетают их миграцию. Доказаны хемотаксическая и хемокинетическая активность GDNF. Периневральная инвазия клеток рака ПЖ увеличивается параллельно градиенту концентрации GDNF между нервными периферическими ганглиями и опухолью ПЖ (Okada Y. et al., 1999).
Иммуногистохимическими методами показана корреляция аберрантного Е-Kадгерина со степенью дифференцировки и распространенностью протоковой аденокарциномы ПЖ у человека. Экспрессия аберрантного фактора адгезии в опухолевых клетках повышается с потерей диференцировки, местной распространенностью, наличием метастазов в лимфоузлы и отдаленных метастазов рака ПЖ. Таким образом потеря экспрессии нормального Е-Кадгерина и увеличение экспрессии аберрантного ассоциируются с увеличением подвижности и инвазивности опухолевых клеток (Karayiannakis A.J. et al., 1998).
Установлена структура молекулы белка, состоящего из 188 аминокислот, центральный сегмент которой гомологичен эпидермальному фактору роста (EGF) и трансформирующему фактору роста (TGF). Указанные факторы роста обнаружены не только в клетках опухоли, но и в протоковом и ацинарном эпителии прилежащих к опухоли участков ПЖ. Известны изоформы трансформирующего фактора роста (TGF) у больных раком ПЖ: TGF-b–1 (47%), TGF-b–2 (42%), TGF-b–3 (40%). Наличие указанных изоформ коррелирует с распространенным опухолевым процессом, их отсутствие — с нераспространенными опухолями (Friess H. et al., 1994).
Патологическая анатомия и особенности клинического течения злокачественных опухолей ПЖ
Последняя патолого-анатомическая классификация опухолей ПЖ, предложенная патологами США (Solcia E. et al., 1997), основана на современной патолого-анатомической диагностике опухолей и в значительной степени отражает клиническое течение и прогноз заболевания. В классификации выделена группа опухолей с неопределенным, пограничным злокачественным потенциалом. Например, сóлидная псевдопапиллярная опухоль имеет доброкачественные гистологические проявления, но при этом может метастазировать. Все пограничные опухоли медленно растут, при адекватном удалении прогноз благоприятный. Названия опухолей в классификации отражают их гистогенетические зачатки и фенотипические проявления, в частности, направление дифференцировки:
- Эпителиальноклеточные типы опухолей, т.е. опухоли из протокового эпителия (муцинозных или серозных дуктул).
- Опухоли из клеток ацинусов.
- Опухоли из эндокринных клеток.
В классификации собственно эндокринных опухолей учтены макроскопические характеристики местной инвазии, периневральной инвазии и инвазии кровеносных сосудов, размеры опухоли (менее или более 3 см) как индикатора злокачественности. Учитывается функциональная активность эндокринных опухолей, т.е. классификация основана на клинико-патолого-анатомических признаках опухолей. Ниже представлен фрагмент указанной классификации, касающийся первичных опухолей ПЖ.
1. Первичные опухоли ПЖ
1.1. Опухоли экзокринной ткани ПЖ
1.1.1. Доброкачественные опухоли ПЖ (серозная цистаденома, муцинозная цистаденома, внутрипротоковая папиллярная муцинозная аденома, зрелая кистозная тератома)
1.1.2. Пограничные опухоли ПЖ (муцинозная кистозная опухоль с умеренно выраженной дисплазией, внутрипротоковая папиллярно-муцинозная опухоль с умеренно выраженной дисплазией, сóлидная псевдопапиллярная опухоль)
1.1.3. Злокачественные опухоли ПЖ
1.1.3.1. Протоковая аденокарцинома (микроскопические формы протокового рака: муцинозный некистозный, перстневидно-клеточный, железистоплоскоклеточный, недифференцированный, смешанный протоково-эндокринный)
1.1.3.2. Гигантоклеточная опухоль
1.1.3.3. Серозная цистаденокарцинома
1.1.3.4. Муцинозная цистаденокарцинома (неинвазивная, инвазивная)
1.1.3.5. Внутрипротоковая папиллярно-муцинозная карцинома (неинвазивная, инвазивная)
1.1.3.6. Ацинарноклеточный рак (ацинарноклеточная цистаденокарцинома, смешанный ацинарноэндокринный рак)
1.1.3.7. Панкреатобластома
1.1.3.8. Сóлидная псевдопапиллярная карцинома
1.1.3.9. Смешанные карциномы
1.2. Эндокринные опухоли ПЖ
1.2.1. Доброкачественные эндокринные опухоли ПЖ
1.2.1.1. Высокодифференцированная аденома (инсулинома, нефункционирующая аденома)
1.2.2. Пограничные (с неопределенным злокачественным потенциалом) эндокринные опухоли ПЖ (высокодифференцированная опухоль без инвазии сосудов, инсулинома, гастринома, випома, глюкагонома, соматостатинома, другие нефункционирующая опухоль)
1.2.3. Эндокринные опухоли ПЖ с низкой степенью злокачественности
1.2.3.1. Высоко и умеренно дифференцированные эндокринные карциномы (инсулинома, гастринома, випома, глюкагонома, соматостатинома, другие опухоли, нефункционирующие карциномы)
1.2.4. Эндокринные опухоли ПЖ с высокой степенью злокачественности
1.2.4.1. Низкодифференцированный эндокринный рак ПЖ (мелкоклеточный рак функционально активный или нефункционирующий)
1.3. Неэпителиальные опухоли ПЖ
1.3.1. Доброкачественные мягкотканные опухоли
1.3.2. Злокачественные мягкотканные опухоли
1.3.3. Лимфомы с поражением ПЖ
Протоковая аденокарцинома ПЖ, представленная пятью микроскопическими формами (см. выше), — абсолютно преобладающая опухоль ПЖ. Именно для нее характерна крайняя биологически детерминированная агрессивность течения. Муцинозная, серозная и ацинарноклеточная цистаденокарциномы, гигантоклеточная карцинома, внутрипротоковая папиллярно-муцинозная карцинома, сóлидная псевдопапиллярная карцинома — более редкие формы экзокринного рака ПЖ. Чаще встречаются среди женщин, обладают менее агрессивным течением и лучшим прогнозом. Объединение под диагнозом “рак ПЖ” протоковой аденокарциномы с другими микроскопическими формами экзокринных и эндокринных опухолей неизбежно исказит представления об отдаленных результатах лечения.
В структуре всех первичных опухолей ПЖ на различные микроскопические формы экзокринного рака поджелудочной железы приходится 75%. В структуре экзокринного рака протоковая аденокарцинома составляет почти 97%.
Наиболее часто рак ПЖ развивается в головке ПЖ (59,1–87%), реже — в теле и хвосте органа. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, головка ПЖ бывает поражена опухолью у 75% пациентов, тело ПЖ — у 18%, хвост — у 7% больных раком ПЖ с твердо установленной локализацией опухоли в ПЖ. Необходимо учесть, что у ряда больных установить точную локализацию опухоли в ПЖ практически невозможно.
Развитие рака ПЖ на фоне хронического панкреатита в действительности встречается не так часто, как принято было считать раньше. Мультицентричное поражение ПЖ отмечается менее чем у 3% больных протоковой аденокарциномой ПЖ. В большинстве случаев протоковый рак ПЖ диагностируется на стадии внеорганного распространения опухоли и отдаленных метастазов. Локо-регионарный рецидив у подавляющего большинства больных, перенесших хирургическое лечение, обусловлен ранним лимфогенным метастазированием, распространением опухоли по межтканевым, внутритканевым щелям, периневрально.
Главный лимфогенный путь опухолевой диссеминации при раке головки поджелудочной железы — поражение лимфоузлов вокруг головки ПЖ (регионарные лимфоузлы) и, прежде всего, лимфоузлов задней панкреатодуоденальной группы. Далее лимфогенное метастазирование может осуществляться прямо в парааортальные лимфоузлы или в лимфоузлы вокруг верхних брыжеечных сосудов и чревного ствола, а затем — в парааортальные лимфоузлы. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, при протоковой аденокарциноме головки ПЖ в момент хирургическорго лечения метастазы в регионарных лимфоузлах имеются у 90–100% больных, метастазы в лимфоузлах юкстарегионарного лимфоколлектора — у 80% больных, внеоргaнная ретроперитонеальная инвазия — у 80%, инвазия крупных сосудов в зоне операции — у 60% пациентов. Все это делает вероятность радикального хирургического лечения при протоковом раке головки ПЖ очень невысокой, а отдаленные результаты лечения — неудовлетворительными. Рак головки ПЖ в 47–92% случаев осложняется механической желтухой. Развившаяся желтуха не является ранним проявлением заболевания.
Особенностью протокового рака тела и хвоста ПЖ является более длительное бессимптомное течение заболевания. Появление жалоб, как правило, совпадает с распространением опухоли, исключающим вероятность ее радикального хирургического удаления. Постоянные, упорно нарастающие боли в эпигастральной области, иррадиирующие в спину и поясницу, сопровождающиеся анорексией и похуданием — ведущий симптомокомплекс у таких больных. Главный путь лимфогенного метастазирования при локализации опухоли в теле и хвосте ПЖ следующий: лимфоузлы, прилежащие к телу и хвосту ПЖ, включая лимфоузлы ворот селезенки, далее — лимфоузлы вокруг чревного ствола, корня брыжейки (по ходу верхних брыжеечных сосудов, нижней брыжеечной вены) и парааортальные лимфоузлы. Метастатическое поражение отдаленных групп лимфоузлов (медиастинальные, бронхопульмональные, периферические) выявляются у 28–51% больных протоковым раком ПЖ. Периневральный путь распространения рака ПЖ рассматривается, наряду с лимфогенным и гематогенным, как важнейший.
Интенсивность болевого синдрома и иррадиация болей в спину коррелируюет с местной ретроперитонеальной инвазией и, прежде всего, с периневральным распространением опухоли. Значительная потеря в весе связана с массой опухоли и выключением ПЖ из пищеварения. Ряд осложнений: холемические кровотечения, кровотечения в двенадцатиперстную кишку из распадающейся опухоли головки ПЖ, сахарный диабет, панкреатит, мигрирующие тромбофлебиты — в разной степени ухудшают течение заболевания.
Клинико-анатомическая классификация экзокринного рака ПЖ поTNM (5 редакция, 1997)
Критерий T
T1 — опухоль ограничена ПЖ и ≤ 2 см;
T2 — опухоль ограничена ПЖ и > 2 см;
T3 — распространяется на 12ПК, холедох, ткани вокруг ПЖ;
T4 — распространяется на крупные сосуды, желудок, ободочную кишку, селезенку.
Критерий N
N1 — метастазы в регионарные лимфоузлы.
Группировка по стадиям приведена в таблице 9.
Таблица 9
Группировка по стадиям
| Стадия I | T1-2 | N0 | M0 |
| Стадия II | T3 | N0 | M0 |
| Стадия III | T1-3 | N1 | M0 |
| Стадия IVa | T4 | N0-1 | M0 |
| Стадия IVb | T1-4 | N0-1 | M1 |
К сожалению, в настоящей редакции классификации рака ПЖ по TNM есть, как минимум, 3 недостатка.
Первый — классификация одинаково рассматривает все микроскопические формы экзокринного рака без биологических особенностей каждой формы, определяющих разный прогноз. Следовало бы ограничиться только протоковой аденокарциномой.
Второй — ретроперитонеальная инвазия, являясь плохим прогностическим признаком, относится к градации T3, а сочетание T3N0M0 cоответствует II стадии. Следует ретроперитонеальную инвазию включить в градацию T4.
Третий — недостаточно детализирован критерий N. Следовало бы ввести градацию N2 (метастазы в юкстарегионарные лимфоузлы) и любое сочетание T с N2 отнести к IV стадии заболевания.
В этом смысле наиболее передовой клинико-патологической классификацией рака ПЖ является 4 редакция общих правил по изучению рака ПЖ, принятая в Японии (“General rules for the study of pancreatic cancer”, 4th ed., 1993). В этой классификации критерий T учитывает инвазию передней капсулы ПЖ, ретроперитонеальную инвазию, инвазию крупных сосудов, 12ПК, холедоха по 4 степеням (0 — нет данных за инвазию, 1 — подозрение на инвазию, 2 — инвазия не вызывает сомнений, 3 — инвазия очень выражена). Градации критерия T выглядят так:
T1a — опухоль ≤ 2 см, 12ПК0, Х0, К0, Рп0, ВВ0, А0,
Т1в — опухоль > 2 см, 12ПК0, Х0, К0, Рп0, ВВ0, А0,
Т2 — 12ПК1,2,3, Х1,2,3, К1, Рп1, ВВ1, А1,
Т3 — К2,3, Рп2,3, А2,3,
где 12ПК — двенадцатиперстная кишка, Х — холедох, К — передняя капсула ПЖ, Рп — ретроперитонеальная соединительная ткань, ВВ — воротная вена, А — артерия.
Критерий N включает 3 градации:
N1 — метастазы в регионарные лимфоузлы, непосредственно прилежащие к панкреатодуоденальному комплексу,
N2 — метастазы в лимфоузлы вокруг брыжеечных сосудов и чревного ствола,
N3 — метастазы в парааортальные лимфоузлы.
Таблица 10
Группировка по стадиям
| Критерии | N0 | N1 | N2 | N3 |
| T1a | I | II | III | IVa |
| T1b | I | II | III | IVa |
| T2 | III | III | IVa | IVb |
| T3 | IVa | IVa | IVb | IVb |
Клинико-патологические особенности опухолей эндокринного происхождения
Эндокринные опухоли ПЖ (“карциноиды” — Оберндорфер, 1907) являются редкими и в большинстве своем характеризуются более доброкачественным течением по сравнению с аденокарциномой. Среди всех опухолей ПЖ доля эндокринных опухолей, по-видимому, не превышает 20–25%. Лишь одна эндокринная опухоль — мелкоклеточная низкодифференцированная карцинома ПЖ — легко распознается как злокачественная опухоль по выраженной анаплазии и агрессивному течению. Судить о злокачественности большинства эндокринных опухолей приходиться по совокупности клинико-патолого-анатомических признаков:
— метастазы, микро- и макроскопически определяемая местная инвазия, ангио- и периневральная инвазия, размеры опухоли более 3 см — индикаторы злокачественности;
— размеры опухоли меньше 2 см, отсутствие метастазов, инвазии и митозов — индикаторы доброкачественности опухоли.
Значительную помощь в диагностике и установлении злокачественности оказывает функциональная активность опухоли — эндокринный синдром (или их совокупность), который позволяет лучше судить о “естественном” течении заболевания: выраженности симптомов, продолжительности болезни. И, наоборот, нефункционирующие эндокринные опухоли сложнее для интерпретации злокачественности.
Эндокринные опухоли могут синтезировать большое количество биологически активных аминов, пептидов: серотонин, гистамин, тахикинины, нейрон-специфическая енолазу, 5-гидрокситриптамин, 5-гидрокситриптофан, хромогранины А и С, инсулин, АДГ, ХГ, вазоактивные интестинальные пептиды, гормон роста, нейропептиды, АКТГ, меланоцитстимулирующий гормон, гастрин, панкреатический полипептид, кальцитонин, бомбезин, глюкагон и др. Все они определяют специфическое клиническое течение. До сих пор точно не установлено, какой из аминов или пептидов определяет клиническую манифестацию “карциноидного синдрома” (серотонин, гистамин, тахикинины, гастроинтестинальные пептиды, ПГ, субстанция П, субстанция К, нейропептид К, нейротензин, инсулин, глюкагон, гастрин, соматостатин, панкреатический полипептид, ХГ и др.). Эндокринные опухоли чаще локализуются в теле и хвосте ПЖ (Блохин Н.Н. и др., 1982; Горбунова В.А. и др., 1999; Пономарев А.А. и др., 2000; Кубышкин В.А. и др., 2003).
Диагностика злокачественных опухолей ПЖ
Скрининг рака ПЖ не разработан.
Клинико-анамнестические, лабораторные данные позволяют заподозрить опухоль и послужить поводом для обследования больного. Практическое значение имеют иммунохимические тесты сыворотки крови на 2 антигена: СА 19–9 и РЭА. Указанные тесты не дают перекрестной реакции.
СА 19–9
Средняя чувствительность маркера при экзокринном раке ПЖ составляет 80%. Значения СА 19–9 коррелируют с распространением опухоли: более высокая концентрация маркера у лиц с распространенным раком ПЖ, желчного пузыря и ВЖП. Имеется зависимость от степени дифференцировки опухоли — высокодифференцированным опухолям соответствуют бóльшие значения СА 19–9. Специфичность маркера ограничена из-за повышенных показателей у больных острым холангитом, острым панкреатитом, хроническим рецидивирующим панкреатитом, у больных с синдромом холестаза вне зависимости от вызвавшей его причины. Повышение концентрации маркера отмечается при раке других локализаций: желудка, толстой кишки, гепатоцеллюлярном и холангиоцеллюлярном раке.
РЭА
Гликопротеид. У взрослых содержится в сыворотке крови до 2,5 нг/мл (мкг/л) — у некурящих и немного выше у курильщиков. Уровень больше 5 нг/мл может свидетельствовать о раке. Чувствительность маркера при раке ПЖ — 46–90%. Значения РЭА коррелируют с распространенностью и степенью дифференцировки опухоли — концентрация в сыворотке выше при распространенном опухолевом поражении и более дифференцированной опухоли. Специфичность маркера при раке ПЖ ограничена из-за положительных значений теста при ряде неопухолевых заболеваний (гепатит, цирроз печени, эмфизема легких, пневмония, терминальный илеит, панкреатит); доброкачественных опухолях (полипы толстой кишки), злокачественных опухолях других локализаций (рак толстой кишки, желудка, молочной железы, легкого) (Окулов В.Б., 1989; Белохвостов А.С. и др., 2002).
Невысокая специфичность маркеров обусловливает их роль как метода мониторинга за больными раком ПЖ, у которых ранее, до лечения, отмечались положительные иммунохимические тесты на СА 19–9 и РЭА.
Отмечено снижение соотношения концентраций тестостерона и дегидротестостерона в сыворотке крови ниже 5 у 70% больных экзокринным раком ПЖ. В норме это соотношение равно 10. При невысокой чувствительности отмечена более высокая специфичность данного теста по сравнению с другими (Robles-Diaz G. et al., 1991).
Дооперационная диагностика опухолей ПЖ основана на инструментальных методах и призвана ответить на 2 вопроса:
1) Какова природа изменений и гистогенез опухоли в ПЖ?
2) топический диагноз (точная локализация и распространенность опухоли).
УЗИ
УЗТ, являясь безвредным для больного методом лучевой диагностики, позволяет выявить опухоль в ПЖ размером не менее 1,5 см, определить пораженный отдел, визуализировать главный панкреатический проток, внутри- и внепеченочные желчные протоки, указать размеры расширенных протоков вне печени и внутри печени (при внепеченочном холестазе), уровень блока желчных протоков, наличие очагов (метастазов) в печени, если их размеры не меньше 1,0 см, наличие увеличенных лимфоузлов; выявить даже небольшое количество жидкости в свободной брюшной полости. Эхогенность патологического очага в ПЖ зависит от структуры самой опухоли: сóлидная, кистозная, сóлидно-кистозная. Наиболее часто эхогенность опухоли неравномерно снижена. Реже отмечается неравномерное повышение эхосигнала. Возможно усиление эхогенности в центральных отделах опухоли и снижение в периферических и наоборот. Современные методики УЗИ позволяют:
1) уточнить структуру опухоли (режимы нативной гармоники, цветового колорайзинга),
2) оценить степень васкуляризации опухоли (энергетическое допплеровское картирование, эхоконтрастирование),
3) оценить прилежащие к ПЖ крупные венозные и артериальные сосуды (ЦДК, волюметрическая трехмерная реконструкция).
Эндоскопическая (дуоденоскопия) и эндоваскулярная (при введении датчика в воротную и верхнюю брыжеечную вены) эхография с высокой точностью определяют инвазию верхней брыжеечной и воротной вен, что имеет важное прогностическое значение. Возможность диагностировать инвазию воротной вены увеличивается при эндоскопическом внутрипротоковом УЗИ.
Разработана классификация взаимоотношений крупных сосудов и опухоли ПЖ:
1) интактность сосуда — сосуд топографически вне опухоли;
2) оттеснение сосуда — сосуд оттеснен опухолью и имеет патологическую топографию, может отмечаться увеличение линейной и снижение объемной скорости кровотока, регистрироваться турбулентный кровоток;
3) прорастание сосуда — сосуд муфтообразно окружен опухолью и деформирован, может наблюдаться любое изменение линейной скорости кровотока и снижение объемной скорости кровотока, определяться тромбоз сосуда, стаз крови, кровоток может быть монофазным и турбулентным;
4) оттеснение и одновременное прорастание сосуда — признаки пунктов 2 и 3 сочетаются;
5) распространение воспалительного перипроцесса на сосуд — опухоль не имеет прямого контакта с сосудом, сосуд окружен тканями, эхоструктура которых отлична от опухолевой.
Таким образом, современное УЗИ, включающее дополнительные методики, позволяет с высокой точностью судить, во-первых, о природе изменений в ПЖ и о структуре опухоли и, во-вторых, о распространенности поражения и в значительной степени заменить собой рентгенологические и сцинтиграфические методы диагностики.
Факторами, ограничивающими применение УЗИ, являются: газ в кишечнике, наличие выраженного подкожного и внутрибрюшного жира (Бацков С.С., 1998; Зубарев А.В. и др., 2001; Старков Ю.Г., 2003).
РКТ
Возможности РКТ в определении природы и распространенности опухоли повышаются при внутривенном контрастировании.
При спиральной РКТ с болюсным введением контрастного вещества меняется рентгенологическая плотность опухоли (чаще в сторону понижения, из-за более низкой васкуляризации экзокринного рака ПЖ по сравнению с васкулиризацией самой ПЖ), что облегчает оценку границ опухоли, ее взаимоотношений с окружающими органами и сосудами, позволяет дифференцировать метастазы. Метод позволяет реконструировать трехмерное изображение исследуемой опухоли.
СКТ-ангиография высокоинформативна в установлении инвазии окружающих органов, инвазии прилежащих крупных сосудов.
Классификация опухолевого вовлечения сосудов при протоковом раке ПЖ на основе данных РКТ с болюсным контрастным усилением (Loyer E.M. et al., 1996):
1. Тип А — жировая прослойка отделяет опухоль и непораженную паренхиму ПЖ от соседних сосудов.
2. Тип В — неизмененная паренхима ПЖ четко отграничивает гиподенсную опухоль от крупных сосудов.
3. Тип С — гиподенсная опухоль не отграничена от соседних сосудов, опухоль граничит с сосудами.
4. Тип D — гиподенсная опухоль граничит и частично окружает сосуды.
5. Тип E — гиподенсная опухоль окружает соседние сосуды, нет прослоек между опухолью и сосудами.
6. Тип F — сосуды вовлечены в опухоль.
При типах А и В вероятность хирургического удаления опухоли без резекции сосудов — 95%. При типе С прогностическое значение РКТ невелико. При РКТ-типе D у большинства больных имеется инвазия сосудов, вероятность хирургического удаления опухоли с резекцией пораженного сосуда около 50%. При РКТ-типах E и F опухоль нерезектабельна (Позднякова О.Ф. с соавт., 2001; Кармазановский Г.Г., 2003).
МРТ
МРТ при опухолях ПЖ решает те же задачи, что УЗТ и РКТ, а именно:
— уточняет природу объемных изменений в органах билиопанкреатодуоденальной зоны,
— высокоточно характеризует структуру образований, их органную принадлежность, размеры, связь с прилежащими структурами и сосудами,
— определяет наличие метастазов в лимфоузлах и печени и др.
Для диагностики протоковой аденокарциномы ПЖ оптимально сочетание T1-взвешенных спин-эхо последовательностей после внутривенной инъекции гадолиния DTPA (выявляет опухоль и ее распространение на окружающие структуры) и T2-взвешенных спин-эхо последовательностей (выявляет кисты, зоны некроза). При МРТ протоковый рак ПЖ обнаруживается в виде зоны низкой интенсивности сигнала на T1 — взвешенных изображениях; после внутривенного введения Гадолиния DTPA зона опухоли, имеющая низкую интенсивность сигнала, становится более выраженной. На T2-взвешенных изображениях протоковая аденокарцинома выглядит в виде зоны высокой интенсивности сигнала.
МРТ превосходит РКТ в оценке обнаружения опухоли ПЖ, ее распространенности на прилежащие крупные сосуды и окружающие органы, хотя уступает спиральной РКТ с болюсным контрастированием в оценке ретроперитонеальной инвазии тканей вокруг ПЖ.
Магнитно-резонансная холангиопанкреатография, являясь неинвазивной методикой, позволяет достаточно точно судить о степени расширения желчных и главного панкреатического протоков, локализации, природе и протяженности стеноза общего желчного протока при раке головки ПЖ, о патологических включениях и наличии ретенционных кист.
Таким образом, при отсутствии морфологической верификации диагноза этот метод позволяет относительно достоверно судить о природе изменений (опухолевая или неопухолевая) в головке ПЖ.
Методики магнитно-резонансной артериографии и сплено-мезентерико-портографии основаны на МРТ в условиях внутривенного введения контрастного вещества (например, гадопентеновая кислота) и дают ценную информацию о вовлечении в патологический процесс крупных сосудов в области опухоли, а также сосудистой анатомии (Шотемор Ш.Ш., 2001; Кармазановский Г.Г., 2003).
ПЭТ
ПЭТ выявляет очаги повышенной концентрации РФП (наиболее часто используется 18 F-фтордезоксиглюкоза) в первичной опухоли и метастазах. Благодаря расcчитанным коэффициентам дифференциального накопления (опухоль/интактные ткани) РФП, ПЭТ является наиболее чувствительным методом инструментальной диагностики при обнаружении метастазов рака в лимфоузлы и другие органы (печень, легкие, кости). Считается, что ПЭТ более точно, по сравнению с УЗТ, РКТ и МРТ, позволяет устанавливать опухолевую природу обнаруженных изменений в органах билиопанкрекатодуоденальной зоны.
ПБ
ПБ (пункционная цитобиопсия), выполняемая под контролем УЗТ или РКТ, решает единственную диагностическую задачу — морфологическая верификация изменений в ПЖ. Метод относительно безопасен для больного. Подтвердить диагноз данным методом удается у 57–96% больных раком ПЖ. Наряду с традиционными методами цитологической диагностики (световая микроскопия окрашенных препаратов), используются иммуноцитохимические методики. ПБ обязательно выполняется больным с нерезектабельными опухолями, а также лицам, которым планируется неоадьювантная химиолучевая терапия. В хирургических клиниках, где выполняются операции на ПЖ с низкой летальностью и не получены данные за нерезектабельность процесса до операции, пункционной цитобиопсией для морфологического подтверждения диагноза можно пренебречь.
ЭГДС
ЭГДС — обязательный метод исследования для больных с подозрением на опухоль ПЖ, позволяющий визуализировать опухоли большого дуоденального сосочка и двенадцатиперстной кишки, осуществить их биопсию, оценить степень опухолевого стеноза двенадцатиперстной кишки, инвазию двенадцатиперстной кишки при опухолях головки ПЖ.
Он обеспечивает выполнение ретроградной холангиопанкреатографии, транспапиллярного дренирования и протезирования ВЖП при их опухолевом стенозе.
ЭРХПГ
Метод высокоинформативен в установлении опухолевой природы изменений в ПЖ. Типичным для опухолей головки ПЖ является обнаружение дилатации главного панкреатического и общего желчного протоков со стенозом дистального холедоха и в области ампулы БДС. При этом протяженность стеноза главного панкреатического протока при раке ПЖ, как правило, более 10 мм, имеется деформация и нарушение структуры самого протока — его узурация, чего не наблюдается при хроническом панкреатите и доброкачественных образованиях ПЖ. ЭРХПГ неинформативна в установлении внеорганной распространенности поражения (Ревякин В.И. с соавт., 1996).
АГ
Целиакография, верхняя мезентерикография, возвратная спленопорто- и мезентерикопортография — рентгеноэндоваскулярные методики, наиболее часто используемые в решении важнейших диагностических задач, которыми являются:
— установление особенностей сосудистой анатомии билиопанкреатодуоденальной области,
— степень вовлеченности в опухолевый процесс крупных сосудов (прямая местная инвазия опухоли).
При отсутствии морфологической верификации высококровоснабжаемых опухолей ПЖ (приблизительно половина нейроэндокринных опухолей ПЖ) АГ позволяет установить оргáнную принадлежность и с высокой вероятностью судить о гистогенезе опухоли.
Инвазия стенок хотя бы одной из таких артерий, как общая и собственная печеночные артерии, чревный ствол, верхняя брыжеечная артерия, истинная инвазия воротной и верхней брыжеечной вен на значительном протяжении или их полная опухолевая обструкция свидетельствуют о запущенности заболевания и исключают целесообразность операции. То есть, ангиографическому методу отводится важнейшая роль установления нерезектабельности процесса на дооперационном этапе. В этой связи, с целью определения прогноза на основании АГ, разработана классификация вовлечения в опухоль верхней брыжеечной и воротной вен (Nakao A. et al., 1995):
тип A — при АГ нет деформации верхней брыжеечной и воротной вены, инвазия сосудов отсутствует;
тип B — деформация верхней брыжеечной и воротной вены с одной из сторон, инвазия сосудов при протоковом раке ПЖ отмечается у 20% больных;
тип C — деформация контуров верхней брыжеечной и воротной вены с обеих сторон, инвазия сосудов подтверждается гистологически у 70% больных протоковым раком ПЖ;
тип D — выраженная двухсторонняя деформация или полная окклюзия сосудов, инвазия сосудов подтверждается у 92% больных протоковым раком ПЖ.
Визуализация билиарного дерева
ЧЧХГ, выполняемая при пункции внутрипеченочных желчных протоков во время ЧЧХС, высокоинформативна в установлении уровня стеноза желчных протоков, природы стеноза, состояния всего билиарного дерева.
Возможно взятие материала на морфологическое и бактериологическое исследование.
Выполняемая через холангиостому холангиоскопия (ХС), позволяет визуально оценить стеноз общего желчного протока при раке головки ПЖ. Возможно осуществить эндобилиарное УЗИ (Долгушин Б.И. и др., 1996).
Эндоскопические методики
Лапароскопия при раке ЖП используется для визуализации мелких метастазов по брюшине и в печени, зон опухолевой инфильтрации висцеральной брюшины, инвазии печени. Во время лапароскопии возможно взять материал, в том числе асцитическую жидкость, на морфологическое и иммуноморфологическое исследование. Диагностическая ценность метода возрастает, если лапароскопия комбинируется с УЗИ. В целом самостоятельное значение этого метода в диагностике рака ПЖ невелико (Старков Ю.Г., 2003).
Учитывая высокую диагностическую ценность методик УЗТ, по сравнению с другими методами лучевой диагностики, при подозрении на опухолевое поражение ПЖ целесообразно выполнить диагностический комплекс: УЗТ + ПБ + исследование крови на СА 19–9 и РЭА, который в большинстве случаев позволяет точно диагностировать природу и структуру опухоли, ее локализацию и распространенность. Одновременно с указанным комплексом проводятся лабораторные исследования крови и мочи, ЭКГ, рентгенография органов грудной клетки.
В случае невозможности осуществить методики УЗТ из-за выраженного подкожного и внутрибрюшного жировых слоев или газа в кишечнике, целесообразно прибегнуть к другим методам лучевой диагностики (РКТ, МРТ). При наличии механической желтухи, от ПБ и исследования крови на СА 19–9 допустимо временно воздержаться, т.к. в дальнейшем, при разрешении механической желтухи одним из рентгенохирургических методов билиарной декомпрессии, биопсия будет взята через холангиостому, а реакция на СА 19–9 в условиях желчной гипертензии и холангита может оказаться ложноположительной. При отсутствии механической желтухи указанный диагностический комплекс полностью оправдан и может оказаться достаточным для выработки тактики лечения.
Когда подтверждено расширение желчных протоков, установлен дистальный уровень обструкции билиарного дерева, производится ЧЧХС или эндоскопическое ретроградное дренирование и протезирование ВЖП и холангиография. Это лечебно-диагностические методы обеспечивают желчную декомпрессию, уточняют уровень стеноза билиарного дерева, позволяют довольно точно высказаться об опухолевой природе стеноза, обеспечивают морфологическое подтверждение диагноза.
Если после выполнения методик УЗТ, направленных на уточнение распространенности опухоли, остаются сомнения, необходимо прибегнуть к РКТ или МРТ. Кроме того, магнитно-резонансная холангиопанкреатография позволяет с высокой точностью судить о природе стриктуры панкреатического протока и ВЖП, что сделает необязательным в дальнейшем выполнение ЭРХПГ. Необходимость в выполнении ЭРХПГ возникает при отсутствии морфологической верификации заболевания. Если после выполнения ультразвукового ЦДК или спиральной РК-ангиографии (или МР-ангиографии) все же необходимо уточнить анатомию сосудов в области опухоли и их вовлеченность в опухоль, то обычная рентгеновская АГ, оставаясь пока эталонным исследованием сосудов, поможет разрешить указанные вопросы.
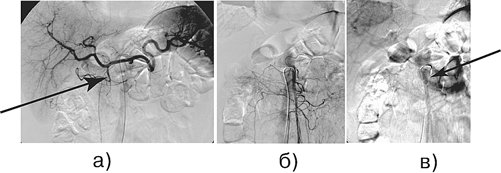
Рисунок 5. Больной М., 72 года. Диагноз: рак головки поджелудочной железы с инвазией верхней брыжеечной вены, T 4 N 1 M 0 :
а — целиакография: артериальная фаза, ригидность желудочно-двенадцатиперстной артерии; б — верхняя мезентерикография, артериальная фаза; в — возвратная мезентерикопортография: циркулярное сужение проксимального отдела верхней брыжеечной вены.В дальнейшем выполнена ГПДР с циркулярной резекцией верхней брыжеечной вены
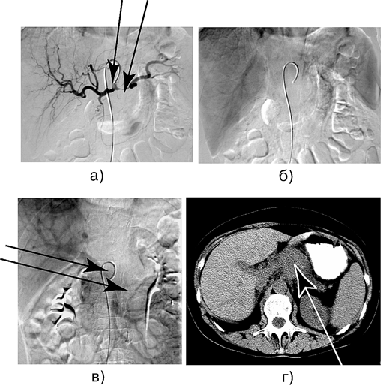
Рисунок 6. Больная Ш. Рак тела и хвоста поджелудочной железы с инвазией чревного ствола, общей печеночной артерии, селезеночной артерии, селезеночной вены и верхней брыжеечной вены:
а — целиакография: артериальная фаза, инвазия проксимального отдела общей печеночной артерии и селезеночной артерии; б — возвратная целиакоспленография, отсутствие контрастирования селезеночной вены; в — возвратная мезентерикопортография: циркулярное сужение проксимального отдела верхней брыжеечной вены; г — КТ: опухолевый узел в теле поджелудочной железы.
В дальнейшем выполнена дистальная субтотальная резекция поджелудочной железы с циркулярной резекцией чревного ствола, общей печёночной артерии, пристеночной резекцией верхней брыжеечной вены — аденокарцинома, pT4N1M0
Следует иметь в виду — только убедительные инструментальные признаки опухолевой инвазии прилежащих крупных артерий и значительный стеноз верхней брыжеечной и воротной вены вплоть до полной опухолевой окклюзии (тип D) при протоковом раке ПЖ могут рассматриваться как противопоказания к хирургическому удалению опухоли.
Описание проверено экспертом
Оцените статью:
- ВИПома
- Карциноидная опухоль поджелудочной железы
- Местнораспространенная аденокарцинома поджелудочной железы
- Рак поджелудочной железы
- Неоперабельный рак поджелудочной железы
- Глюкагономы
- Опухоли поджелудочной железы
- Опухоли поджелудочной железы экзокринные
- Опухоли поджелудочной железы эндокринные
Рак поджелудочной железы: шестое место по распространенности среди онкологических заболеваний
Рак поджелудочной железы – одно из самых сложных и агрессивных онкологических заболеваний. Вы узнаете о причинах, симптомах и факторах риска, связанных с этим недугом
Опубликовано на сайте: 26.08.24 | Обновлено на сайте: 19.08.24
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).




