- Факторы повышенного риска развития рака молочной железы
- Статистика
- Прогностические параметры
- Классификация рака молочной железы
- Методы диагностики злокачественных опухолей молочной железы
- Клинические варианты рака молочной железы
- Хирургические методы лечения рака молочной железы
- Лучевая терапия рака молочной железы
-
Схемы лечения больных
- Стадия 0
- Стадии I, IIA, IIВ
- Лечение рака молочной железы Т1 N0 М0
- Лечение больных Т2 N0 М0 (IIА стадия)
- Лечение больных Т1 N1 М0 (IIА стадия)
- Лечение больных Т2 N1 М0 — Т3 N0 М0 (IIВ стадия)
- Лечение больных местно-распространенным раком молочной железы III стадии
- Паллиативные хирургические вмешательства
- Лечение рака молочной железы у мужчин
- Неэпителиальные и фиброэпителиальные опухоли молочных желез
- Рак молочной железы и беременность
- Лечение метастатического рака молочной железы
C50 Злокачественные новообразования молочной железы, МКБ-10
- C50.0 Соска и ареолы
- C50.1 Центральной части молочной железы
- C50.2 Верхневнутреннего квадранта молочной железы
- C50.3 Нижневнутреннего квадранта молочной железы
- C50.4 Верхненаружного квадранта молочной железы
- C50.5 Нижненаружного квадранта молочной железы
- C50.6 Подмышечной задней части молочной железы
- C50.8 Поражение молочной железы, выходящее за пределы одной или более вышеуказанных локализаций
- C50.9 Молочной железы неуточненной части
Отредактировано: 02.04.2024
д.м.н., проф. Летягин В.П.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Факторы риска развития рака молочной железы. Статистика. Прогностические параметры. Классификация рака молочной железы. Методы диагностики злокачественных опухолей молочных желез. Клинические варианты рака молочной железы. Хирургическое лечение рака молочной железы. Лучевая терапия рака молочной железы. Лечение первичного рака молочной железы. Лечение рака молочной железы у мужчин. Неэпителиальные и фиброэпителиальные опухоли молочной железы. Рак молочной железы и беременность. Лечение метастатического рака молочной железы
Рак молочной железы (РМЖ) отличается многообразием клинических форм и характеризуется чрезвычайной прогностической пестротой. В настоящее время обязательные компоненты лечебно-диагностического процесса — изучение и учет для каждой конкретной пациентки ряда прогностических факторов. Основные прогностические факторы:
- Возраст.
- Состояние менструальной функции.
- Наличие рецепторов стероидных гормонов в опухоли.
- Клинические проявления болезни.
- Стадия процесса и его локализация.
Только определение всего спектра прогностических факторов позволяет с достаточной степенью объективности выработать план адекватных лечебных мероприятий. Для лечения больных РМЖ с успехом используются все существующие методы: хирургический, лучевой и лекарственный — которые чаще комбинируются друг с другом. В этой главе представлены самые эффективные современные методики, применяемые в практической онкологии, позволяющие добиться наиболее высоких отдаленных результатов.
РМЖ является самым распространенным онкологическим заболеванием среди женщин. В мире ежегодно регистрируются более 570 тыс. новых случаев заболевания, в странах Европейского Сообщества — 250 тыс., и 60 тыс. женщин умирают от этого заболевания.
В России, как и в большинстве стран мира, отмечается неуклонный рост заболеваемости РМЖ. В структуре заболеваемости злокачественными новообразованиями у женщин РМЖ с 1985 г. занимает первое место и его удельный вес постоянно увеличивается.
Факторы повышенного риска развития рака молочной железы
1. Факторы, характеризующие репродуктивную систему организма женщины:
а) менструальная, половая, детородная, лактационная функции;
б) гиперпластические и воспалительные заболевания органов малого таза.
2. Эндокринно-метаболические факторы, обусловленные сопутствующей патологией:
а) ожирение;
б) гипертоническая болезнь;
в) сахарный диабет;
г) атеросклероз;
д) заболевания печени;
е) гипотиреоз;
ж) дисгормональные дисплазии молочных желез.
3. Генетические факторы (носительство генов BRCA1 и BRCA 2):
а) РМЖ у кровных родственников;
б) молочно-яичниковый синдром (РМЖ и рак яичников в семье);
в) синдромы:
РМЖ + опухоль мозга;
РМЖ + саркома;
РМЖ + рак легкого + лейкоз + рак гортани;
SBLA-синдром + саркома + РМЖ+ лейкоз + карцинома коры надпочечников;
г) раково-ассоциированные генодерматозы:
болезнь Cowden — множественная трихилема кожи + рак щитовидной железы, аденоматозный полипоз, рак толстой кишки + РМЖ;
болезнь Bloom — аутосомальный наследственный дерматоз + РМЖ.
4. Экзогенные факторы:
а) ионизирующая радиация;
б) курение;
в) химические канцерогены, общие для всех локализаций опухолей;
г) избыточное потребление животных жиров, высококалорийная диета;
д) длительный прием некоторых лекарств (отрицательная роль до конца не прояснена).
Статистика
В России злокачественные опухоли молочной железы были обнаружены в 2000 г. у 44840 пациенток (38,24 на 100 тыс. населения). Диагноз морфологически верифицирован в 93% случаев. Около 17,6% новообразований выявлены при профилактических осмотрах. У 60,3% пациенток был РМЖ I—II стадии, у 26,1% — III стадии, у 12,4% — IV стадии.
Абсолютное число больных с впервые установленным диагнозом РМЖ в течение последних 10 лет увеличивается в среднем на 3,9% ежегодно, а заболеваемость возросла на 26,3%. Наиболее высокие уровни заболеваемости и темпы прироста показателей в 2000 г. отмечены в возрастных группах 60—64 и 75 лет и старше: 134,6 и 137,68 на 100 тыс. населения соответственно. Эти показатели увеличились в указанных возрастных группах по сравнению с 1991 г. в 1,5 и 1,95 раза соответственно. В возрастных группах 20—24; 25—29; 30—34 и 35—39 в течение последнего десятилетия (по сравнению с 1991 г.) отмечается стабилизация заболеваемости РМЖ: 0,59 и 0,73; 3,42 и 4,36; 13,12 и 14,28; 31,59 и 31,4 на 100 тыс. населения соответственно.
Наиболее высокие стандартизованные показатели заболеваемости женского населения злокачественными новообразованиями молочной железы в 2000 г. отмечены в Москве — 48,7; Санкт—Петербурге — 47,51; Еврейской автономной области — 44,61; Московской области — 44,38.
Злокачественные новообразования молочной железы имеют наибольший удельный вес в структуре смертности женского населения (16,4%). Стандартизованный показатель смертности женщин от злокачественных новообразований молочной железы вырос с 1991 по 2000 гг. на 17,29% и составил в 2000 г. 17,24 на 100 тыс. населения. Среднегодовой темп прироста — 1,79%.
Наибольший повозрастной показатель смертности женского населения от злокачественных новообразований молочной железы наблюдается в возрастных группах 75—79 и 80—84 лет — 88,87 и 89,35 на 100 тыс. соответственно.
Наиболее высокие стандартизованные показатели смертности на 100 тыс. женского населения России от РМЖ в 2000 г. отмечены в Москве — 24,11; Санкт—Петербурге — 22,75; Карачаево-Черкесской республике — 21,02; Московской области — 20,07; Приморском крае — 19,62.
В 2000 г. в России находились под наблюдением 353201 больная раком молочной железы, из них 5 лет и более —190030 женщин. Средний показатель 5-летней выживаемости при данной патологии в России равен 55%.
Прогностические параметры
Различия в течении заболевания у разных пациентов обусловлены биологическими особенностями опухолей. Это общеонкологическое представление применимо к РМЖ и включает в себя многие параметры, в т.ч.:
- Скорость роста опухоли.
- Способность опухоли к метастазированию.
- Особенности метастазирования.
- Гормоночувствительность.
- Химиорезистентность и ряд других.
Поэтому определение прогноза любого онкологического заболевания, включая РМЖ, предполагает по существу идентификацию маркеров, которые в той или иной степени связаны с перечисленными биологическими особенностями опухоли и позволяют прогнозировать развитие «естественной истории», подбирать оптимальную лечебную тактику и предсказывать ее эффективность.
Наиболее значимые прогностические параметры для больных раком молочной железы
- Размер опухоли.
- Наличие метастазов в регионарных лимфатических узлах.
- Гистологическая степень злокачественности.
- Уровень рецепторов стероидных гормонов (эстрогенов и прогестерона).
- Маркеры активности синтеза ДНК:
— индекс метки;
— фракция S-фазы;
— активность тимидинкиназы;
— Ki–67;
— плоидность или индекс ДНК.
- Рецепторы факторов роста или регуляторов роста, включая онкогены:
— рецепторы эпидермального фактора роста (EGF-R);
— HER2/neu;
— рецепторы инсулиноподобного фактора роста (IGF-R);
— рецепторы к соматостатину.
- Опухолевосупрессорные гены:
— р53;
— Nm23.
- Другие изучаемые параметры:
— heat-shock protein (hsр27);
— рS2;
— протеин, связанный с гаптоглобином;
— трансформирующий фактор роста альфа (TGF-α);
— катепсин D;
— активаторы плазминогена урокиназного типа;
— способность к колонеобразованию in vitro;
— концентрация в тканях ферритина;
— экспрессия рецепторов ламинина;
— белок, связывающий цАМФ;
— NRCR11 (3; 4; 5).
Параметры, прогнозирующие наличие микрометастазов
1. Выявление опухолевых клеток в регионарных лимфатических узлах.
Показано, что прогноз определяется не только фактом наличия микрометастазов, но и их количеством. Согласно современной концепции развития РМЖ процесс лимфогенного метастазирования при данном заболевании происходит одновременно с ростом первичной опухоли, поэтому лимфаденэктомия (с удалением I—III уровней лимфооттока) носит не столько лечебный, сколько диагностический характер.
2. Морфологические маркеры.
Давно известно, что некоторые гистологические характеристики опухоли являются важными прогностическими факторами, в частности, для больных без поражения зон регионарного метастазирования. Опухоли т.н. благоприятных гистологических форм (тубулярный, слизеобразующий, папиллярный рак) имеют показатели выживаемости при Т2 N0 лучше, чем инвазивный протоковый или дольковый рак меньшего размера.
Прогностически благоприятными факторами считаются лимфоидная инфильтрация опухоли и гистиоцитоз синусов лимфатических узлов.
Более серьезным прогнозом отличаются опухоли анеуплоидные, с высоким индексом ДНК и числом клеток в фазе синтеза более 7—14%.
Параметры, прогнозирующие чувствительность к проводимому лечению
1. Рецепторы стероидных гормонов.
Рецепторы стероидных гормонов — специфические белки, избирательно связывающие соответствующие стероиды после проникновения последних в клетку и опосредующие т.о. их биологические эффекты. Принципиально важным для женского РМЖ является присутствие в опухолевой ткани рецепторов эстрогена и прогестерона. С одной стороны, это свидетельствует о чувствительности к гормональной терапии, а с другой — о более высокой дифференцировке опухоли и соответственно о ее более низком потенциале метастазирования.
2. Эпидермальные факторы роста.
Многочисленными исследованиями было показано, что наличие в опухолевой ткани этих белков, особенно в отсутствие рецепторов к стероидным гормонам, свидетельствует о неблагоприятном прогнозе даже на ранних стадиях и о резистентности к проводимой гормонотерапии.
3. HER2/neu.
HER2/neu — представитель семейства трансмембранных тирозинкиназ, являющийся ключевым звеном передачи митогенных сигналов всех пептидов, подобных рецепторам эпидермального фактора роста. Он совершенно необходим для полноценного функционирования систем клетки в целом. Блокирование этого фермента может существенно замедлять или останавливать рост опухолей, зависимых от любых стимулов. Поэтому МКА к HER2/neu (трастузумаб, препарат Герцептин), при условии определения у пациентки экспрессии HER2/neu, способен в значительной степени интенсифицировать комбинированное и комплексное лечение с увеличением безрецидивного интервала.
Параметры, прогнозирующие прогрессирование и локализацию метастазов
Способность к метастазированию и инвазии — одно из фундаментальных свойств злокачественных опухолей.
Клиническая трактовка этой проблемы только вступает в фазу активных разработок. Интенсивные лабораторные исследования показали, что на всех этапах метастазирования центральное место занимает экспрессия специфических белковых факторов роста опухолевых клеток (протеаз). Считается, например, что плазмин, способный уменьшить уровень внеклеточных матричных гликопротеидов, играет решающую роль как в локальном распространении опухоли, так и в формировании метастазов в отдаленных органах и тканях. Важная роль в разрушении внеклеточного матрикса принадлежит также активатору плазминогена урокиназного типа — uPA. Соответственно подавление uPA на различных уровнях может стать перспективным направлением современной противоопухолевой терапии.
В последние годы много исследований посвящены неоангиогенезу, т.е. формированию новых сосудов в злокачественных опухолях. Важнейшим положительным регулятором ангиогенеза является фактор проницаемости сосудов. Исследованиями последних десятилетий показано, что этот фактор имеет, по-видимому, существенное значение для прогноза заболевания, а также влияет на чувствительность опухолей к химио— и гормонотерапии. Его высокий уровень свидетельствует о неблагоприятном прогнозе как при раннем, так и при распространенном РМЖ.
К клиническим маркерам плохого прогноза и метастазирования при РМЖ относятся рецепторы эстрогена (РЭ). У больных в предменопаузе с низким содержанием РЭ в первичной опухоли чаще наблюдаются висцеральные метастазы, тогда как у пациенток в постменопаузе с высоким содержанием РЭ чаще развивается поражение костей скелета.
Ежегодно данные о биологических маркерах РМЖ переоцениваются и дополняются новыми. Поэтому существующие сведения, несомненно, со временем будут унифицированы, а некоторые из них, возможно, утратят свое значение.
Однако практически выбор метода лечения определяется стадией опухолевого процесса, гистологической структурой опухоли (и степенью ее злокачественности), уровнем рецепторов стероидных гормонов (эстрогенов и прогестерона).
Наряду с традиционным особое место отводится иммуноморфологическому стадированию РМЖ.
В основе метода иммунодиагностики метастазов лежит специфика экспрессии ряда генов, присущая только эпителиальным клеткам. Продуктами этих генов являются цитокератины Egp 34, HMFG–1, раково-эмбриональный антиген (РЭА) и другие белки, которые могут быть обнаружены с помощью МКА. Экспрессия эпителиальных генов может быть установлена также на уровне мРНК методом обратной транскрипции и полимеразной цепной реакции (ПЦР).
Чувствительность иммуноморфологических методик с использованием МКА и чувствительность ПЦР примерно одинакова, но значительно превышает чувствительность морфологических методов.
Наиболее показательными маркерами, подтверждающими наличие метастатического поражения регионарного лимфатического аппарата при РМЖ, являются САМ5.2, ИКО–25, НЕА–125.
В большинстве случаев метастатические клетки в пораженных лимфатических узлах коэкспрессируют эпителиальные маркеры НЕА–125+ ИКО–25+ САМ5.2 (47%). Значительно реже обнаруживается реакция САМ5.2 в сочетании с ИКО–25 (14%) или без такового (13%). Другие комбинации антигенов немногочисленны.
Метастазирование в костный мозг заметно ухудшает прогноз течения РМЖ. Поэтому оценка микрометастазирования играет важную роль в определении тактики лечения, а иммунологические методики дают прекрасную возможность выполнения таких исследований с малым количеством материала. Наименьший процент метастазов в костный мозг отмечен при I стадии заболевания. Частота выявления опухолевых клеток в костном мозге возрастает уже при IIа стадии. Метастазы выявлены более чем в половине случаев при IIb, IIIb, IV стадиях. Наибольший процент микрометастазов отмечен при IIб стадии. Важным является то, что количество опухолевых клеток, определяемых иммуноцитологическим методом, является очень низким — от 1 до 12 на 1 млн миелокариоцитов.
Классификация рака молочной железы
Для клинициста крайне важно определить прогноз заболевания и спланировать наиболее эффективный курс лечебных мероприятий, для чего требуется объективная оценка анатомической распространенности поражения. Для этих целей необходима классификация, основные принципы которой были бы применимы ко всем локализациям злокачественных опухолей и которую впоследствии можно было бы дополнить сведениями, полученными при патолого-гистологическом исследовании, и/или данными хирургического вмешательства. Система TNM полностью отвечает этим требованиям для РМЖ.
При использовании TNM—классификации необходимо гистологическое подтверждение диагноза. Анатомическая часть, где развивается опухоль, фиксируется, но не учитывается при классифицировании. В случае одновременного развития нескольких опухолей в одной железе Т-категория определяется по наибольшей. Одновременно развившиеся билатеральные опухоли классифицируются раздельно.
Анатомические области и части
1. Сосок (С50.0).
2. Центральная часть (С50.1).
3. Верхневнутренний квадрант (С50.2).
4. Нижневнутренний квадрант (С50.3).
5. Верхненаружный квадрант (С50.4).
6. Нижненаружный квадрант (С50.5).
7. Аксиллярный отросток (С50.6).
Регионарные лимфатические узлы
1. Подмышечные (на стороне поражения) — интерпекторальные (лимфатические узлы Роттера) и лимфатические узлы, расположенные вдоль аксиллярной вены и ее притоков, — подразделяются на следующие уровни:
а) уровень I (нижние подмышечные) — лимфатические узлы, расположенные латерально по отношению к боковому краю малой грудной мышцы;
б) уровень II (средние аксиллярные) — лимфатические узлы, расположенные между латеральным и медиальным краями малой грудной мышцы, и интерпекторальные (лимфатические узлы Роттера);
в) уровень III (верхние подмышечные) — лимфатические узлы, расположенные медиально по отношению к медиальному краю малой грудной мышцы, включая подключичные и апикальные.
Интрамаммарные лимфатические узлы кодируются как аксиллярные (подмышечные).
2. Внутренние лимфатические узлы молочной железы (на стороне поражения) располагаются в эндоторакальной фасции, в межреберных пространствах вдоль края грудины.
Любые другие лимфатические узлы, пораженные метастазами, включая надключичные, шейные или контралатеральные внутренние лимфатические узлы молочной железы, обозначаются как отдаленные метастазы (М1).
Классификация по TNM
Критерий Т (первичная опухоль):
Тх — недостаточно данных для оценки первичной опухоли;
То — первичная опухоль не определяется;
Тis — преинвазивная карцинома: внутрипротоковая или внутридольковая carcinoma in situ или болезнь Педжета без наличия опухолевого узла (болезнь Педжета, при которой пальпируется опухолевый узел, классифицируется по его размерам);
Т1 — опухоль до 2 см в наибольшем измерении;
T1mic — микроинвазия до 0,1 см в наибольшем измерении;
Т1а — опухоль до 0,5 см в наибольшем измерении;
Т1b — опухоль до 1 см в наибольшем измерении;
Т1с — опухоль до 2 см в наибольшем измерении;
Т2 — опухоль до 5 см в наибольшем измерении;
Т3 — опухоль более 5 см в наибольшем измерении;
Т4 — опухоль любого размера с прямым распространением на грудную стенку или кожу (грудная стенка включает ребра, межреберные мышцы, переднюю зубчатую мышцу, но без грудных мышц);
Т4а — распространение на грудную стенку;
Т4b — отек (включая «лимонную корку»), или изъязвление кожи молочной железы, или сателлиты в коже молочной железы;
Т4с — признаки, перечисленные в Т4а и Т4b вместе;
Т4d — воспалительная форма рака.
Критерий N (регионарные лимфатические узлы):
Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов;
N0 — нет признаков поражения регионарных лимфатических узлов;
N1 — метастазы в смещаемых подмышечных лимфатических узлах(е) на стороне поражения;
N2 — метастазы в подмышечных лимфатических узлах(е) на стороне поражения, фиксированные друг с другом или с другими структурами;
N3 — метастазы во внутригрудных лимфатических узлах(е) на стороне поражения.
Критерий М (отдаленные метастазы):
Мх — недостаточно данных для определения отдаленных метастазов;
М0 — нет признаков отдаленного метастазирования;
М1 — имеются отдаленные метастазы (включая метастазы в надключичных лимфатических узлах).
Таблица 1
Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | T1 | N0 | M0 |
| Стадия IIa | T0 T1 T2 |
N1 N1 N0 |
M0 M0 M0 |
| Стадия IIb | T2 T3 |
N1 N0 |
M0 M0 |
| Стадия IIIa | T0 T1 T2 T3 |
N2 N2 N2 N1, N2 |
M0 M0 M0 M0 |
| Стадия IIIb | T4 Любая T |
Любая N N3 |
M0 M0 |
| Стадия IV | Любая T | Любая N | M1 |
Постхирургическая классификация
рТ — первичная опухоль
Постхирургическая классификация требует исследования первичной опухоли. По краю производимой резекции не должно быть опухолевой ткани. рТ-критерий соответствует Т-критерию:
pТis — рак in situ;
pТ1 — 2 см;
pТ1а — 0,5 см;
pТ1b — 0,5—1 см;
pТ1с — 1— 2 см;
pТ2 — от 2 до 5 см;
pТ3 — 5 см;
pТ4 — грудная стенка/кожа;
pТ4а — грудная стенка;
pТ4b — отек кожи/изъязвление, сателлиты;
pТ4с — признаки Т4а и Т4b;
pТ4d — воспалительная карцинома.
рN — регионарные лимфатические узлы
Для патогистологической классификации требуется иссечение и исследование хотя бы нижних подмышечных лимфатических узлов.
I уровень. В таком материале содержится обычно не менее 6 лимфатических узлов.
рNх — недостаточно данных для оценки состояния лимфатических узлов (регионарные лимфатические узлы не удалялись);
рNo — нет признаков поражения регионарных лимфатических узлов метастазами;
рN1 — выявлены метастазы в смещаемых лимфатических узлах на стороне поражения;
рN1а — только микрометастазы (не более 0,2 см);
рN1в — микрометастазы в 1 или нескольких лимфатических узлах (более 0,2 см);
рN1с — метастазы (до 2 см) в наибольшем измерении в 1–3 лимфатических узлах;
рN1d — метастазы (до 2 см) в 4 и более лимфатических узлах;
рN1е — метастазы (до 2 см) в наибольшем измерении, прорастающие капсулу лимфатического узла;
рN1f — метастазы (более 2 см в наибольшем измерении) в лимфатических узлах;
рN2 — метастазы в подмышечных лимфатических узлах, связанные друг с другом или с другими структурами на стороне поражения;
рN3 — метастазы во внутренних лимфоузлах(е).
рМ — отдаленные метастазы. рМ-критерии соответствуют М-критериям.
G — гистопатологическая дифференцировка
Gх — степень дифференцировки не может быть установлена;
G1 — высокая степень дифференцировки;
G2 — средняя степень дифференцировки;
G3 — низкая степень дифференцировки;
G4 — недифференцированные опухоли.
Гистологическая классификация
РМЖ относится к эпителиальным злокачественным опухолям, морфологическая структура его чрезвычайно многообразна и до некоторой степени определяется источником его развития.
Рак начинается большей частью в протоках разного размера, преимущественно мелких. Значительно реже процесс начинается в эпителии долек, давая развитие дольковому РМЖ. Эти формы являются исходными для всех других вариантов рака данной локализации.
Таким образом, с точки зрения морфологии, РМЖ представлен тремя большими группами.
1. Неинфильтрирующие опухоли:
а) внутрипротоковый рак;
б) дольковый рак.
2. Инфильтрирующие опухоли:
а) инфильтрирующий протоковый рак;
б) инфильтрирующий протоковый рак с преобладанием внутрипротокового компонента;
в) инфильтрирующий дольковый рак;
г) слизистый рак;
д) медуллярный рак;
е) папиллярный рак;
ж) тубулярный рак;
з) аденокистозный рак;
и) секреторный (ювенильный) рак;
к) апокриновый рак;
л) рак с метаплазией (плоскоклеточного, веретеноклеточного, хондроидного, остеоидного, смешанного типов);
м) другие.
3. Болезнь Педжета соска.
Помимо правильной интерпретации первичной опухоли в соответствии с современной терминологией, гистологическое исследование должно содержать следующую информацию:
1) данные о наличии или отсутствии нескольких очагов опухоли (мультицентричный рост), а также внутриорганных метастазов, обнаруживаемых в виде гнезд опухолевых клеток или округлых узлов за пределами первичного очага;
2) характеристику состояния окружающих тканей (например, кистозные изменения, гиперплазия эпителия и пролиферация в протоках и дольках, стромальные реакции);
3) данные о наличии или отсутствии местных клеточных мезенхимальных реакций вокруг опухоли (образование лимфоплазмоцитарных и гистиоцитарных скоплений, вала, окружающего опухоль, гистиоцитоза лимфатических узлов);
4) данные об исследовании регионарных лимфатических узлов, вырезанных из препарата после мастэктомии и изученных по группам (отдельно подмышечные и подключичные, а при расширении объема операции — парастернальные по межреберьям);
5) данные об изучении степени повреждающего действия предоперационного облучения, лекарственной терапии и их сочетания (в случае применения), т.е. патоморфоза;
6) данные о динамическом (до— и послеоперационном) изучении рецепторов стероидных гормонов в опухоли и ее метастазах.
Методы диагностики злокачественных опухолей молочной железы
Выбор правильного лечения возможен только при верном диагнозе и точной оценке распространенности РМЖ.
Пальпация
Является инициальным моментом в диагностическом поиске различной патологии молочных железы. Полноценный осмотр молочных желез проводится по строго определенному плану с использованием установленных положений. У молодых менструирующих женщин идеальным периодом регулярного динамического контроля является исследование в промежутке 7—10 дни нормального менструального цикла. Однако, если речь идет об узловом образовании, то время осмотра не имеет значения. К сожалению, пальпаторный метод не всегда выявляет истинные размеры опухоли. Для более точной диагностики применяется ряд лабораторно-инструментальных методик.
Маммографическое исследование
Играет большую роль в диагностике РМЖ благодаря высокой эффективности при распознавании и дифференциальной диагностике заболевания. По литературным данным, процент достоверности маммографического исследования составляет от 75 до 95%. При проведении массовых профилактических осмотров с использованием маммографии наряду с клиническим исследованием установлено, что РМЖ I стадии выявляется в 50–70% случаев. При непальпируемых опухолях метод маммографии может выявить рак в 18–33% случаев. При подозрении на внутрипротоковый рак, признаком которого является патологическая секреция из соска вне периода лактации, применяется дуктография — рентгенологическое исследование с контрастированием. Для этого в систему сецернирующих протоков вводят йодсодержащее водорастворимое контрастное вещество, после чего выполняют снимки в прямой и боковой проекциях. Современные рентгеновские установки обладают очень высокой разрешающей способностью, позволяя выявить злокачественные опухоли размером от 5 до 10 мм.
Несмотря на довольно высокую эффективность, метод имеет определенные ограничения, обусловленные пределами его возможностей.
В частности, это связано с обследованием молодых нерожавших женщин, маммография которым должна проводиться при условии высокой вероятности злокачественного процесса на основании данных пальпаторного обследования клиницистом.
В связи с внедрением в клиническую практику УЗИ (особенно с цветной допплерографией) удалось добиться значительного улучшения визуализации опухоли. Ряд исследователей предлагают дополнить рентгенологическое исследование молочной железы ультразвуковым, указывая на высокую разрешающую способность последнего в определении размеров опухолевого узла и особенностей сосудистого русла при различных заболеваниях молочной железы.
Однако УЗТ не обладает достаточной разрешающей способностью при опухолях менее 1 см.
При выявлении микрокальцинатов полученные данные хуже данных маммографии. В целом, по разным данным, диагностическая точность УЗИ не превышает 87% (рис. 1).
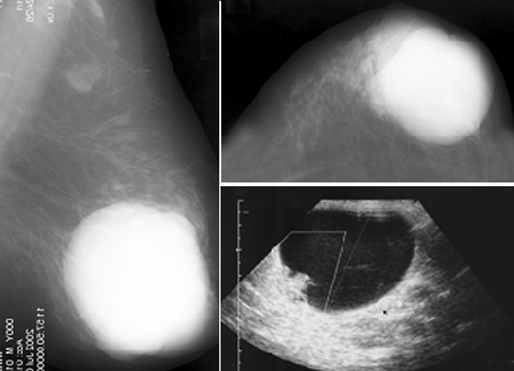
Рисунок 1. Разные лучевые методы в диагностике РМЖ
Термография
Этот метод уже достаточно широко применяется в клинической практике. Сущность его заключается в определении с помощью инфракрасных лучей температуры разных участков молочной железы. А поскольку при различных заболевания молочной железы происходят изменения кровотока и интенсивности обменных процессов, будет изменяться температура над пораженным участком. Однако диагностическая точность термографического исследования все же не так высока, как при маммографии и УЗИ. Поэтому данная методика в самостоятельном варианте используется лишь при определенных клинических ситуациях.
Цитологическое исследование
Позволяет судить о процессе до начала лечения, когда требуется максимально достоверное подтверждение клинического диагноза. При помощи этого метода определяются морфология и биология клетки, более полно характеризуется патологический процесс и, в первую очередь, некоторые особенности опухолевого роста на основе установления степени анаплазии и злокачественности клеток. Цитологический метод первоначально включал изучение только выделений из соска, и лишь после 50 гг. ХХ в. в клинике стала применяться и получила широкое признание пункционная цитология.
Достоверность цитологического метода диагностики РМЖ, по данным разных авторов, составляет от 60 до 98%, причем число предположительно положительных заключений обычно превосходит число ошибочных.
Оценить распространенность РМЖ без исследования лимфатических узлов подмышечного коллектора невозможно. Наиболее доступный и приемлемый метод исследования подмышечных лимфатических узлов — пальпаторный. Увеличение, уплотнение и потеря подвижности пальпируемых лимфоузлов — безусловный признак их поражения.
Ошибки при выявлении поражения подмышечных лимфатических узлов методом пальпации могут быть в сторону как гипо-, так и гипердиагностики. Затруднение выявления поражений подмышечных лимфоузлов может быть связано не только с обилием жировой клетчатки у некоторых больных, но и с частичным поражением лимфатического узла опухолевыми клетками (микрометастазы).
С целью оценки состояния подмышечно-подключичных лимфатических узлов в клинической практике J.B. Kinmonth еще в 1952 г. применил прямую цветную лимфографию, выделяя из клетчатки лимфатический сосуд, пунктируя его и вводя водорастворимое контрастное вещество.
Главным признаком метастатического поражения подмышечных лимфоузлов при проведении прямой контрастной лимфографии является дефект наполнения различной величины и формы, обусловленный опухолевым поражением определенного участка. Характерным для метастаза признаком может быть “изъеденность” контуров узла, возникающая в результате прорастания опухоли в капсулу и паренхиму.
Лимфоангиография
Этот метод еще не получил широкого распространения при диагностике РМЖ.
Радиоизотопная лимфосцинтиграфия
Этот метод основан на том, что метастатически измененные лимфоузлы, в отличие от нормальных, частично или полностью теряют способность накапливать изотоп, и на сцинтиграммах возникает картина дефекта наполнения.
K. Hultborn в 1955 г. получил интересные результаты при введении 198Au внутривенно и подкожно вблизи опухоли молочной железы. Изотоп накапливался в подмышечных лимфоузлах в течение 12–48 ч после инъекции. Отсутствие изображения лимфоузлов на сцинтиграммах рассматривалось авторами как результат поражения метастазами.
Другие методы
Некоторое время в целях верификации метастатического поражения лимфатических узлов использовалась аксиллография. Однако исследования последних лет показывают, что для этих целей более информативным является УЗИ, чувствительность которого, по разным данным, колеблется от 70 до 90%, а точность достигает 80%.
Наиболее сложна при РМЖ дооперационная диагностика метастатического поражения парастернальных лимфатических узлов. Недоступные прямому осмотру и пальпации, эти лимфатические узлы вызывали большой интерес у ученых.
Один из наиболее широко известных методов выявления поражения метастазами парастернальных лимфатических узлов — чрезгрудинная флебография. Контрастное вещество, введенное под давлением в губчатое вещество грудины, попадает через многочисленные vv. sternales во внутренние грудные вены обеих сторон парастернальной области. Лимфатические узлы парастернальных цепочек в первом и третьем межреберьях прилегают к стенкам вен, и увеличение их размеров при метастатическом поражении или гиперплазии может привести к изменению конфигурации вены, уменьшению калибра, а иногда и к полному перерыву.
Частота изменений на флебограммах, по данным ряда авторов, различна и колеблется от 20 до 55%. Число ошибочных заключений (в сторону как гипер-, так и гиподиагностики) не превышает 8—10%.
Необходимо отметить, что не всегда метастатическое поражение парастернальных лимфатических узлов проявляется на флебограммах. К недостаткам метода относится также невозможность проведения обследования определенной части больных из-за ряда противопоказаний (заболевания почек, печени, изменение миокарда, высокая индивидуальная чувствительность к препаратам йода и др.). В связи с этим в последние годы ведется поиск новых безопасных методов исследования лимфатических узлов парастернальной области.
В частности, предложен метод радиоизотопной лимфосцинтиграфии парастернальной области с применением коллоидного 198Au. Метод основывается на возможности транспорта коллоидных частиц, введенных подкожно, в регионарные для данной области лимфатические узлы. Задержка коллоидных радиоактивных частиц в лимфатических узлах обусловливает возможность их визуализации с помощью обычных сканирующих систем. Впервые сцинтиграфию парастернальных лимфатических узлов с применением коллоидного золота произвел R. Rossi (1962). В настоящее время для выявления поражения парастернальных лимфатических узлов наряду с радиоактивным коллоидным золотом используется 99mTc. Достоверность данных радиоизотопной лимфосцинтиграфии, по сведениям разных авторов, колеблется от 50 до 98%.
Визуальный осмотр парастернальных лимфоузлов — ретростерноскопия. Во время радикальной мастэктомии во втором межреберье рассекаются межреберные мышцы и обнажается парастернальное пространство, где видны внутренние грудные сосуды, по ходу которых располагаются парастернальная клетчатка и лимфатические узлы. В это пространство вводится детский бронхоскоп, с помощью которого производится визуальный осмотр парастернальных лимфоузлов. В случае выявления увеличенный лимфоузел либо извлекается, либо пунктируется с последующим морфологическим исследованием. Предложенный метод визуального осмотра парастернальных лимфатических узлов может успешно использоваться в клинической практике с целью морфологической верификации подозрительных лимфоузлов, выявленных при дооперационных исследованиях. При определенном практическом навыке исследование занимает не более 5—10 мин (подробнее см. соответствующий раздел).
В последнее время в связи с развитием эндохирургических методик в практическую деятельность все шире внедряется метод видеоторакоскопической лимфодиссекции.
Клинические варианты рака молочной железы
Наиболее часто встречающейся клинической формой РМЖ является узловая (75–80%), характеризующаяся образованием плотного узла в том или ином участке молочной железы. Чаще поражаются верхненаружные квадранты. Локализация в правой или левой железе равновероятны.
Признаки ранних форм РМЖ:
- Наличие определяемого узла в ткани молочной железы, без четких контуров, ограничено подвижного, плотной консистенции.
- Патологическая морщинистость или втяжение кожи над опухолью.
- Безболезненность опухолевого узла.
- Наличие одного или нескольких плотных узлов, свободноподвижных, небольших размеров в подмышечной области той же стороны.
Иногда первым проявлением и первой жалобой пациенток, страдающих РМЖ, являются различного характера выделения из соска молочной железы. Чаще всего подобные выделения носят серозный или кровянистый характер и дифференцируются с некоторыми доброкачественными заболеваниями.
При более распространенных процессах клиническая симптоматика значительно ярче:
1) симптом диффузного отека ткани молочной железы, или симптом «лимонной корки»;
2) изменения со стороны центрального отдела в виде отечности ареолы и уплощения соска — симптом Краузе;
3) различного характера деформации ткани органа;
4) заметное на глаз втяжение кожи в месте определяемой опухоли — симптом умбиликации (см. рис. 2 на цветной вклейке);
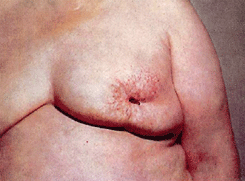
Рисунок 2. Симптом умбиликации
5) изъязвление или прорастание кожи над опухолью;
6) втяжение и фиксация соска;
7) конгломерат плотных, неподвижных, зачастую «вколоченных» лимфатических узлов в аксиллярной области;
8) надключичные метастазы с той же стороны или перекрестные подмышечные или надключичные метастазы;
9) боли в молочной железе;
10) выявляемые при обследовании отдаленные метастазы и соответствующая им симптоматика.
Другую группу составляют диффузные формы РМЖ. Для этой группы в целом характерна триада симптомов различной степени выраженности:
- отек;
- кожная гиперемия и гипертермия (см. рис. 3 на цветной вклейке).
- Значительная местная распространенность процесса, неблагоприятный прогноз и необходимость использования комплексной терапии.
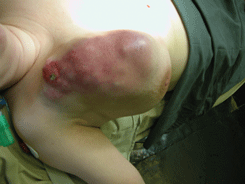
Рисунок 3. Кожная гиперемия и гипертермия
К диффузным формам РМЖ относится прежде всего инфильтративно-отечный вариант РМЖ (первично отечно-инфильтративная и вторично отечно-инфильтративная формы). Отличием этих двух вариантов является то, что при истинно отечно-инфильтративной форме клинически и рентгенологически узловое образование в ткани железы не определяется (при вторично отечно-инфильтративной форме характерно сочетание симптомов отека и узлового образования).
Вторым вариантом диффузных форм является маститоподобная форма РМЖ, описанная впервые в 1875 г. как карциноматозный мастит. Отличием ее является более выраженные симптомы кожной гиперемии и гипертермии по сравнению с инфильтративно-отечным вариантом.
Наибольшую степень выраженности отек, кожная гиперемия и гипертермия приобретают при рожистоподобной форме РМЖ (см. рис. 4 на цветной вклейке).
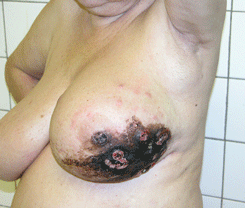
Рисунок 4. Распадающийся рак молочной железы
Еще одна своеобразная клиническая форма, относящаяся к редким, — рак Педжета молочной железы. Своеобразие данной формы определяется рядом факторов.
1. Клиническое начало часто напоминает экзему соска молочной железы, поэтому очень часто лечение начинается не у специалиста, а у дерматолога, терапевта, нередко и самолечение.
2. Эта форма — относительно благоприятная по течению морфологическая форма РМЖ.
3. Рак Педжета молочной железы высоко мультицентричен, а с условием локализации органосохранные типы оперативных вмешательств при этом варианте болезни не применяются.
4. Гормональная чувствительность рака Педжета ничем не отличается от типичной морфологической формы — протокового инфильтративного рака.
Хирургические методы лечения рака молочной железы
Условием успешного оперативного лечения рака молочной железы является правильное установление стадии заболевания. При начальных стадиях процесса хирургический метод остается основным и наиболее эффективным. При применении же комплексной терапии операция остается важнейшим звеном при лечении РМЖ. В последние годы в связи с внедрением восстановительных операций требования к оперативному вмешательству еще более повысились. Операции должны проводиться с минимальной травматизацией тканей при соблюдении всех принципов радикализма.
Совершенствование методов лечения РМЖ ведет к уточнению показаний к различным видам оперативного вмешательства. Основным критерием является степень распространенности процесса и возможность сочетания хирургического метода с другими. В широкой онкологической практике можно выделить следующие варианты оперативных вмешательств.
Радикальная мастэктомия по Холстеду-Майеру
В 1891 г. W. Halsted впервые опубликовал результаты предложенного им оперативного вмешательства с удалением обеих грудных мышц у 13 больных. Почти одновременно с ним W. Meyer в 1894 г. представил свой опыт использования аналогичной операции. Так возникла и затем сложилась классическая операция по Halsted-Meyer, которая в течение длительного времени была основной в хирургическом лечении РМЖ. Однако операция эта травматична и вызывает ряд осложнений: лимфорею, болевой синдром, плекситы и др.
Расширенная радикальная мастэктомия
Практически не применяется.
Радикальная мастэктомия с сохранением большой грудной мышцы (операция Пейти-Диссона)
В 1948 г. D. Patey и W. Dyson предложили свой вариант радикальной операции, который предусматривал сохранение большой грудной мышцы. При выполнении этого вмешательства в комбинации с облучением результаты лечения были такими же, как и при операции по Холстеду. Модификация, предложенная D. Patey, постепенно приобрела огромную популярность в силу ее меньшей травматичности и лучших функциональных результатов и стала широко применяться для лечения ранних стадий РМЖ в качестве самостоятельного метода, а затем и в комплексной терапии местнораспространенного рака.
Принципиальным ее отличием от радикальной мастэктомии является сохранение большой грудной мышцы. Выполняется она следующим образом:
1. Выбор кожного разреза индивидуализируется, как и при радикальной мастэктомии. Кожные лоскуты отсепаровываются в тех же границах, что и при операции по Холстеду.
2. После отсепаровки лоскутов рассекают фасцию по средней линии грудины; молочную железу вместе с фасцией отделяют от большой грудной мышцы острым путем до обнажения заднелатерального края этой мышцы.
3. Обнажив край мышцы и освободив ее заднюю поверхность от фасции, крючком Фарабефа мышцу отводят кпереди и медиально.
4. Подведя руку под большую грудную мышцу, хирург выделяет малую грудную мышцу, по возможности сохраняя сосуды и нервы, питающие большую грудную мышцу.
5. Выделенную малую грудную мышцу отсекают от клювовидного отростка лопатки и места прикрепления к передней стенке, низводя к общему блоку удаляемых тканей.
6. Обеспечив пересечением малой грудной мышцы широкий доступ к клетчатке сосудисто-нервного пучка, приступают к выделению последней в той же последовательности, что и при операции по Холстеду. Выделяют клетчатку в медиальной части сосудистого пучка и далее вдоль по вене к подмышечной впадине.
7. Выделение клетчатки с лимфатическими узлами доводят до края широкой мышцы спины, и выделенный подключично-подмышечно-подлопаточный блок вместе с малой грудной мышцей удаляют. Рану дренируют, как и при радикальной мастэктомии, с последующей активной аспирацией.
Преимуществами операции с сохранением большой грудной мышцы считают лучшее заживление раны, лучшие косметические и функциональные результаты. При этой операции почти не наблюдается лимфостаза верхней конечности. В то же время существенных отклонений в радикализме при этой операции по сравнению с другими типами нет.
Радикальная мастэктомия с сохранением обеих грудных мышц (типа операции Маддена)
Следующим этапом в развитии щадящих методик операции было предложение J. Madden (1965) удалять лимфоузлы подмышечной межпекторальной области в едином блоке с молочной железой, сохранив обе грудные мышцы.
Выбор кожного разреза индивидуализируется, как и при радикальной мастэктомии, с сохранением большой грудной мышцы.
После отсепаровки кожных лоскутов и выделения молочной железы с фасцией, покрывающей большую грудную мышцу от грудины до наружного края большой грудной мышцы, последнюю крючком Фарабефа отводят кпереди и медиально. Как при операции Пейти, но без иссечения малой грудной мышцы выделяют клетчатку по ходу сосудисто-нервного пучка. Малую грудную мышцу для лучшего ее выделения выделяют из фасциального футляра и отводят крючком кнаружи, а по выделении клетчатки медиальной зоны — кнутри. Клетчатка выделяется в объеме, необходимом для удаления подключично-подмышечно-подлопаточного блока, т.е. как при радикальной мастэктомии.
С 90-х гг. ХХ в. впервые в отечественной практике в клинике опухолей молочных желез в ГУ РОНЦ им. Н.Н. Блохина РАМН выполняется модифицированный вариант радикальной мастэктомии с сохранением большой и малой грудных мышц:
— при ранних стадиях РМЖ в качестве самостоятельного метода лечения,
— при местно-распространенных формах РМЖ — после предварительной неоадъювантной химиолучевой терапии.
Среди принципиально новых моментов, разработанных в нашей клинике, следует отметить следующие.
Эллипсоидным разрезом в поперечном направлении окаймляется пораженная молочная железа так, чтобы горизонтальная ось была перпендикулярной по отношению к парастернальным и аксиллярым линиям. Парусообразным возвышением краев кожи, пришитых держалками, проводится термокоагуляторная отсепаровка лоскутов по направлению часовой стрелки в пределах традиционно принятых границ. Молочная железа прошивается марлевой салфеткой и туго завязывается с четырех сторон для получения концентрированного препарата. В пространственном представлении дно операционного поля имеет конфигурацию изогнутого прямоугольника. Следующим этапом электрохирургической процедуры является пересечение апоневроза Жерди и оголение подмышечных сосудов. Острым путем производится диссекция лимфатических узлов I уровня вместе с рыхлой соединительной клетчаткой. При этом мелкокалиберные сосуды только коагулируются. Пересекается дистальный конец n. intercostabrachialis и полностью освобождается от клетчатки for. quadrilaterum. Железистая ткань отсекается от широчайшей мышцы спины вдоль всего протяжения. Снизу, также острым путем, оголяется v. thoracodorsalis вместе с одноименными артерией и нервом до границы ее впадения в подмышечную вену.
Мобилизованная нижнебоковая регионарная клетчатка сфокусирована в подлопаточной области. Далее осуществляется также термокоагуляционная отсепаровка молочной железы вместе с фасцией большой грудной мышцы от последней до ее латерального края в диагональном направлении. Поднимается большая грудная мышца, пересекаются a. et v. thoracoacromiales и выделяется межпекторальная клетчатка. Малая грудная мышца освобождается от фасциального футляра, берется на разработанный в нашей клинике муфтообразный зажим и низводится на всем протяжении ее ложа. Надсекается внутригрудная фасция, и острым путем выделяются апикальные лимфоузлы III уровня из пространства Лесфранка. После этого малая грудная мышца вместе с большой поднимаются вверх, и проводится диссекция лимфатических узлов II уровня. Проксимальный конец n. intercostobrachialis пересекается у межреберной мышцы, диссектором освобождается от прилежащей клетчатки n. thoracicus longus и сохраняется.
Таким образом, молочная железа вместе с регионарной клетчаткой и лимфатическими узлами всех уровней единым блоком отсекается без нарушения принципов радикализма.
Комментируя ход операции, следует подчеркнуть:
1. Разрез, после которого рубец повторяет траекторию ребра, оправдан по всем канонам пластической хирургии, не образуя в большинстве случаев такого нежелательного осложнения, как келоид. С точки зрения эстетики, низко расположенный рубец оправдан также с возможностью ношения открытых женских нарядов и купальных костюмов.
2. С хирургических позиций следует отметить чрезвычайно низкую вероятность краевого некроза. Раздвижением грудных мышц в противоположные стороны путем применения муфтообразного зажима обеспечиваем доступ к наиболее глубоко и труднодоступным апикальным лимфоузлам, что является ключевым моментом модифицированной радикальной мастэктомии с сохранением грудных мышц. Подобная манипуляция не описана в мировой литературе и может считаться рационализаторским предложением нашей клиники.
3. Сохраняя малую грудную мышцу, мы модифицировали и радикальную резекцию молочной железы, выполняемую при ранних стадиях рака.
Модифицированная радикальная мастэктомия в нашей клинике стала операцией выбора для всех стадий заболевания, обеспечивающей длительный безрецидивный период, минимальные последствия и создающей перспективу для реконструктивно-пластических вмешательств.
Мастэктомия
Мастэктомия — это удаление молочной железы с фасцией большой грудной мышцы. Данный тип операции применяется либо как паллиативное мероприятие при изъязвлениях, распадающихся опухолях, либо при противопоказаниях к радикальной мастэктомии в связи с сопутствующими заболеваниями, возрастом и т.д.
Операция может быть разделена на следующие этапы:
1. С учетом локализации опухоли и размеров поражения производят разрез, окаймляющий молочную железу.
2. Кожу с подкожным жировым слоем отсепаровывают на 3—5 см в стороны от кожного разреза.
3. По краю отсепарованных кожных лоскутов рассекают фасцию, покрывающую большую грудную мышцу.
4. Отделяя последнюю от мышцы, удаляют молочную железу вместе с фасцией, но сохраняя большую и малую грудные мышцы.
5. Ушивают кожную рану с дренированием ее через контрапертуру. При противопоказаниях к наркозу операция может быть выполнена под местным обезболиванием.
Радикальная резекция молочной железы
Операция заключается в удалении сектора молочной железы в одном блоке с лимфатическими узлами подключично-подмышечно-подлопаточной зоны. Показана такая операция при ограниченных по распространенности узловых формах опухолей с локализацией в верхненаружных квадрантах. Как самостоятельный метод — при I и IIа стадиях (T1–2 N0). Производится в несколько этапов:
1. Отступив не менее 3 см от пальпируемого края опухоли, двумя полуовальными разрезами в радиальном направлении рассекают кожу над молочной железой и отсепаровывают ее в сторону.
2. Из ткани молочной железы иссекают сектор, включающий опухолевый узел и визуально неизмененную ткань, на расстоянии 3–5 см от края опухоли в каждую сторону. Иссечение сектора производят по всей толще молочной железы, включая фасцию, покрывающую большую грудную мышцу в зоне соприкосновения с удаленным сектором.
3. Разрез кожи продолжают производить по наружному краю большой грудной мышцы к подмышечной впадине. Край мышцы обнажают и тупым крючком отводят кпереди и медиально.
4. Как при ампутации с удалением подмышечных лимфатических узлов (описание см. выше), выделяют подключично-подмышечно-подлопаточный блок клетчатки и лимфатических узлов с сохранением большой и малой грудных мышц.
5. Выделенную подключично-подмышечно-подлопаточную клетчатку удаляют единым препаратом вместе с сектором молочной железы. После гемостаза рану дренируют с активной аспирацией через дренаж.
Следует отметить, что некоторые зарубежные авторы рекомендуют проводить т.н. косметические разрезы кожи и выполнять данный тип операции из 2 разрезов. С нашей точки зрения, наибольшим основанием для удаления опухоли из 2 разрезов является медиальная локализация опухоли. Наружные локализации удобнее удалять по вышеописанной методике.
К особенностям послеоперационной терапии следует отнести активное аспирационное ведение раны. Постоянная аспирация через дренаж избавляет от необходимости наложения давящих повязок, облегчает течение послеоперационного периода, уменьшает количество кровянистой и серозной жидкости в послеоперационной ране, предупреждая образование сером и уменьшая лимфорею. Активное отсасывание проводят на протяжении 4–5 дней, после чего дренаж удаляют. В случае образования сером в более поздние сроки следует прибегать к повторным пункциям и отсасыванию содержимого полости.
В мире сегодня накоплен огромный рандомизированный клинический материал, касающийся целесообразности применения т.н. консервативных операций в сочетании с последующей лучевой терапией.
Послеоперационное облучение в ГУ РОНЦ им. Н.Н. Блохина РАМН проводится на гамма-установках типа “Рокус” или линейных ускорителях. Энергия торможения излучения в пределах 6—10 МэВ. В зону лучевого воздействия включаются молочная железа и ложе опухоли. РОД — 2 Гр, подводится 5 раз в неделю до СОД 50 Гр. При наличии метастазов в регионарных лимфатических узлах в зону облучения, кроме того, включается подмышечная зона. При локализации опухоли в медиальном и/или центральном отделах железы у больных с I-IIа стадией лучевой обработке подвергается зона парастернальных лимфатических узлов. Зоны регионарного лимфооттока облучаются в СОД 45 Гр.
В настоящее время в широкую клиническую практику вошли оперативные вмешательства меньшего, чем радикальная резекция, объема. Это — туморэктомия, лампэктомия, которые используются при ранних стадиях РМЖ, при Т1, Т2 ≤3см, когда достаточно велики размеры самой молочной железы, а границы резекции проходят, отступя 1 см от видимого края опухоли. При этом необходимо подчеркнуть два обязательных обстоятельства: рентгенологический контроль удаленного препарата и обязательное срочное гистологическое исследование краев резекции. Выполнение этого типа операции возможно только при отсутствии указаний на поражение краев разреза.
Тенденция сокращения объема операций на молочной железе коснулась и лимфодиссекции при ранних стадиях РМЖ. В этой связи B.M. Cabanas выдвинул концепцию «сторожевого» лимфатического узла, куда в первую очередь осуществляется лимфоотток из пораженного участка. Узел является своеобразным фильтром для опухолевых клеток и, таким образом, первым поражается метастазами. Для определения возможных путей лимфогенного метастазирования и «сторожевых» лимфоузлов применяются лимфотропный РФП (99mТс «Наноцисс»), обзорная сцинтиграфия с использованием компьютерного гамма-томографа до операции и портативного гамма-сканера C-TRAC (Arrow-Medical, США), состоящего из датчика-щупа и счетной камеры. А для визуализации «сторожевых» лимфатических узлов применяется синий краситель, вводимый в несколько точек по периметру опухоли за 1 ч до оперативного вмешательства. В последующем выполняется морфологическое исследование удаленных лимфоузлов с изготовлением парафиновых блоков, окрашенных гематоксилин-эозином, причем «сторожевые» лимфатические узлы исследуются на 10 срезах, а все остальные — с изготовлением 3 срезов с каждого лимфоузла. Истинно-положительным считается результат, при котором в «сторожевом» лимфатическом узле выявляли метастазы рака, истинно-отрицательным — при котором ни в «сторожевых», ни в других лимфоузлах метастатического поражения не обнаружено. Точность и чувствительность метода составляет 96,8% и 93,2% соответственно. В результате методика позволяет значительно сократить объем оперативного вмешательства на зонах регионарного метастазирования и может быть рекомендована для широкого применения.
Лучевая терапия рака молочной железы
Проблема лучевой терапии при РМЖ чрезвычайно важна. Этот метод лечения, получивший широкое распространение, может применяться как самостоятельно, так и в сочетании с другими методиками. В ходе развития лучевой терапии постоянно менялись варианты и способы лучевого воздействия: от использования ортовольтовой рентгенотерапии до применения тормозного излучения и электронного пучка бетатронов и линейных ускорителей, от дополнительного к операции лечебного фактора до самостоятельного метода лечения и от строго локального метода рационального воздействия до опосредованного угнетения функции гипофиза с помощью протонного медицинского пучка.
Желание изучить непосредственные и отдаленные результаты лечения привело к идее сочетанного использования облучения и операции, т.е. комбинированного лечения.
Существует 3 метода комбинированного лечения:
1. Облучение в предоперационном периоде с последующим оперативным вмешательством.
2. Операция с последующей лучевой терапией.
3. Лучевая терапия, проводимая как до, так и после операции.
1. Облучение в предоперационном периоде с последующим оперативным вмешательством
При операбельных опухолях (Т1–2 N0 М0 и Т1 N1 М0) используется методика предоперационного облучения крупными фракциями первичной опухоли и подключично-подмышечной зоны в течение 5 дней до СОД 20 Гр. Вызывая гибель малодифференцированных и анаплазированных клеточных популяций и подавляя дополнительные участки злокачественного роста, а также микрометастазы в лимфоузлах и лимфатических сосудах, данная методика является оправданной с онкологических позиций и не осложняет хирургического вмешательства, проводимого в ближайшие 1—3 дня после окончания облучения.
2. Операция с последующей лучевой терапией
Адъювантное облучение после сохранных операций является наиболее частым вариантом применения послеоперационной лучевой терапии. В зону лучевого воздействия включаются молочная железа и ложе опухоли. РОД равняется 2 Гр, подводится 5 раз в неделю до СОД 50 Гр при помощи гамма-установки «Рокус» или линейного ускорителя. При наличии метастазов в регионарных лимфоузлах в зону облучения включается подмышечная зона.
Регионарные зоны рекомендуется облучать в следующих случаях:
— при медиальной локализации — облучение парастернального коллектора;
— в случае поражения >50% аксиллярных лимфоузлов и при неблагоприятных морфологических признаках, а также при центральной локализации опухоли — подмышечный и подключичный коллекторы.
Объем послеоперационной лучевой терапии зависит от локализации опухоли (при внутренней локализации обязательно облучение парастернальной зоны) и наличия метастазов в регионарных лимфатических узлах, что требует обязательного облучения зон регионарного метастазирования.
У больных после мастэктомии, проведенной в связи с наличием опухоли, имеющей максимальный диаметр более 5 см, или при положительных по опухолевым клеткам хирургических границах опухоли риск локального рецидива достаточно высок, что оправдывает применение после подобной операции лучевой терапии на грудную стенку и регионарные лимфатические узлы. Женщины с четырьмя и более опухолеположительными лимфатическими узлами также находятся в состоянии повышенного риска в отношении местного рецидива заболевания, поэтому для них следует рассмотреть вопрос о проведении лучевой терапии на грудную стенку и надключичную область.
Регионарные зоны облучаются до СОД 45 Гр.
Начинать послеоперационную лучевую терапию рекомендуется не ранее 2-й и не позднее 5-й недели от момента выполнения оперативного вмешательства.
Основной задачей послеоперационного облучения молочной железы после сохранной операции является снижение числа местных рецидивов.
Итак, послеоперационное облучение после радикальной мастэктомии показано лишь в определенных случаях: центральная и медиальная локализация первичного очага в связи с высоким (до 55%) риском поражения парастернального коллектора (в данной ситуации облучение цепочки загрудинных лимфоузлов обязательно).
Дистанционная гамма-терапия в качестве самостоятельного метода лечения применяется достаточно редко.
Показания к консервативной лучевой терапии:
— абсолютные противопоказания к проведению оперативного вмешательства (пожилой возраст, тяжелая соматическая патология и т.д.);
— отказ больной от хирургического лечения;
— неоперабельная или отечно-инфильтративная форма РМЖ.
В данных случаях облучение производится в 2 этапа до СОД на опухоль молочной железы 60–70 Гр и 50 Гр — на зоны регионарного метастазирования.
Лучевая терапия является одним из важнейших компонентов комбинированного лечения местнораспространенного и метастатического РМЖ.
Целью облучения при данных стадиях болезни является разрушение первичной опухоли и метастазов в отдаленных органах и тканях.
Дистанционная лучевая терапия проводится на линейных ускорителях или гамма-аппаратах. Молочная железа облучается с двух тангенциальных полей, зоны регионарного метастазирования — через фигурное поле (надключично-подмышечное). СОД на основание молочной железы составляет 60 Гр, на зоны регионарного лимфооттока — 45—48 Гр, причем облучение регионарных зон проводится с применением формирующих блоков для защиты отдельных органов и тканей, располагающихся в пределах геометрического поля.
Облучение парастернальных лимфатических узлов осуществляется с одного переднего поля, захватывающего первые 6 межреберий на стороне поражения. Эту зону при наличии соответствующего оборудования можно облучать высокотехнологическим методом брахитерапии, СОД 60 Гр.
Принцип внутритканевой лучевой терапии (контактной, брахитерапии) для создания boost-дозы на ложе опухоли в настоящий момент чрезвычайно широко и активно используется во многих клиниках мира.
Более чем за 80-летнюю историю контактная лучевая терапия претерпела качественные изменения от простого внутриопухолевого введения препаратов до научно обоснованных методик контактной гамма-бета— и нейтронной терапии.
Особенно широко методы внутритканевой лучевой терапии для создания «ударной» дозы на ложе опухоли стали применяться после внедрения в клиническую практику аппаратов «Микроселектрон», «Гаммамед» и др. Благодаря появившейся возможности изготовления более миниатюрных по сравнению с 226Ra источников (137Cs, 60Co, 192Ir) с высокой удельной активностью прогрессивный принцип afterloading (последовательное автоматическое ведение источников) удалось распространить и на внутритканевую лучевую терапию, а также широко варьировать активность источников и мощность дозы излучения.
Существуют альтернативные методы использования источников иридия, цезия:
- Интраоперационное введение имплантационных игл.
- Ручное послеоперационное введение иридиевой проволоки.
- Использование гибких пластиковых трубок, проводимых через направляющие пластины с расстоянием 1,6–1,8 см между ними, что позволяет создать равномерное поле в облучаемых тканях.
Разработанные за последние годы и апробированные в ряде зарубежных клиник радионуклиды, такие как 103Pd, 143Sm, обладающие по сравнению с традиционными источниками более высокой активностью и коротким периодом полураспада, позволяют еще более усовершенствовать методику и технологию внутритканевой лучевой терапии.
Интраоперационное введение интрастатов через направляющие пластины при органосохранных операциях с последующим проведением внутритканевой лучевой терапии на ложе удаленной опухоли в необходимых объемах методом afterloading на аппаратах «Микроселектрон-HDR, LDR» в ГУ РОНЦ им. Н.Н. Блохина РАМН стали применять с 80-х гг. ХХ в.
При внутритканевой лучевой терапии парастернальной лимфатической цепочки используется разработанная в отделении радиохирургии ГУ РОНЦ им. Н.Н. Блохина РАМН методика.
После выполнения хирургического этапа по удалению первичной опухоли и подмышечно-подключично-подлопаточной лимфаденэктомии катетеризируется внутренняя грудная артерия для последующей внутритканевой лучевой терапии парастернальной зоны.
Информация о взаимном расположении интрастатов, общем объеме имплантата, его позиции — результат топометрического исследования, которое является обязательной частью предлучевой подготовки для всех видов контактного облучения и проводится на следующий день после операции. Целью его является рентгенологическое контролирование положения катетера во внутренней грудной артерии.
Внутритканевое облучение парастернальной цепочки лимфатических узлов проводится в «активной плате» блока закрытых источников в соответствии с технологической картой, где указываются:
— объем облучаемых тканей,
— тип источника, его активность, мощность,
— предполагаемая суммарная очаговая доза,
— время облучения.
Методика применима на следующие сутки после выполненного оперативного вмешательства, пролонгировано, непрерывно в течение 15—25 ч, во время которого подводимая доза составляет 15—25 Гр.
После окончания этапа внутритканевого облучения интрастаты удаляют, больную переводят в общую палату.
Лечение первичного рака молочной железы
За исключением преинвазивных форм РМЖ, программа лечения строится из двух компонентов: локального, к которому относятся хирургическая операция или лучевая терапия, и системного, осуществляемого с помощью химио— и гормонотерапии.
С этой точки зрения все формы РМЖ можно разделить следующим образом:
1) неинвазивные карциномы (LCIS, DCIS) — стадия 0;
2) операбельные инвазивные карциномы, к которым следует отнести РМЖ I-II и частично IIIA стадии;
3) неоперабельные (при первичном обращении) инвазивные карциномы (некоторые формы IIIА и стадия IIIВ);
4) метастатические или рецидивирующие карциномы.
Отличительной чертой лечебных методов для больных РМЖ является все более широкое использование органосохранных операций, особенно у больных ранними стадиями.
Подобное оперативное вмешательство позволяет свести к минимуму повреждения нормальной ткани молочной железы и кожи, а при сочетании с подмышечной лимфодиссекцией и последующей лучевой терапией позволяет получить такие же отдаленные результаты, как после мастэктомии.
Главными условиями планирования органосохраняющего лечения являются обнадеживающие отдаленные результаты, не уступающие таковым после радикальных мастэктомий, и хороший косметический эффект.
В 1965 г. академик Н.Н. Блохин разработал вариант сберегающей операции при наружных локализациях РМЖ, аналогом которого впоследствии стала квадрантэктомия, широко используемая в мире. Затем под руководством доктора В.В. Вишняковой было проведено первое рандомизированное исследование, доказавшее целесообразность подобного типа операций.
Дальнейшее усовершенствование методов консервативной хирургии привело к использованию более «экономных», чем квадрантэктомия, оперативных вмешательств — лампэктомии и туморэктомии.
Выбор того или иного вида лечения определяют несколько параметров:
— стадия опухолевого процесса,
— его локализация,
— менопаузальный статус и возраст пациентки,
— наличие и отсутствие рецепторов стероидных гормонов в опухоли, ряд факторов прогноза.
Схемы лечения больных
Стадия 0
Внутридольковая инфильтрирующая карцинома (LCIS)
Возможно несколько вариантов:
а) наблюдение (т.к. риск развития инфильтративного рака является низким — около 21%, т.е. 7,8 на протяжении 15-летнего срока наблюдения). Прием тамоксифена на протяжении 5 лет обеспечивает снижение риска развития рака на 56% (National Surgical Adjuvant Breast and Bowel Project, NSABP);
б) двухсторонняя мастэктомия с первичной маммопластикой, т.к. риск установления диагноза LCIS является одинаковым для обеих молочных желез.
Внутрипротоковая неинфильтративная карцинома (DCIS)
Также возможно несколько вариантов:
а) радикальная мастэктомия с сохранением обеих грудных мышц (если имеется поражение нескольких квадрантов, опухоль на фоне микро— и макрокальцинатов и т.д.), возможно, с первичной маммопластикой;
б) мастэктомия без лимфодиссекции (с предварительным удалением «сторожевого» лимфоузла при отсутствии его метастатического поражения), возможно, с первичной маммопластикой;
в) радикальная резекция с последующей лучевой терапией;
г) секторальная резекция (с исследованием «сторожевого» лимфатического узла) с последующей лучевой терапией.
В обзоре, посвященном лечению преинвазивного протокового рака, основанном на материале 36400 случаев, было показано, что наилучшие показатели 5-летней выживаемости получены у больных, перенесших радикальную мастэктомию с сохранением грудных мышц — 98–99% (при числе местных рецидивов 1–2%); после комбинации радикальной резекции с лучевой терапией этот показатель составил 91,1% (при местном рецидиве в 8,9%), а после радикальной резекции без облучения — 78% (при местном рецидиве в 22%). За последние 14 лет в ГУ РОНЦ им. Н.Н. Блохина РАМН находились на лечении 53 больные с диагнозом преинвазивный РМЖ разных морфологических вариантов: дольковый рак in situ — 14 пациенток, протоковый —18 и рак Педжета — 21 пациентка. При изучении отдаленных результатов общая и безрецидивная 5-летняя выживаемость при протоковом раке составила 90,5 и 83,3% соответственно, при преинвазивном раке Педжета— 95,2%. Наиболее эффективным вариантом лечения в данных группах была радикальная мастэктомия с сохранением обеих грудных мышц с возможной первичной маммопластикой. Общая и безрецидивная выживаемость при дольковом варианте неинвазивного рака равнялась 84,6%. Альтернативой мастэктомии при данной форме процесса следует считать секторальную резекцию с последующей лучевой терапией на оставшуюся часть молочной железы и зоны регионарного метастазирования.
<
Стадии I, IIA, IIВ
Местное лечение
На сегодняшний день существуют 2 варианта хирургического вмешательства:
а) радикальная мастэктомия с сохранением обеих грудных мышц (c возможной первичной маммопластикой);
б) радикальная резекция с последующей обязательной лучевой терапией (оценка состояния подмышечных лимфатических узлов осуществляется путем исследования «сторожевых» лимфатических узлов). Биопсия «сторожевых» лимфатических узлов не может быть рекомендована всем больным. Такая процедура рекомендуется только для тех случаев, когда она может быть проведена опытной специализированной бригадой; кроме того, в подмышечных узлах должны отсутствовать клинические признаки поражения, первичная опухоль должна быть одиночной, категории Т1 или небольшая опухоль категории Т2. При этом следует подчеркнуть, что в ряде случаев подобная тактика невыполнима в связи со следующими обстоятельствами:
— центральная локализация опухоли;
— мультицентричный характер роста;
— неблагоприятные рентгенологические данные (множественные микрокальцинаты, заинтересованность центральных отделов);
— мужской пол;
— заведомо неудовлетворительные косметические результаты (очень маленькая молочная железа);
— больная предпочитает мастэктомию;
— беременность.
К местному воздействию относится и лучевая терапия.
Существуют 3 метода комбинированного лечения:
1) облучение в предоперационном периоде с последующим оперативным вмешательством;
2) операция с последующей лучевой терапией;
3) лучевая терапия, проводимая как до, так и после операции (см. выше).
При операбельных опухолях (Т1–2 N0 М0 и Т1 N1 М0) используется методика предоперационного облучения крупными фракциями первичной опухоли и подключично-подмышечной зоны в течение 5 дней до СОД 20 Гр. Вызывая гибель малодифференцированных и анаплазированных клеточных популяций и подавляя дополнительные участки злокачественного роста, а также микрометастазы в лимфоузлах и лимфатических сосудах, данная методика является оправданной с онкологических позиций и не осложняет хирургического вмешательства, проводимого в ближайшие 1–3 дня после окончания облучения.
Адъювантное облучение после сохранных операций является наиболее частым вариантом применения послеоперационной лучевой терапии. В зону лучевого воздействия включаются молочная железа и ложе опухоли. Разовая доза равняется 2 Гр, подводится 5 раз в неделю до СОД 50 Гр при помощи гамма-установки «Рокус» или линейного ускорителя. При наличии метастазов в регионарных лимфоузлах в зону облучения включается подмышечная зона.
Регионарные зоны рекомендуется облучать в следующих случаях:
— при медиальной локализации — облучение парастернального коллектора;
— в случае поражения >50% аксиллярных лимфоузлов и при неблагоприятных морфологических признаках, а также при центральной локализации опухоли — подмышечный и подключичный коллектор.
Регионарные зоны облучаются до СОД 45 Гр.
Начинать послеоперационное лечение рекомендуется не ранее 2-й и не позднее 5-й недели от момента выполнения оперативного вмешательства. Основной задачей послеоперационного облучения молочной железы после сохранной операции является снижение числа местных рецидивов.
Послеоперационное облучение после радикальной мастэктомии показано лишь в определенных случаях. К ним относят центральную и медиальную локализации первичного очага в связи с высоким (до 55%) риском поражения парастернального коллектора. В данном случае облучение цепочки загрудинных лимфоузлов обязательно.
Лечение рака молочной железы Т1 N0 М0
При центральной локализации и отказе больной от выполнения органосохранного вмешательства — радикальная мастэктомия с сохранением обеих грудных мышц с возможной первичной или отсроченной маммопластикой. При медиальной локализации обязательно использование видеоторакоскопической лимфодиссекции с последующим применением контактной или дистанционной лучевой терапии на парастернальную зону.
Во всех остальных случаях — радикальная резекция с последующей лучевой терапией. В случае медиального расположения опухоли — обязательно использование видеоторакоскопической лимфодиссекции с последующим применением контактной или дистанционной лучевой терапии на парастернальную зону.
При наличии неблагоприятных прогностических факторов у молодых менструирующих больных показано использование 6 курсов системной адъювантной химиотерапии (САF). В менопаузальной группе при положительных стероидных рецепторах в опухоли возможно использование гормонотерапии 1-й линии (Mтамоксифен не менее 5 лет). Гормонотерапия у молодых больных применяется после соответствующего воздействия на яичники (эндоскопическая или лучевая кастрация, гозерелин).
Лечение больных Т2 N0 М0 (IIА стадия)
В ряде случаев, при опухолях размером >3 см возможно использование курса предоперационной лучевой терапии в режиме укрупненного фракционирования, либо нескольких (не менее 4) циклов неоадъювантной полихимиотерапии в целях возможного увеличения числа больных — кандидатов на органосохранное оперативное вмешательство.
Во всех остальных случаях тактика лечения сходна с таковой, применяемой при Т1 N0 М0 стадии первичного РМЖ.
Лечение больных Т1 N1 М0 (IIА стадия)
Лечение больных данной категории практически начинается с установления степени распространения опухолевого процесса по лимфатическим узлам на основании цитологических данных пунктата или при исследовании «сторожевого» лимфатического узла. Инициальным моментом комплексной терапии может быть крупнофракционная лучевая терапия с последующим выполнением операции:
1. При центральной локализации — радикальной мастэктомии с возможной первичной или отсроченной маммопластикой, а при медиальной локализации первичной опухоли — обязательно использование видеоторакоскопической лимфодиссекции с последующим применением контактной или дистанционной лучевой терапии на парастернальную зону.
2. Радикальной резекции (при внутренней локализации опухоли — из двух разрезов с возможной видеоторакоскопической лимфодиссекцией). Курс послеоперационного облучения (брахитерапия иди дистанционный режим) обязателен. При метастатическом поражении 1–3 регионарных лимфатических узлов — 6 курсов полихимиотерапии (либо антрациклиновые комбинации, либо классический СМF). При поражении 4 и более регионарных лимфатических узлов — 4 цикла антрациклинов (доксорубицин) с последующим использованием 8 циклов классического режима СМF. При положительных рецепторах эстрогенов в опухоли — тамоксифен 20 мг/сут в течение 5 лет (у молодых больных — после выключения функции яичников).
Лечение больных Т2 N1 М0 — Т3 N0 М0 (IIВ стадия)
Лечебные мероприятия для данной категории больных, как и в предыдущих случаях, состоят из местного и общего воздействий.
В отличие от предыдущих стадий, рассчитывая на возможность выполнения органосохранного оперативного вмешательства, целесообразно проведение нескольких курсов неоадъювантной химиотерапии с антрациклинами (4 цикла) с последующей лучевой терапией или их комбинации вне зависимости от локализации первичной опухоли. В этом случае изучение рецепторов стероидных гормонов в опухоли и некоторых прогностических факторов производится до начала специфической терапии с помощью трепанобиопсии опухоли. Повторное изучение факторов прогноза в динамике проводится после выполнения оперативного вмешательства.
В ситуациях, когда первичная опухоль не превышает 3 см, лечение может быть начато с курса предоперационной лучевой терапии укрупненными фракциями или же с операционного этапа:
а) радикальная мастэктомия с сохранением грудных мышц (при центральной локализации) с возможной видеоторакоскопической парастернальной лимфодиссекцией. Обязательным этапом адъювантного лечения следует считать лучевую терапию на парастернальную зону или брахитерапию. Возможна первичная или отсроченная маммопластика;
б) радикальная резекция (при медиальной локализации операция выполняется из двух разрезов с возможной торакоскопической парастернальной лимфодиссекцией). Обязательно проводится послеоперационная лучевая терапия.
Адъювантная химиогормонотерапия проводится по тем же показаниям и в тех же режимах, что и при лечении предыдущих стадий болезни. Следует отметить, что весьма перспективным является адъювантное применение таксанов, особенно в комбинации с антрациклинами (ТАС).
Лечение больных местно-распространенным раком молочной железы III стадии
Лечение местнораспространенного РМЖ складывается из 3 этапов:
— предоперационного (индукционного);
— местного (операция, или лучевая терапия, или их сочетание);
— адъювантной терапии.
Такая тактика, общепринятая в настоящее время, сложилась не сразу. Исходно местнораспространенный рак был идентифицирован как иноперабельный.
Иноперабельные больные получали лучевую терапию, а часть из них затем оперировали. В дальнейшем местное лечение стали дополнять химио— и гормонотерапией. Неудовлетворительные результаты были связаны с тем, что системную болезнь лечили местными средствами либо системную терапию применяли в последнюю очередь.
Революционным было предложение начинать лечение местнораспространенного рака как системной болезни с проведения индукционной системной и регионарной химиотерапии, что позволило увеличить число оперированных больных, уменьшить частоту возникновения местных и отдаленных рецидивов и тем самым улучшить результативность лечения данной категории больных.
Наиболее часто применяемые схемы химиотерапии: АС, FACVP, CMFA, CMFAV, AVCF, VAM, VCAF, CAMP, CAP или таксаны в комплексе с антрациклинами (АТ, ТАС). Считается, что на этапе индукции больная должна получить не менее 4–6 циклов химиотерапии.
Вопрос комбинации неоадъювантной химиотерапии и лучевой терапии рассматривается многими авторами, но оптимальная схема их применения остается неоднозначной. Кроме того, нет точных данных о том, следует ли использовать только один метод воздействия или их сочетание. Некоторые авторы считают, что предоперационное химиолучевое лечение обеспечивает наибольшую продолжительность жизни при РМЖ III стадии, а оптимальным является многокомпонентный подход к лечению (химиолучевое лечение + операция + химиогормонотерапия).
Основным типом оперативного вмешательства при этой стадии болезни является радикальная мастэктомия с сохранением обеих грудных мышц с возможной первичной, а лучше отсроченной маммопластикой.
Таким образом, возможность органосохраняющей операции при местнораспространенном РМЖ в большинстве современных публикаций оценивается весьма оптимистично. При этом исходят из двух принципиальных положений:
1) при раннем РМЖ с размером первичной опухоли до 3 см органосохраняющая операция в сочетании с лучевой терапией является столь же эффективным лечебным воздействием, как и радикальная мастэктомия с сохранением обеих грудных мышц;
2) больным местнораспространенным РМЖ после эффективного предоперационного лечения с остаточной опухолью до 3 см можно проводить такое же местное лечение, как и при раннем РМЖ.
Первое положение обосновано рандомизированными исследованиями (EBCTCG), второе требует подтверждения соответствующими исследованиями.
Абсолютное большинство современных публикаций в качестве выполняемого варианта радикальной мастэктомии описывают модифицированный вариант радикальной мастэктомии с сохранением одной или обеих грудных мышц, с удалением лимфатических узлов I-III уровней.
Адъювантная химиотерапия должна проводиться обязательно, и количество курсов должно быть не менее 6. Вопрос об использовании гормонотерапии 1-й линии (тамоксифен) решается традиционно: при положительном рецепторном статусе опухоли у молодых менструирующих женщин препарат назначается в стандартной дозировке не менее 5 лет после предварительной кастрации (оперативной, лекарственной или лучевой), у пожилых пациенток — без какого-либо воздействия на яичники.
Паллиативные хирургические вмешательства
У больных c местнораспространенным неоперабельным или метастатическим процессом по витальным показаниям (кровотечение или абсцедирование распадающейся опухоли) могут выполняться паллиативные оперативные вмешательства. Паллиативность этого вмешательства относительна. Паллиативная операция, выполняемая у больной, не имеющей отдаленных метастазов или при остающихся перспективах подавления диссеминированной болезни, по возможности должна носить все признаки радикальной операции. Совершенно не исключено, что после проведения адъювантного лечения первая пациентка окажется радикально излеченной, а второй будут подарены годы жизни.
Лечение рака молочной железы у мужчин
РМЖ у мужчин — заболевание редкое, встречающееся приблизительно в 100 раз реже, чем у женщин. Мы располагали обширным клиническим материалом (за последние 25 лет), включающим 152 больных РМЖ.
Наиболее часто это заболевание встречается в 6 и 7 декадах жизни. Средний возраст составил 55,8 лет, что несколько выше, чем у женщин.
Распределение по стадиям больных, наблюдавшихся в ГУ РОНЦ им. Н.Н. Блохина РАМН, представлено в таблице 2.
Таблица 2
Рак молочной железы у мужчин в зависимости от стадии
| Стадия | Количество больных | |
| Абсолютное число | % | |
| I — Ia | 28 | 20,6 |
| Ib | 31 | 22,8 |
| III | 42 | 30,8 |
| IV | 35 | 25,8 |
| Всего | 136 | 100,0 |
Обращает на себя внимание тот факт, что 56,6% больных находились в III—IV стадиях заболевания.
Анатомические особенности молочной железы у мужчин и близость железы к кожному покрову позволяют при обычной поверхностной пальпации выявить даже небольшие начальные изменения. Тем не менее, по нашим данным, только 34% мужчин, больных РМЖ, обращаются к врачу в течение первого месяца после выявления признаков заболевания. Остальные больные, обнаружившие у себя изменения в молочной железе, месяцы, а иногда и годы не обращаются за медицинской помощью. Однако запущенность РМЖ у мужчин связана не только с недостаточно внимательным отношением к себе со стороны пациентов, но и с отсутствием необходимой онкологической настороженности у некоторых врачей. По нашим данным, в 20% наблюдений правильный диагноз у мужчин, больных РМЖ, при первичном обращении к врачу не был установлен. Как бы ни были велики успехи в разработке новых методов лечения РМЖ, отдаленные результаты сегодня во многом зависят от степени распространенности опухолевого процесса к началу лечения. При начальных стадиях заболевания для полного выздоровления нередко бывает достаточно только хирургического вмешательства, радикальной мастэктомии (по Холстеду) или радикальной мастэктомии с сохранением большой грудной мышцы (по Пейти). Как показал наш опыт, при начальных стадиях заболевания последняя из указанных выше операций по радикальности ничем не уступает радикальной мастэктомии по Холстеду.
Именно высокий процент запущенности РМЖ у мужчин побудил нас к разработке комплексных методов лечения заболевания. Один из компонентов комплексного лечения — гормонотерапия, разработанная и примененная в ГУ РОНЦ им. Н.Н. Блохина РАМН при распространенных формах РМЖ у мужчин (орхэктомия с последующим длительным применением кортикостероидов). В последние годы появилась возможность исследования действия гормонов на субклеточном уровне. Наличие цитологических рецепторов в опухолях молочной железы выявлено не только у женщин, но и у мужчин. Так, наличие рецепторов эстрогенов в опухоли молочной железы может служить индикатором ее гормоночувствительности. В настоящее время имеются данные, свидетельствующие о том, что чувствительность опухоли к эндокринной терапии коррелирует с содержанием в ней рецепторов не только эстрогенов, но и прогестерона. Опухоли, содержащие оба типа рецепторов, считаются высокочувствительными к эндокринной терапии.
Так, из 49 мужчин, страдающих РМЖ, уровень рецепторов эстрогенов был повышен у 48, причем у 24 из них опухоль одновременно содержала и рецепторы прогестерона, уровень которых в ряде случаев был достаточно высоким: рецепторы эстрогенов (20 фмоль/мг белка) и прогестерона (15 фмоль/мг белка) достигали в ряде случаев соответственно 155,1 и 541,1. Применение антиэстрогенов, в частности, тамоксифена, при рецепторположительных опухолях открыло новые пути лечения этого заболевания у мужчин и позволило избежать применения разработанного ранее метода гормонотерапии: сочетания двухсторонней орхэктомии с длительным применением кортикостероидов.
В течение 25 лет значительно усовершенствовались также методы лучевой и химиотерапии. Однако если проанализировать и обобщить основные принципы проводимого лечения, то в течение всех лет при начальных стадиях РМЖ (I—IIa) основным методом было радикальное хирургическое лечение. При IIb стадии заболевания радикальная мастэктомия сочеталась в основном с лучевой и монохимиотерапией. В последние годы широко применяется комбинированная химиотерапия в ходе предоперационного лечения при III стадии и адъювантная терапия после радикальной мастэктомии, а также для лечения рецидива и метастазов. Начиная с III стадии заболевания, всем больным проводилась гормонотерапия, в IV стадии процесса — комплексное лечение, включающее химиотерапию и лучевую терапию. Радикальная мастэктомия выполнена только 16 из 35 больных РМЖ IV стадии.
Отдаленные результаты лечения изучены методом построения таблиц дожития (табл. 3).
Таблица 3
Отдаленные результаты лечения мужчин, больных РМЖ в зависимости от стадии заболевания
| Стадия | Кол-во больных | Выживаемость, % | |||
| 1 год | 3 года | 5 лет | 10 лет | ||
| I — Ia | 28 | 95,0 | 95,0 | 85,5 | 68,4 |
| Ib | 31 | 80,5 | 66,5 | 12,7 | |
| III | 42 | 77,0 | 58,7 | 51,3 | |
| IV | 35 | 69,7 | 41,5 | 21,5 | 4,7 |
| Всего | 136 | 89,1 ± 3,1 | 68,8 ± 5,0 | 51,6 ± 5,7 | 29,6 ± 6,0 |
Из представленных данных видно, что 5— и 10-летняя выживаемость у мужчин достаточно высока. Обращает на себя внимание довольно высокие показатели 10-летней выживаемости у больных I, IIa и III стадиями заболевания по сравнению с данными больных с IIb стадией. Возможным объяснением этому факту может быть более агрессивное лечение при III стадии рака с включением почти для всех больных этой группы комбинированной химиотерапии и гормонотерапии.
Из общего количества больных (152 больных) исключены 16 человек, у которых стадия РМЖ не известна.
На основании полученных данных можно рекомендовать проведение гормонотерапии антиэстрогенами больным РМЖ, начиная со IIb стадии заболевания при рецепторположительных опухолях.
Неэпителиальные и фиброэпителиальные опухоли молочных желез
Неэпителиальные и фиброэпителиальные опухоли (листовидная фиброаденома и саркомы) молочных желез представляют собой довольно редко встречаемую и поэтому мало изученную онкологическую патологию, составляя, по данным разных авторов, до 2% среди всех злокачественных опухолей молочных желез.
Фактором, объединяющим эту группу опухолей молочных желез, является то, что все они характеризуются как новообразования, имеющие двухкомпонентное строение с преобладающим развитием соединительнотканного компонента, который в саркомах является абсолютным, а в группе фиброэпителиальных опухолей сочетается с параллельным развитием эпителиального компонента. Существование единой морфогенетической цепи — листовидная опухоль — саркома молочной железы — диктует необходимость их параллельного изучения.
Редкость данных заболеваний, своеобразие клинического течения и полиморфизм гистологического строения, вероятно, объясняют разнородность взглядов как на природу указанных процессов, так и на адекватность лечебных мероприятий.
Появляющиеся редкие сообщения об этой группе опухолей носят, как правило, лишь описательный характер и подчеркивают сложность диагностики, лечения и его неблагоприятные результаты с 5-летней выживаемостью при саркомах молочных желез 16—68% в зависимости от гистологической формы опухоли.
Не существует единого мнения онкологов и об основном варианте лечения этих опухолей. Рекомендуется весь арсенал оперативных вмешательств, использующийся при лечении опухолей молочных желез, — от секторальной резекции до расширенной радикальной мастэктомии, хотя в работах последних лет ставится под сомнение необходимость выполнения лимфаденэктомии при саркомах молочных желез, т.к. подавляющее количество исследователей не выявляют метастазов в регионарные лимфоузлы.
История изучения филлоидных опухолей достаточно длительна и охватывает последние полтора столетия. В 1838 г. J. Muller впервые описал несколько необычных новообразований молочной железы и выделил их в особую нозологическую единицу. Предложенное им название “cystosarcoma phylloides” является распространенным и в настоящее время.
В работах, посвященных классификации и номенклатуре листовидной опухоли, выделяют до 80 ее наименований, наиболее часто употребляются такие, как “листовидная цистосаркома”, “филлоидная фиброаденома”, “листовидная фиброаденома”.
Способность к рецидивированию и малигнизации с развитием саркомы молочной железы является основной особенностью листовидных опухолей.
Подавляющее большинство описанных в мировой литературе листовидных опухолей молочных желез обнаружено у женщин. Описаны лишь единичные случаи развития данного новообразования у мужчин. Листовидная опухоль может возникнуть в различном возрасте — от периода раннего полового созревания и до старости.
В доступной нам литературе этот временной интервал колеблется от 10 до 90 лет. Этиология филлодных фиброаденом не ясна, равно как и их патогенез.
Окончательный диагноз листовидной опухоли может быть констатирован только при гистологическом исследовании. Среди дополнительных методов диагностики наиболее часто используется маммография.
Трудность диагностики, непредсказуемость клинического течения заболевания, большая вероятность рецидивирования опухоли объясняют множественность разноречивых предложений в выборе рационального метода лечения и объема оперативного вмешательства. Большинство авторов в случаях небольших доброкачественных листовидных опухолей предлагают ограничивать оперативное вмешательство объемом секторальной резекции. В случаях, когда опухоль занимает бóльшую часть молочной железы, достаточна мастэктомия. При злокачественной форме листовидной опухоли необходимо удаление всей молочной железы. Попытки снизить вероятность возникновения рецидива листовидной опухоли за счет проведения послеоперационной лучевой терапии не привели к желаемым результатам. Как было уже указано ранее, листовидные опухоли обладают способностью к метастазированию в регионарные лимфоузлы (единичные случаи), основной путь метастазирования — гематогенный. Наиболее вероятные места выявления метастазов — легкие и кости. Способность к метастазированию свойственна переходным и злокачественным формам и в целом отмечается в 30% случаев. Лечение метастазов представляет сложную задачу. Применение лучевой и химиотерапии неэффективно.
Другой, менее изученной, группой неэпителиальных опухолей молочных желез являются саркомы, обладающие значительно худшим прогнозом. Об этиологии сарком молочной железы известно не более, чем об этиологических факторах листовидных опухолей. Исходя из гистогенеза, неэпителиальные опухоли молочных желез могут быть отнесены к соединительно-тканным, липоматозным, неврогенным, сосудистым, хрящевым и костным. Помимо этого, описаны мезенхимомы и рабдомиосаркомы. Это указывает на соответствие гистогенеза сарком молочных желез таковому при саркомах мягких тканей. Однако первичный источник развития сарком молочных желез, в отличие от сарком других локализаций, может быть двояким: собственно соединительная ткань молочной железы, служащая источником развития “стромальных” сарком, и строма филлоидных фиброаденом. Разделяют саркомы молочных желез на клинико-гистологические типы, которые отличаются друг от друга прежде всего прогнозом и лечебными подходами. Выделены четыре типа опухолей:
— злокачественная филлоидная опухоль;
— фибробластическая и липобластическая саркомы;
— лимфоидная и ретикулярная саркомы;
— прочие (составляют до 7% от всех сарком молочных желез).
Саркомы молочных желез — достаточно редкое заболевание, составляет по отношению ко всем злокачественным заболеваниям молочных желез от 0,3 до 10,7%. Как правило, в анализируемой литературе данное заболевание встречается как описание конкретного случая. Имеются данные о выявлении сарком молочных желез у мужчин — единичные казуистичные наблюдения. Возрастные характеристики пациентов при саркомах молочных желез примерно соответствуют таковым при РМЖ, средний возраст составляет 40–50 лет. Из особенностей необходимо отметить возможность выявления этого заболевания практически в любом возрастном периоде. Саркомы выявляют как в первом десятилетии, так и на восьмом десятке жизни пациенток. Заболевание одинаково часто встречается как в правой, так и в левой молочной железе. Наиболее частой жалобой, заставляющей пациентов обратиться к врачу, является наличие опухолевидного, иной раз занимающего всю молочную железу, как правило, безболезненного образования. Саркомы молочных желез в целом характеризуются быстрым, а иной раз и стремительным ростом, достигая гигантских размеров в течение нескольких месяцев.
Практически всегда авторы использовали радикальную мастэктомию и лишь после анализа полученного материала (данные о поражении лимфоузлов, рецидивирование, особенности гистологических характеристик и др.) в большинстве случаев указывали на необоснованность лимфаденэктомии при саркомах молочных желез. Лимфаденэктомия не улучшает отдаленных результатов лечения. Сводные исследования указывают на выявление метастазов в регионарных лимфоузлах в 4% случаев. Наиболее часты упоминания о лимфогенном метастазировании при ангиосаркомах. Вероятно, различия в этих данных обусловлены малочисленностью групп пациенток, которые включены в анализ. Сведения о лучевой и химиотерапии при саркомах молочных желез неоднозначны, а часто и противоречивы. Данные о предоперационных химиолучевых воздействиях в анализируемой литературе крайне редки. Показана целесообразность проведения адъювантной химиотерапии при низкодифференцированном типе ангиосаркомы. Применение химиотерапии при других видах сарком носит лишь эпизодический характер, что не позволяет систематизировать этот опыт. Лучевая терапия показана лишь в случаях сомнительного радикализма оперативного вмешательства.
Ретроспективный анализ лечебных подходов, применявшихся в ГУ РОНЦ им. Н.Н. Блохина РАМН при курации пациентов, страдающих неэпителиальными и фиброэпителиальными опухолями молочных желез, показал: в клиниках наблюдались 144 пациентки с листовидными опухолями молочных желез и 35 больных, у которых выявлена саркома молочной железы. В данные группы включены только те больные, у которых диагноз заболевания подтвержден гистологически.
За последние 30 лет работы наблюдались всего лишь 144 больных с данной опухолевой патологией (в среднем 5 пациенток в год), что составляет 1,4% всех опухолевых заболеваний молочных желез. Мужчин с данной опухолевой патологией не выявлено.
Как было уже указано ранее, выделяют 3 гистологических типа листовидной опухоли: доброкачественный, промежуточный и злокачественный. В нашем исследовании преобладал доброкачественный — 87 больных (60,4%), в то время как злокачественный тип наблюдался у 21 пациентки (14,6%). У остальных 37 выявлен промежуточный гистологический тип.
Возраст больных колебался от 11 до 72 лет, составляя в среднем 42 года.
Листовидные опухоли одинаково часто поражали левую и правую молочные железы — 70 и 74 соответственно. Синхронное поражение молочных желез выявлено у 4 пациенток (2,8%) и не встречалось при злокачественном варианте опухоли. Мультицентричность опухоли отмечена в 4 случаях , сочетание с другими опухолями молочных желез (фиброаденомы) — в 5. Размер опухоли (при доброкачественном и промежуточном варианте) колебался от 1,5 до 35 см, составляя в среднем 6,5 см. При злокачественном варианте листовидной опухоли минимальный размер опухоли составлял 6 см, максимальный 40 см, при усредненном размере узла в 16 см.
Большинство пациенток обращались за медицинской помощью на протяжении года с момента выявления опухоли в молочной железе, хотя встречались больные с длительностью анамнеза в 18 и 25 лет. Нами не выявлено достоверной закономерности между особенностями течения заболевания и длительностью существования опухоли. В большинстве случаев (68%) пациентки отмечают этапность в развитии опухоли (характерно для всех гистологических вариантов) — период стабильного существования опухоли (длящийся иной раз десятилетиями) заканчивается этапом бурного роста образования, что, как правило, и является основной причиной обращения к врачу.
При мнимой простоте диагностики предварительная клиническая трактовка диагноза лишь в 28% случаев соответствовала диагнозу гистологическому.
Анализируя лечебные подходы (табл. 4) при доброкачественных и промежуточных вариантах листовидных опухолей, можно констатировать, что были использованы все варианты хирургических вмешательств, применяющиеся при заболеваниях молочных желез. Основным вариантом хирургического лечения является секторальная резекция молочной железы (80% случаев). Использование различного вида мастэктомий и радикальных резекций обусловлено либо большими размерами опухоли, либо ошибками диагностики.
Таблица 4
Варианты лечения больных с доброкачественными
и промежуточными вариантами листовидной опухоли
| Вариант лечения | Число больных |
Местные рецидивы |
| Энуклеация опухоли | 3 | 3 |
| Секторальная резекция | 99 | 9 |
| Подкожная мастэктомия | 4 | — |
| Мастэктомия | 11 | — |
| Радикальная мастэктомия (Пейти) | 3 | — |
| Химиотерапия, радикальная мастэктомия (Мадден) | 1 | — |
| Радикальная резекция | 1 | — |
| Радикальная резекция, лучевая терапия | 1 | — |
| Всего | 123 | 12 (9,7%) |
Как видно из таблицы, увеличение объема оперативного вмешательства приводит к уменьшению вероятности развития местного рецидива заболевания. Так, во всех случаях энуклеации опухоли возникли местные рецидивы, при секторальных резекциях в 9% случаях, а после мастэктомий возврата заболевания не возникло. Рецидивы в среднем развиваются через 17 мес (разброс временного интервала составляет 4 мес — 3 года). Не выявлено достоверных различий в склонности к рецидивированию в зависимости от гистологического варианта листовидной опухоли. Так, 7 из 12 больных с рецидивом заболевания имели промежуточный вариант опухоли. Пациенткам с рецидивами было проделано повторное оперативное вмешательство — в 3 случаях выполнена мастэктомия, в остальных — секторальная резекция.
Наличие злокачественности стромального компонента предопределило особенности течения заболевания. Нами не выявлено метастазов листовидных опухолей в регионарные лимфоузлы.
Таким образом:
1. Наличие опухоли в молочной железе является абсолютным показанием к оперативному вмешательству.
2. Секторальная резекция молочной железы является достаточным объемом операции при небольших размерах листовидной опухоли.
3. При значительных размерах узла или при тотальном поражении молочной железы необходимый объем операции — мастэктомия. Нет необходимости выполнять лимфаденэктомию при злокачественном варианте листовидной опухоли.
4. Имеющиеся данные не позволяют настаивать на ужесточении лечебных мероприятий при злокачественных листовидных опухолях (химио— и/или лучевая терапия) в надежде на улучшение отдаленных результатов лечения.
5. Лечение местных рецидивов листовидных опухолей не столь уж безнадежное мероприятие.
За аналогичный период времени в клиниках ГУ РОНЦ им. Н.Н. Блохина РАМН проведено лечение 35 пациентов с гистологически подтвержденным диагнозом саркомы молочной железы, что составляет 0,34% всех опухолевых заболеваний молочных желез. В данной группе опухолевой патологии выявлен 1 мужчина.
Средний возраст пациентов составляет 42,9 года (16–69 лет) и практически не отличается от такового при листовидных опухолях молочных желез. Не выявлено преимущества стороны поражения: процесс в левой молочной железе выявлен в 16 случаях, в правой — в 19. Мультицентричности, синхронности поражения в данной группе больных не отмечено. Размер опухолевого узла варьировал от 7 до 35 см, составляя в среднем 14 см.
Описывая свое заболевание, большинство пациентов отмечают быстрый, порой стремительный рост опухоли, что и является основной причиной обращения к врачу.
Клиническая картина принципиально не отличается от таковой при листовидных опухолях. Диагностические критерии более информативны, чем при последних. Маммографические критерии малигнизации процесса присутствуют в 70% случаев, а в цитологических заключениях в 65% случаев есть указания на наличие злокачественного новообразования, что в сочетании со стремительным ростом опухоли и ее большими размерами дают все возможности для установления правильного клинического диагноза.
Как видно из данных таблицы 5, оперативное вмешательство явилось неотъемлемым компонентом лечения у 91% больных (32 пациента), как самостоятельный вид первичного лечения — у 19 пациентов (54,3%). Троим больным предпринята попытка проведения химиотерапии.
Таблица 5
Лечение сарком молочных желез
| Вид первичного лечения | Число больных |
Рецидивы | 5-летняя выживаемость |
| Секторальная резекция | 8 (22,8%) | 8 (100%) | 2(25%) |
| Секторальная резекция + лучевая терапия | 1(2,8%) | — | 1(100%) |
| Секторальная резекция + химиотерапия | 1(2,8%) | — | 1(100%) |
| Мастэктомия | 11(31,4%) | 2 (18,2%) | 3(27,3%) |
| Мастэктомия + лучевая терапия | 2(5,7%) | 1 (100%) | — |
| Мастэктомия + химиотерапия | 3(8,6%) | 1(33,3%) | — |
| Мастэктомия + химиотерапия + лучевая терапия | 6(17,1%) | 3(75%) | — |
| Химиотерапия | 3(8,6%) | — | — |
| Итого | 35 | 15 (42,9%) | 7 (20%) |
Объем оперативного вмешательства варьировал от секторальной резекции до радикальной мастэктомии по Холстеду (радикальная резекция не выполнялась).
Данные таблицы красноречиво указывают, что объем оперативного вмешательства в виде секторальной резекции явно недостаточен — 100% рецидивирование заболевания.
В то же время проведение дополнительных лечебных мероприятий достоверно не влияет на характер течения заболевания. Лишь сопоставление течения заболевания с гистологической формой саркомы дает объяснение подобной ситуации: у 11 из 15 (73,3%) пациенток с местным рецидивом заболевания была выявлена ангиосаркома молочной железы, для которой характерно упорное рецидивирование и крайне неблагоприятный прогноз заболевания. Таким образом, течение заболевания больше зависит от гистологической формы заболевания, чем от объема лечебных мероприятий.
Касаясь выбора объема оперативного вмешательства, на наш взгляд, следует остановиться на мастэктомии. Лимфаденэктомия не имеет смысла: для сарком характерно гематогенное метастазирование (по нашим данным, при гистологическом исследовании метастазы саркомы в регионарные лимфоузлы выявлены не были). Метастазирование отмечалось преимущественно в легкие.
Выживаемость больных невелика. В течение 1-го года погибли 15 пациентов (42,9%), 5-летняя выживаемость составила 20%. 10 лет пережили 6 больных (17,6%). Анализируя гистологический тип опухоли у данных больных, выяснили, что у 4 из 7 пациентов, переживших 5-летний рубеж, была выявлена липосаркома, а все семеро имели в анамнезе либо медленный, либо двухфазный характер роста опухоли, что не позволяет исключить в данных случаях злокачественного варианта листовидной опухоли.
Лечение отдаленных метастазов малоэффективно. Отмечено лишь 2 случая успеха: после иссечениея солитарного метастаза в легком (липосаркома) пациентка жила в последующем 22 года и 1 случай эффективного химиотерапевтического воздействия при метастазах в легкие (злокачественная фиброзная гистиоцитома, 9 курсов химиотерапии с винкристином, карубицином и интерфероном) — смерть данной пациентки произошла через 5 лет после окончания химиотерапии от генерализации другого злокачественного заболевания — рака желчного пузыря.
Рак молочной железы и беременность
РМЖ является наиболее частой формой злокачественных опухолей, диагностируемых во время беременности. Частота РМЖ в период беременности колеблется от 1 случая на 1360 до 1 случая на 3200 женщин (Parente J.T., 1988). До 7,3% женщин моложе 45 лет, страдающих РМЖ, являются беременными или кормящими (Applewhite R.R., 1973). Учитывая тенденцию к увеличению возраста рожающих женщин, РМЖ может стать одной из основных опасностей для беременных.
Под определением “рак молочной железы, связанный (ассоциированный) с беременностью”, понимается возникновение РМЖ во время беременности, на фоне лактации и в течение одного года после завершения беременности. Редкость РМЖ, ассоциированного с беременностью, и неизученность проблемы приводит к различию взглядов на течение болезни у данной группы пациенток и отсутствию единой лечебной тактики.
Поздняя диагностика заболевания в период беременности является, скорее, правилом, чем исключением. Увеличение размеров молочных желез, изменение консистенции, усиленная васкуляризация, ряд возможных осложнений (мастит, галактоцеле) затрудняют осмотр и маскируют развивающуюся опухоль. Психологическая неготовность врача и пациентки к постановке диагноза ”рак”, зачастую нежелание выполнять какие-либо диагностические процедуры, такие как биопсия, приводят к более продолжительному времени наблюдения от выявления первых симптомов до установки диагноза по сравнению с обычной ситуацией (11 и 4 мес соответственно); лечение начинается при более распространенных стадиях болезни, чем у не беременных. В связи с этим наряду с более активным применением неионизирующих методов диагностики (УЗИ) необходимо более активно внедрять цитологические и морфологические исследования при появлении любых узловых образований в молочной железе во время беременности и лактации. При подтверждении РМЖ у беременных необходимо еще на диагностическом этапе выявлять «неблагоприятные» факторы прогноза (наличие отрицательных рецепторов опухоли, анеуплоидность опухоли, высокий митотический индекс, гиперэкспрессию HER2/neu) на основании данных морфологического и биохимического исследования материала трепанобиопсии опухоли для составления индивидуального плана лечения.
Лечебная тактика зависит и от дополнительных факторов: от желания пациентки сохранить беременность «во что бы то ни стало», от сроков беременности, от стадии заболевания и степени распространенности опухоли. Основываясь на результатах международных исследований, возможно сформулировать следующие принципы:
- Полихимиотерапия проводится, только начиная со II триместра беременности определенными препаратами.
- Лучевая терапия во время беременности не проводится.
Лечебные рекомендации определяются преимущественно распространенностью опухоли и сроком беременности. Диагностика распространенности опухоли и срока беременности предполагает применение неионизирующих методов, безопасных для плода, в т.ч. маммографии, УЗИ молочных желез, рентгенографии грудной клетки с защитным экраном (допустимая поглощаемая плодом доза при этом соответствует 0,6 мГр или 0,06 мрад, а риск побочных эффектов возрастает в III триместре беременности), а также, по показаниям — назначение скенирования скелета. При пальпируемых новообразованиях выполняется их пункционная биопсия. Отсутствие опухолевых клеток в пунктате позволяет проводить наблюдение. Выявление элементов опухоли обусловливает необходимость секторальной резекции. В наших наблюдениях раннего (N=0) РМЖ у беременных прогноз оказывался существенно хуже в возрастной группе до 35 лет — в этих случаях доминировали опухоли с отрицательными рецепторами эстрогенов, высокими митотическими индексами, что подтверждало быструю пролиферацию. Кроме того, в этих случаях отмечена высокая вероятность инвазии лимфатических сосудов, значительная частота анеуплоидных опухолей, другие факторы неблагоприятного прогноза, среди которых следует указать несвоевременную диагностику, а также выявление больных в более распространенной стадии заболевания.
Выбор решения о проведении лучевой или химиотерапии по поводу РМЖ во время беременности должен обусловливаться очевидной и непосредственной пользой данного лечения для матери сравнительно с возможностью повреждающего и отсроченного побочного действия лечения на плод.
Побочные эффекты ионизирующей радиации на плод определяются соотношением подведенной дозы и сроком беременности. Последний фактор имеет более важное значение: эмбрион (1–2 нед беременности) более подвержен повреждающим воздействиям, чем плод. При продолжении органогенеза (2–8 нед беременности) эмбрион более восприимчив к тератогенным повреждениям. Пороговая повреждающая доза — 10 рад (0,1 Гр или 10 сГр). Доза 10—15 рад приводит к повреждениям (дефектам развития, нарушениям ЦНС); повышение дозы до 50—200 рад приводит к задержке развития, а до 100—250 рад — к уродствам. В III триместре беременности (9–49 нед) наблюдается некоторое снижение чувствительности плода к лучевым воздействиям. Если при выборе метода лечения оказывается, что доза 10 рад и более была подведена в течение I триместра беременности, то следует рекомендовать медицинский аборт. Обоснованием такой рекомендации является исключительно повреждающее действие радиации на плод.
При сочетании РМЖ I—II стадии и беременности методом выбора является операция «модифицированной» радикальной мастэктомии (с сохранением малой и большой грудных мышц) с отсроченной пластикой. Органосохранное лечение в объеме секторальной резекции с подмышечной лимфаденэктомией, дополняемое послеоперационной лучевой терапией, сопряжено с лучевым воздействием на плод в дозе от 10 рад в начале до 200 рад в конце беременности. Если органосохранное лечение (секторальная резекция, аксиллярная лимфаденэктомия) проводится в течение III триместра беременности, то лучевую терапию возможно провести после родов. Больным местно-распространенным раком молочной железы стадии III(A-B)—IV, т.е. в тех случаях, когда лучевая терапия является неотъемлемой частью лечебного процесса, целесообразно искусственное прерывание беременности.
При назначении химиотерапии беременным больным РМЖ, так же как и при назначении лучевого лечения, следует руководствоваться соотношением благоприятных непосредственных (для больной) и неблагоприятных отдаленных (для плода) результатов. Поскольку плод чрезвычайно чувствителен к повреждающим воздействиям химиотерапии, ее нецелесообразно назначать в начале беременности. В этой связи лечащий врач должен установить, возможно ли, не причиняя вреда пациентке, отложить начало химиотерапии до II-III триместра беременности, когда препараты не смогут оказать повреждающего плод воздействия. Как очевидно, прерывание беременности становится неизбежным в тех случаях, когда химиотерапия жизненно необходима. Выбор препаратов становится важным фактором при назначении химиотерапии. Винкристин, винбластин, доксорубицин в меньшей степени воздействуют на плод во время I триместра беременности и относительно безопасны в последующие сроки. Циклофосфамид занимает последующее место по степени токсичности. Метотрексат и фторурацил обладают наибольшим повреждающим плод действием. Побочные эффекты таксанов изучаются. По данным некоторых исследований, доксорубицин и циклофосфамид являются препаратами выбора в тех случаях, когда химиотерапия назначается во II-III триместре беременности.
Выбор метода лечения в зависимости от стадии заболевания, по данным Американского хирургического общества (American College of Surgeons), представляется следующим образом: при T1abN0 M0 рекомендуется модифицированная радикальная мастэктомия с сохранением обеих грудных мышц с отсроченной реконструкцией. Органосохранные операции, дополняемые послеоперационной лучевой терапией, противопоказаны во время I триместра беременности.
При информированном согласии пациентки лучевая терапия может быть отложена до родов (в т.ч. и родов кесаревым сечением до наступления 9-месячного срока родоразрешения). Адъювантная химиотерапия при раннем раке (T1abN0M0) и благоприятных прогностических факторах не рекомендуется, поскольку выживаемость в таких случаях достигает 100%, а рецидивы опухоли не возникают. При неблагоприятных факторах прогноза (недифференцированные или анапластические опухоли, когда частота прогрессирования процесса достигает 11% за 10-летний срок наблюдения) рекомендуется назначить после родов химиотерапию при эстрогенотрицательных рецепторах либо тамоксифен при положительных рецепторах опухоли.
В течение I триместра беременности аборт по медицинским показаниям выполняется для того, чтобы провести химиотерапию без неблагоприятных последствий. Тамоксифен при беременности противопоказан. При IIA (T1N1M0) — IIB (T2N1M0) стадиях модифицированная радикальная мастэктомия с отсроченной пластикой является операцией выбора в течение всего срока беременности. Химиотерапия после прерывания беременности считается предпочтительным методом лечения во время I триместра. Секторальная резекция с подмышечной лимфаденэктомией и последующей лучевой терапией предусматривает необходимость прерывания беременности в I триместре. Если возникает необходимость в лучевой терапии, то ее следует отложить до II-III триместра.
В случаях, когда больная желает родить здорового ребенка, химиолучевая терапия может быть отсрочена до момента раннего родоразрешения, либо назначена с минимальным риском для плода. Тамоксифен при эстрогенположительных рецепторах назначается после завершения беременности (родами либо абортом) и адъювантной химиотерапии.
При местно-распространенном РМЖ стадии IIIA (T1–2N2M0; T3N1–2M0), IIIB (T4 любая N M0), T2N3M0 и при отечно-инфильтративных формах (T4dN1–2M0) рекомендуется прерывание беременности в качестве первого этапа лечения, за исключением тех случаев, когда решение принимается в III триместре беременности и больная (семья больной) считает приоритетом здоровье плода (будущего ребенка). В этом случае лечение проводится после раннего родоразрешения. Показана неоадъювантная терапия по схеме АС с лучевой терапией или без нее. После окончания химиотерапии и выполнения модифицированной радикальной мастэктомии или сохранной операции при эстрогенположительных рецепторах назначается тамоксифен. При отсутствии эффекта от неоадъювантной химиотерапии проводится химиотерапия таксанами (либо препаратами, в отношении которых проводятся клинические испытания).
В случаях, когда у беременных диагностируется РМЖ с множественными метастазами, приоритетной целью лечения становится здоровье плода/ребенка. Следует особо отметить, что выбор метода лечения следует определять индивидуально, и предпочтителен консилиум, с учетом данных о распространенности опухоли и срока беременности.
Вопрос о возможном выключении функции яичников (лекарственное, лучевое, оперативное) при положительных рецепторах опухоли с последующим назначением антиэстрогенов решается индивидуально после беременности и окончания полихимиотерапии.
Высказываемое рядом онкологов и гинекологов утверждение об обязательном и немедленном прерывании беременности при установлении диагноза рак на сегодняшний день не является абсолютным. Считается, что прогноз при сочетании РМЖ с беременностью в целом хуже, тем не менее, несмотря на чувствительность опухолевой ткани к гормональной стимуляции в период беременности и лактации, при сравнении равнозначных по возрасту и стадии заболевания групп больных выживаемость среди беременных и небеременных женщин одинакова (Barnovan Y., 1990). В ряде работ показано также, что прерывание беременности с последующим проведением химиотерапии не улучшает прогноза (Bush H., 1986.).
В ГУ РОНЦ им. Н.Н. Блохина РАМН с 1975 г. проводится исследование, направленное на изучение особенностей течения и прогноза РМЖ, связанного с беременностью. Проведено наблюдение за 47 пациентками в возрасте до 35 лет. При I и II стадиях 10-летняя общая и безрецидивная выживаемость соответствуют 62±14%. При III стадии 10-летняя общая и безрецидивная выживаемость составляют 39±9% и 38±10% соответственно, причем при III стадии результаты лечения беременных аналогичны результатам лечения III стадии в целом (10-летняя безрецидивная выживаемость 31,4±1,9%). Индивидуальный план лечения основывается на стадии заболевания, периоде беременности, наличии благоприятных и неблагоприятных факторов прогноза.
Лечение метастатического рака молочной железы
К клиническим факторам, позволяющим предсказать ответ на лечение и используемым при выборе терапии метастатического РМЖ, относятся:
1) продолжительность интервала между лечением первичной опухоли и возникновением признаков прогрессирования (метастазов) — чем он дольше, тем благоприятнее прогноз;
2) количество и локализация метастазов (только в кости или только локорегиональные — относительно благоприятно; в кости + локорегиональные или + отдельные метастатические узлы в легких, поражение двух органов, ограниченная опухолевая масса — менее благоприятно; поражение более двух органов, метастазы в печень, головной мозг, лимфангоит кожи или легких — неблагоприятно);
3) «эволюционные тенденции» метастазов — темп увеличения размеров, интервал до возникновения новых метастазов;
4) общее состояние больной;
5) возраст и менструальный статус больной (больные в постменопаузе имеют лучший прогноз);
6) содержание рецепторов стероидных гормонов в опухоли (больные с эстрогенотрицательными и прогестеронотрицательными опухолями редко реагируют на гормональную терапию, эффективность химиотерапии мало зависит от наличия или отсутствия этих рецепторов);
7) предшествовавшая химио— и гормонотерапия и ответ на нее.
Метастатический РМЖ считается хроническим заболеванием. Это видно из исследований как стандартной, так и высокодозной химиотерапии с невысоким процентом (от 3 до 25%) выживаемости (после полного регресса), длящейся иногда 5 или даже 10 лет.
Однако и в этих редких случаях остается неясным — излечен ли пациент. Поэтому реалистический план лечения пациентов метастатическим РМЖ представляется как оптимальное последовательное применение всех лечебных воздействий для достижения максимально паллиативного эффекта и отсрочки прогрессирования заболевания и смерти, по возможности, с минимальным токсическим эффектом.
Для выбора оптимального лечения больных метастатическим РМЖ периодически разрабатываются модели многоступенчатых алгоритмов. Большинство направлений лечения в подгруппах (или ступенях) моделей являются относительно произвольными, и наиболее важные направления в значительной степени зависят от характера восприятия их пациентом и лечащим врачом.
Один из таких алгоритмов, адаптированный из 3 представленных на ASCO–99, представлен на рисунке 5.
Рисунок 5. Диагноз метастатического РМЖ
В этой модели больные метастатическим РМЖ вначале оцениваются в отношении распространенности заболевания, наличия серьезных, угрожающих жизни осложнений, скорости прогрессирования и вероятности ответа на гормональное лечение. Пациентки, характеризующиеся низким риском осложнений и имеющие гормонозависимые опухоли, естественно, лучше и эффективнее первоначально лечатся с использованием гормональных средств. Такая стратегия одновременно и достаточно эффективна, и нетоксична у подавляющего большинства больных. Пациентки, опухоли которых хорошо реагируют на 1-ю линию гормонотерапии, как правило, реагируют и на 2-ю, а часто и на 3-ю и 4-ю линии. Виды гормональных воздействий и гормональных препаратов, используемых при метастатическом РМЖ, значительно изменились, и современная гормонотерапия, как правило, хорошо переносится и становится более эффективной.
Несмотря на прогресс в эндокринотерапии за последние 100 лет, у 30% больных она остается неэффективной. Открытие рецепторов эстрогенов и прогестерона позволило надежнее определять кандидатов для эндокринотерапии. Известно, что при высокой концентрации рецепторов эстрогенов и прогестерона (выше 20 фмоль/мл) до 70% больных РМЖ отвечают на гормонотерапию. Однако во всей популяции, включая и пациенток с отсутствием рецепторов в опухоли, только 30% пациентов положительно реагируют на гормонотерапию.
Назначение ингибиторов ароматазы нового поколения (анастрозол, летрозол, экземестан) при рецидиве заболевания на фоне ранее проводившейся адъювантной терапии тамоксифеном приводит к объективному регрессу еще у 25% больных, потерявших чувствительность к антиэстрогенам. Такая же схема последовательного применения сначала антиэстрогенов (тамоксифен) в течение 2–3 лет с последующим приемом ингибиторов ароматазы проходит сейчас проверку в клинических испытаниях адъювантной гормонотерапии.
При гормонозависимом метастатическом РМЖ, независимо от возраста больных, в качестве 1-й линии терапии чаще всего применяется тамоксифен. Терапия тамоксифеном позволяет контролировать заболевание в период от 9 до 12 мес.
Новое поколение ингибиторов ароматазы стремительно становится терапией 2-й линии у постменопаузальных женщин с распространенным РМЖ, прогрессирующим на фоне гормонотерапии тамоксифеном.
Применение ингибиторов ароматазы при распространенном РМЖ у женщин в постменопаузе началось с 1980 г. с внедрения аминоглутетимида. Многочисленные исследования подтвердили эффективность этого препарата в 1-й и 2-й линиях терапии. Аминоглутетимид, изученный в клинических испытаниях как препарат 2-й линии, показал схожую эффективность с хирургической адреналэктомией. Препарат не только ингибирует ароматазу, но одновременно угнетает синтез как глюкокортикоидов, так и минералокортикоидов, поэтому применение препарата требует одновременного использования гидрокортизона. Испытания нового поколения ингибиторов ароматазы (летрозол, анастрозол) показали их бóльшую эффективность по сравнению с прогестинами (мегестрол ацетат), а также лучшую переносимость и меньшую частоту токсических эффектов по сравнению с прогестинами и аминоглутетимидом.
Больные, у которых достигнут клинически благоприятный эффект от 1-й линии гормонотерапии, в случае последующего прогрессирования заболевания после первоначального объективного эффекта могут быть кандидатами для эндокринотерапии 3-й линии. В этих случаях обычно применяются прогестины: мегестрол и медроксипрогестерон ацетат. Эти препараты могут значительно улучшить состояние больных при средней продолжительности объективного ответа на терапию до 6 мес. Больные, опухоли которых не реагируют положительно на предшествующую терапию, как правило, не отвечают и на другие гормональные препараты. Имеются немногочисленные сообщения о том, что применение андрогенов больным, положительно реагирующим на гормонотерапию 1–3-й линии, может также вызвать объективный ответ и улучшение состояния пациентов продолжительностью 4–6 мес.
Больные, опухоли которых стали гормонорефрактерными, а также пациенты с быстро прогрессирующим опухолевым процессом, наличием тяжелых осложнений должны прежде всего направлятся на химиотерапию. В настоящее время считается стандартом лечения одновременное сочетание (комбинация) двух или трех химиопрепаратов. От 50 до 80% больных метастатическим РМЖ отвечают на 1-ю линию химиотерапии, при этом у 5–10% из них наблюдается полная регрессия опухоли. От 30 до 50% метастатических опухолей отвечают на химиотерапию 2-й линии, и далее процент реагирующих на химиотерапию 3-й и последующих линий явно снижается.
Пригодность трастузумаба в лечении Her2-положительных опухолей внесла еще большую сложность в этот алгоритм. Her2 представляет собой ген из первой группы семейства рецепторов факторов роста, повышенная экспрессия которого наблюдается у 20–30% больных РМЖ. Повышенная экспрессия этого онкогенного продукта ассоциируется с ускоренным темпом роста опухоли и ее метастазов, укорочением общей и безрецидивной выживаемости. Больные с Her2-положительными опухолями характеризуются более агрессивным течением заболевания по сравнению с пациентками с Her2-отрицательными опухолями. В серии исследований 1989–1998 гг., проведенных в Сан-Франциско, удалось получить антитела к этому гену, а позднее и лекарственную форму гуманизированного МКА — трастузумаб. В качестве монотерапии трастузумаб позволяет достичь полной или частичной регрессии опухоли у 13–20% больных.
Несомненно, при опухолях с повышенной экспрессией гена Her2, трастузумаб в сочетании с цитостатической терапией представляет собой оптимальный режим 1-й линии; как альтернатива в монорежиме трастузумаб может быть использован у больных, отказавшихся от химиотерапии. Хотя общая стратегия лечения этих больных все еще уточняется, представляется весьма вероятным, что сочетание трастузумаба с паклитакселом имеет эффективность, схожую со стандартным режимом — доксорубицин + циклофосфамид. Окажется ли комбинация таксан + антрациклин + трастузумаб безопасной или более эффективной, чем комбинация трастузумаб + паклитаксел, еще предстоит установить. С введением трастузумаба в общую лечебную практику также должна осваиваться методика тестирования на ген Her2.
В конечном счете «предпочтение» самим пациентом приемлемого риска, побочных эффектов и активности терапии представляются критически важными при планировании лечебной программы. Для некоторых больных основной целью является продолжительность жизни и максимальное уменьшение опухоли, независимо от сопровождающей терапию токсичности. Для таких пациентов более агрессивный подход, включая комбинированную химиотерапию, а иногда даже и высокодозную химиотерапию, может считаться приемлемым. Для других больных высшей ценностью является качество жизни. У таких больных, больных с положительными рецепторами опухоли к стероидным гормонам предпочтительной является гормонотерапия с максимальной отсрочкой тяжелой цитотоксической терапии.
Исследования в области молекулярной биологии постепенно открывают новые пути терапии РМЖ, основанные на генетической характеристике каждой опухоли, фундаментальном представлении об апоптозе, закономерностях ангиогенеза и метастазирования.
Литература
Андросов Н.С. и др. ...Мед. радиология.— 1988.— V. 33 (6).— С. 44–49.
Блохин С.Н. и др. ...Материалы I Междунар. симпозиума “Пластическая и реконструктивная хирургия в онкологии”. М., 1997.— C.135.
Бурлаков А.С. и др. ...Материалы I Междунар. симпозиума “Пластическая и реконструктивная хирургия в онкологии”. М., 1997.— С.153.
Вишневский А.А. и др. ...Хирургия.— 1982.— № 9.— С. 94–96.
Вишнякова В.В. ...Вопр. онкологии.— 1990.— 36 (5).— С. 540–545.
Воротников И.К. Опухоли молочных желез.— М.: ЯРК, 2000.— С. 271–293.
Габуния З.Г. ...Автореф. ...дис. докт. мед. наук.— М., 2002.— 41 с.
Гарин А.М. Новое в терапии рака молочной железы/Под ред. проф. Н.И. Переводчиковой. М., 1998.— С. 67–76.
Демидов В.П. и др. ...Материалы Всеросс. конференции “Реконструктивно-восстановительная хирургия молочной железы”. М., 1996.— С. 72–74.
Классификация по TNM. 1997.
Ковалев Б.Н. и др. ...Материалы IX Всеросс. конференции онкологов.— СПб., 2002.— С. 40–42.
Корытова Л.И. ...Практ. онкология.— 2000.— № 2.— С. 46–49.
Кушлинский Н.Е. и др. ...Вестник РАМН.— 2001.— № 9.— С. 65–67.
Летягин В.П. и др. ...Мед. радиология, радиац. безопасность.— 1994.— № 6.— С. 31–33.
Малыгин Е.Г. ...Автореф. ...дис. докт. мед. наук.— 1990.— 42 с.
Моисеенко В.М. Новое в терапии рака молочной железы/Под ред. проф. Н.И. Переводчиковой.— М., 1998.— С. 25–31.
Опухоли молочной железы (клиника, диагностика, лечение, прогноз)/Под ред. проф. В.П. Летягина. М., 2000.— 393 с.
Портной С.М. ...Дис. ...докт. мед. наук.— М., 1997.— 306 с.
Портной С.М. ...Практ. онкология. — 2000. — № 2. — С. 57–60.
Семиглазов В.М. ...Практ. онкология.— 2000.— № 2.— С. 26–30.
Трапезников Н.Н. и др. ...М.: РОНЦ им. Н.Н. Блохина РАМН.— 2001.— С. 10, 34.
Триголосов А.В.: Дис. ... канд. мед. наук.— М., 2001.— 129 с.
Тюляндин С.А. Опухоли молочных желез.— М.: ЯРК, 2000.— С. 182–215.
Хмелевский Е.В. и др. ...Вопр. онкологии.— 1997.— T. 43.— № 5.— C. 499–504.
Шомова М.В. ...Автореф. ...дис. докт. мед. наук.— 1999.— 45 с.
De Lena M. et al. ...Cancer Chemotherapy Pharmacol.— 1978.— P. 1–53.
Hortobagyi G.N. et al. ...Desease of the Breast.— Philadelphia: Lippincott-Raven, 1996.— P. 585–589.
Silverstein Melvin J. ...Baltimore.— 1997.
Veronesi U. et al. ...Oxford University press, 1995.— P. 1241–1292.
Описание проверено экспертом
Оцените статью:
- Рак молочной железы
- Рак молочной железы гормональнозависимый
- Рак молочной железы в постменопаузе
- Распространенный рак молочной железы
- Диссеминированная карцинома молочной железы
- Злокачественная опухоль молочной железы
- Злокачественное новообразование молочной железы
- Рак грудных желез у мужчин
- Диссеминированный рак молочной железы
- Карцинома молочной железы
- Местно-распространенный рак молочной железы
- Местно-рецидивирующий рак молочной железы
- Эстрогензависимый рак молочной железы
- Местно-распространенный или метастатический рак молочной железы
- Рецидивирующий рак молочной железы
- Гормонозависимая форма рецидивирующего рака молочной железы у женщин в менопаузе
- Гормонозависимый рак молочной железы
- Метастазы опухолей молочной железы
- Рак груди у женщин с метастазами
- Рак груди у мужчин с метастазами
- Рак молочной железы с отдаленными метастазами
- Рак молочной железы с локальными метастазами
- Рак молочной железы с регионарными метастазами
- Распространенные гормонозависимые формы рака молочной железы
- Рецидивы опухолей молочной железы
- РМЖ
- Неоперабельная карцинома молочной железы
- Неоперабельный рак молочной железы
- Эстрогенозависимый рак молочной железы
- Диссеминированный рак молочной железы с гиперэкспрессией HER2
- Контралатеральный рак молочной железы
- Метастазирующая карцинома молочной железы
- Метастатическая карцинома молочной железы
- Рак грудной железы
- Рак молочной железы с метастазами
- Рак молочных желез с метастазами
- Рак соска и ареолы молочной железы
- Опухоли молочных желез
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
новообразование молочной железы
злокачественное новообразование молочной железы
Эстрогензависимые опухоли молочной железы у женщин в пременопаузальном периоде, диагностированные или подозреваемые новообразования молочной железы, опухоли молочной железы, Установленные или подозреваемые злокачественные новообразования молочных желез, злокачественные новообразования молочной железы, злокачественные опухоли молочной железы или подозрение на их наличие, Рак молочной железы или подозрение на него, Диагностированные гормонозависимые злокачественные заболевания молочной железы или подозрение на них, Рак молочной железы, подозрение на рак молочной железы, подозреваемый рак молочной железы, установленный рак молочной железы, диагностированный рак молочной железы, диагностированный рак молочной железы (РМЖ), подозреваемый рак молочной железы (РМЖ), Гормонозависимые злокачественные новообразования молочной железы, выявленные гормонозависимые злокачественные новообразования молочных желез, Рак грудной железы, рак молочной железы (в результате индуцированной фенотиазином секреции пролактина возрастают потенциальный риск прогрессирования болезни и резистентность к лечению эндокринными и цитостатическими лекарственными средствами), Выявленные гормонозависимые злокачественные заболевания молочной железы, раке молочной железы, карцинома молочной железы, выявленные гормонозависимые злокачественные новообразования молочной железы, Гормонозависимые злокачественные опухоли молочной железы в настоящее время, подозрение на гормонозависимые злокачественные новообразования молочной железы, раком молочной железы, подозрение на гормонозависимые злокачественные опухоли молочной железы, карцинома грудной железы у мужчин, ранних стадиях РМЖ, выявленные гормонозависимые злокачественные заболевания молочных желез, рака молочной железы, диагностированный или подозреваемый рак молочной железы (РМЖ), Выявленные гормонозависимые злокачественные заболевания молочных желез,, подтвержденный рак молочной железы, подтвержденный диагноз рака молочной железы, андрогензависимой карциномой молочной железы, наличие гормонозависимых злокачественных заболеваний молочной железы,



