- Этиология и эпидемиология
- Патологическая анатомия и классификация РМП
- Клиническая классификация РМП
- Классификация по TNM
- pTNM — патолого-анатомическая классификация
- G — гистопатологическая градация
- Клиническая картина РМП
- Диагностика РМП
- Лабораторная диагностика
- Прогностические факторы при РМП
- Клинические факторы
- Гистологические факторы
- Биологические факторы
- Лечение РМП
- Лечение поверхностного РМП
-
Лечение инвазивного РМП
- Цистэктомия
- Деривация мочи
- Резекция мочевого пузыря
- Лучевая терапия
- Лучевая терапия по радикальной программе
- Предоперационная лучевая терапия
- Послеоперационная лучевая терапия
- Интраоперационная лучевая терапия
- Внутриполостная лучевая терапия
- Брахитерапия рака мочевого пузыря
- Химиотерапия при раке мочевого пузыря
- Неоадъювантная химиотерапия
- Адъювантная химиотерапия
- Лечение диссеминированного РМП
C67 Злокачественное новообразование мочевого пузыря, МКБ-10
- C67.0 Треугольника мочевого пузыря
- C67.1 Купола мочевого пузыря
- C67.2 Боковой стенки мочевого пузыря
- C67.3 Передней стенки мочевого пузыря
- C67.4 Задней стенки мочевого пузыря
- C67.5 Шейки мочевого пузыря
- C67.6 Мочеточникового отверстия
- C67.7 Первичного мочевого протока (урахуса)
- C67.8 Поражение мочевого пузыря, выходящее за пределы одной и более вышеуказанных локализаций
- C67.9 Мочевого пузыря неуточненной части
Отредактировано: 02.04.2024
д.м.н. Фигурин К.М.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Статистика. Этиология и эпидемиология. Патологическая анатомия и классификация. Клиническая классификация и картина. Диагностика и прогностические факторы. Лечение
Статистика
Рак мочевого пузыря (РМП) является одним из наиболее распространенных онкологических заболеваний. В 2000 г. он занимал в структуре онкологической заболеваемости населения России 8-е место среди мужчин и 17–18 — среди женщин; было выявлено 11958 новых случаев заболевания. Заболеваемость составила: среди мужчин 11,3, а среди женщин — 1,6 на 100 тыс. населения. Среди всех больных злокачественными новообразованиями РМП болели 4,4% мужчин и 1,1% женщин. Прирост заболеваемости в 2000 г. по сравнению с 1990 г. составил 15,3% для мужчин и 10% для женщин. На конец 2000 г. на учете в онкологических диспансерах состояло 52338 больных РМП. Средний возраст заболевших составил 67,3 года.
У впервые заболевших диагностированы: I-II стадии заболевания — в 45,8%, III стадия — в 35,2%, IV стадия — в 13,6% наблюдений. Летальность в течение первого года с момента установления диагноза составила 29,3%.
Заболеваемость РМП различна в разных странах. Так, в США ежегодно регистрируется приблизительно 54400 новых случаев заболевания, более 12500 человек умирают от РМП.
Этиология и эпидемиология
РМП является демонстративным примером влияния экзогенных и эндогенных факторов на развитие опухоли. Такими факторами являются контакт с некоторыми химическими веществами, курение сигарет, инфекции и хроническое раздражение мочевого пузыря, облучение области таза.
В 1895 г. Rehn впервые обосновал связь между РМП и контактом с химическими красителями в Германской промышленности. В дальнейшем подобная корреляция была подтверждена другими исследователями. Установлено, что большинство канцерогенов относятся к ароматическим аминам и их производным (бета-нафтиламин, бензидин, 4-аминобифенил, нитрозоамины). Повышенный риск заболеть РМП имеют рабочие, занятые в производстве и применении красителей, на текстильных и резиновых предприятиях, водители грузовиков, рабочие химической и нефтяной отраслей промышленности, предприятий, производящих алюминий, парикмахеры. Латентный период от контакта с канцерогеном до появления новообразования мочевого пузыря составляет около 20 лет.
Доказано, что курение является одной из причин развития РМП. Установлено, что курильщики болеют РМП в 2–3 раза чаще, чем некурящие. Риск заболевания находится в прямой зависимости от интенсивности курения, при этом риск у злостного курильщика возрастает с 2–3 до 5 раз. Особенно повышен риск развития РМП у лиц, употребляющих черный табак и у курильщиков сигарет без фильтра. Прекращение курения уменьшает риск возникновения новообразования.
Установлена связь между развитием плоскоклеточного РМП и хроническим циститом, вызванным Schistosoma haematobium. Заболевание носит эндемический характер и распространено в Северной Африке. Характерным является развитие новообразования у относительно молодых людей, опухоль обычно высокодифференцированная и редко метастазирует. В моче больных выявляется повышенная концентрация нитрозоаминов, которым также отводится этиологическая роль в возникновении РМП.
Вероятность возникновения РМП повышает также хронический цистит, развивающийся на фоне конкрементов в мочевом пузыре, длительного нахождения постоянного катетера, дивертикула.
Возникновению новообразований мочевого пузыря способствует облучение области таза. Показано, что у больных раком шейки матки, получавших лучевую терапию, имеется 4-кратное увеличение риска заболеть РМП. Риск заболевания повышался при увеличении дозы облучения и продолжительности времени с момента проведения лучевой терапии. Максимальный риск заболевания — 8,7 возник у больных, получавших лучевую терапию 20 лет назад.
Выявлена высокая степень корреляции между употреблением фенацетинсодержащих анальгетиков и развитием РМП. У женщин, употребивших в течение жизни не менее 1 кг фенацетина, риск развития РМП повышается вдвое, а у женщин, принимавших фенацетин не менее 30 дней в течение года, — в 6,5 раз.
Циклофосфамид — химиопрепарат, широко применяющийся для лечении злокачественных новообразований. Отмечено, что у пациентов, которым проводилось лечение циклофосфамидом по поводу онкологических или неонкологических заболеваний, наблюдается увеличение риска возникновения РМП. Особенно это касается больных, у которых лечение осложнялось развитием геморрагического цистита. Латентный период от проведения химиотерапии до развития опухоли составляет от 8 до 12 лет.
Имеется ряд исследований, в которых повышенный риск развития РМП связывают с уростазом, редким мочеиспусканием, повышенной концентрированностью мочи. Все эти причины приводят к более длительному или более эффективному воздействию растворенных в моче канцерогенов на слизистую мочевого пузыря.
Изучалась роль питания в этиологии РМП. Отмечена тенденция к повышению риска РМП при увеличении содержания в рационе белка, холестерина, привычке постоянно подсаливать пищу, употреблении жареной пищи. Не отмечено корреляции между употреблением кофе, алкоголя, искусственных сладостей (сахарин) и риском развития РМП.
Не подтверждена роль вируса папилломы человека в этиологии РМП.
Кроме вышеперечисленных, на заболеваемость РМП влияют целый ряд других факторов. Например, пол пациента: мужчины болеют РМП в 2–10 раз чаще, чем женщины. В России в 2000 г. соотношение впервые заболевших мужчин и женщин составило 4:1. Имеет значение возраст: среди больных РМП преобладают лица старше 60 лет. Так, средний возраст заболевших мужчин в России в 2000 г. составил 67,3 года. Заболеваемость лиц до 35 лет — менее 1 на 100 тыс. населения, а в возрастной группе 75 лет и старше — 121,5 на 100 тыс. населения.
На заболеваемость оказывает влияние раса пациента и место проживания. Например, в Северной Америке и странах Западной Европы заболеваемость высока, она меньше в странах Восточной Европы и низка в некоторых азиатских странах. Интересно, что среди выходцев из юго-восточной Азии, проживающих в Западной Европе, заболеваемость ниже, чем среди коренного населения. В США заболеваемость РМП белых мужчин вдвое выше, чем афроамериканцев или лиц японского или китайского происхождения.
Важнейшими факторами онкогенеза являются различные молекулярные аномалии. Среди них наибольшее значение придается хромосомным аберрациям и инактивации генов-супрессоров. Одной из наиболее важных молекул, идентифицированных в последние годы, является белок р53, который играет исключительно важную роль в реакции клетки на повреждение: он или препятствует репликации клетки, позволяя ДНК исправить повреждение, или включает механизм апоптоза, и тогда поврежденная клетка погибает. При делеции короткого плеча 17-й хромосомы, включающей этот ген, активизируется клеточная пролиферация, нарушается процесс репарации поврежденной ДНК и апоптоза.
Мутация р53 при РМП ассоциируется с плохим прогнозом и низкой выживаемостью как при поверхностном, так и при инвазивном РМП. Кроме того, показано, что мутация р53 часто наблюдается при РМП in situ.
При РМП часты изменения 9-й хромосомы. Многие исследователи считают, что ее повреждения играют значительную роль на начальных стадиях онкогенеза. Потеря 9-й хромосомы встречается при всех стадиях РМП и при любой степени клеточной дифференцировки.
Патологическая анатомия и классификация РМП
В 1973 г. ВОЗ была разработана следующая гистологическая классификация опухолей мочевого пузыря, вторая редакция которой опубликована в 1999 г.
1. Эпителиальные опухоли мочевого пузыря.
1.1. Доброкачественные.
1.1.1. Уротелиальная (переходноклеточная) папиллома (8120/0 1, 2 )
1.1.2. Уротелиальная (переходноклеточная) папиллома, инвертированный тип (8121/0)
1.1.3. Плоскоклеточная папиллома (8052/0)
1.1.4. Виллезная аденома (8261/0)
1.2. Папиллярные уротелиальные (переходноклеточные) опухоли с низким злокачественным потенциалом (8130/1)
1.3. Злокачественные
1.3.1. Уротелиальная (переходноклеточная) карцинома (8120/3)
1.3.1.1. Папиллярная уротелиальная (переходноклеточная) карцинома (8130/3)
1.3.1.2. Инфильтративная уротелиальная (переходноклеточная) карцинома (8120/3)
1.3.1.3. Уротелиальная (переходноклеточная) карцинома in situ (8120/2)
1.3.1.4. Атипия/дисплазия (74000)
1.3.1.5. Варианты уротелиальной (переходноклеточной) карциномы
1.3.2. Плоскоклеточный рак (8070/3)
1.3.2.1. Веррукозная карцинома (8051/3)
1.3.3. Аденокарцинома (8140/3)
1.3.4. Рак урахуса (8010/3)
1.3.5. Светлоклеточная аденокарцинома (8310/3)
1.3.6. Мелкоклеточный рак (8041/3)
1.3.7. Недифференцированный рак (8020/3)
2. Неэпителиальные опухоли
3. Смешанная группа опухолей
3.1. Параганглиома (8680/1)
3.2. Гематопоэтические и лимфоидные новообразования
3.3. Карциносаркома (8980/3)
3.4. Злокачественная меланома (8720/3)
4. Метастатические опухоли и распространение на мочевой пузырь других опухолей
5. Неклассифицируемые опухоли
6. Эпителиальные нарушения
6.1. Гиперплазия (72000)
6.1.1. Плоская уротелиальная (переходноклеточная) гиперплазия (72000)
6.1.2. Папиллярная уротелиальная (переходноклеточная) гиперплазия (72050)
6.2. Реактивная атипия
6.3. Атипия неопределенного значения
6.4. Гнезда фон Брунна (76060)
6.5. Кистозный цистит (73370)
6.6. Железистая метаплазия (73300)
6.7. Нефрогенная аденома (73380)
6.8. Плоскоклеточная метаплазия (73220)
6.9. Эффекты лечения
7. Опухолеподобные поражения
7.1. Папиллярный и полипоидный цистит (46700)
7.2. Фолликулярный цистит (43080)
7.3. Малакоплакия (43180)
7.4. Амилоидоз (55100)
7.5. Миофибробластические пролиферации
7.5.1. Миофибробластическая опухоль (76820)
7.5.2. Послеоперационный веретеноклеточный узел
7.6. Фиброзный (фиброэпителиальный) полип (76810)
7.7. Эндометриоз (76500)
7.8. Гамартома (75500)
7.9. Кисты (33400)
7.10. Шистосомиаз
7.1.1 Лучевой цистит (11620)
1 — Морфологический код международной классификации болезней для онкологии (ICD-O) и систематизированная номенклатура медицины (SNOMED).
2 — “Поведение” опухоли кодируется как /0 — для доброкачественных опухолей, /1 — для низкого или неопределенного злокачественного потенциала или пограничной злокачественности, /2 — для поражения in situ, /3 — для злокачественных опухолей.
До 95% опухолей мочевого пузыря имеют эпителиальное происхождение. Наиболее распространенной (более 90%) гистологической формой злокачественных эпителиальных новообразований мочевого пузыря является переходноклеточный рак. Обычно выделяют две его формы: папиллярную, которая составляет 70–75% впервые выявленных опухолей, и непапиллярную. Среди непапиллярных опухолей выделяют карциному in situ (СIS) и инвазивный рак.
Макроскопически фокусы CIS выглядят как эритематозные или бархатистые участки слизистой, иногда последняя может быть отечной. Микроскопически это плоское поражение, в котором эпителий содержит клетки, цитологически являющиеся злокачественными. Неопластические изменения могут наблюдаться во всей толще эпителиального слоя, они могут иметь место только в поверхностных или только в базальных эпителиальных клетках, могут быть представлены отдельными злокачественными клетками или группами клеток, рассеянных среди нормального уротелия. Они могут вовлекать гнезда фон Брунна или участки кистозного цистита. Спонтанно или в результате повреждения хрупкий эпителий может слущиваться, так что на поверхности остаются лишь единичные клетки рака. Ранее подобные изменения классифицировались как тяжелая дисплазия (синоним — интрауротелиальная неоплазия высокой степени).
Инвазивный переходноклеточный РМП может быть представлен макроскопически в виде узловых образований, полиповидной или грубоворсинчатой опухоли, иногда — в виде изъязвления или отечной гиперемированной слизистой.
Высокодифференцированный переходноклеточный рак по гистологической картине мало отличается от переходноклеточной папилломы. Однако сосочки часто имеют неправильную форму, они толще и короче, чем при папилломе, с булавовидными утолщениями апикальных отделов. Мономорфность и правильная полярность эпителия сочетаются с более выраженной, чем в папилломе, многорядностью, наличием митозов, иногда со значительным количеством и даже преобладанием темных клеток с узкими палочковидными ядрами и базофильной цитоплазмой. Можно обнаружить отдельные участки выраженного клеточного атипизма, где выявляются клетки с крупными гиперхромными ядрами и полной или частичной утратой полярности, а также имеются признаки инвазии в подлежащую ткань. Но эти отличительные признаки нередко раскрываются лишь при тщательном изучении срезов из разных мест опухоли, в том числе обязательно — срезов, проходящих через ножку или широкое основание опухоли. Низкодифференцированный рак нередко частично сохраняет папиллярное строение, но резко полиморфные клетки обычно лишены полярности. Основная масса опухоли часто состоит из сóлидных структур или диффузно-инфильтрирующих раковых клеток с гиперхромными ядрами, лишь местами сохраняющих черты переходного эпителия. Переходноклеточный рак средней степени зрелости занимает промежуточное положение между высоко— и низкодифференцированным.
Плоскоклеточный рак составляет около 5% случаев в зонах, не эндэмичных по шистосомозу, а в областях, где шистосомоз распространен, на его долю приходится около 75% новообразований мочевого пузыря. Около 0,5–2% злокачественных эпителиальных опухолей мочевого пузыря представлены аденокарциномой. Реже имеет место недифференцированный рак.
РМП метастазирует как лимфогенным так и гематогенным путем. Отдаленными метастазами чаще поражаются лимфатические узлы, кости, печень, легкие.
Клиническая классификация РМП
Для клинического применения ВОЗ рекомендует международную клиническую классификацию по системе TNM, где критерий Т характеризует распространенность первичной опухоли, критерий N — наличие или отсутствие регионарных метастазов, критерий М — наличие или отсутствие отдаленных метастазов. Классификация применима только для рака, папиллома исключается. Должно быть гистологическое или цитологическое подтверждение диагноза. Все критерии устанавливаются на основании физикального обследования, лучевых методов диагностики и эндоскопии.
Регионарными лимфатическими узлами для мочевого пузыря являются узлы малого таза, расположенные ниже бифуркации общих подвздошных артерий. Сторона поражения не учитывается при определении критерия N.
Классификация по TNM
Критерий Т (первичная опухоль). Индекс (m) должен быть добавлен к соответствующему критерию Т для обозначения множественных опухолей. Индекс (is) может быть добавлен к любому Т, чтобы указать на сопутствующее присутствие рака in situ:
ТХ — первичная опухоль не может быть оценена;
Т0 — нет данных о первичной опухоли;
Та — неинвазивная папиллярная карцинома;
Tis — карцинома in situ (плоская опухоль);
Т1 — опухоль распространяется на субэпителиальную соединительную ткань;
Т2 — опухолевая инвазия мышечного слоя;
Т2а — опухолевая инвазия поверхностного мышечного слоя (внутренняя половина);
Т2b— опухолевая инвазия глубокого мышечного слоя (наружная половина);
Т3 — опухоль распространяется на паравезикальную клетчатку.
Т3а — микроскопически;
Т3b — макроскопически (экстравезикальный конгломерат);
Т4 — опухолевая инвазия любого из перечисленных органов: предстательная железа, матка, влагалище, стенка таза, брюшная стенка.
Т4а — распространение опухоли на предстательную железу или матку, или влагалище;
T4b — опухолевая инвазия стенки таза или брюшной стенки.
Критерий N (регионарные лимфатические узлы):
NX — регионарные лимфатические узлы не могут быть оценены;
N0 — нет метастазов в регионарных лимфатических узлах;
N1 — метастаз в одном регионарном лимфатическом узле не более 2 см в наибольшем измерении;
N2 — метастаз в одном регионарном лимфатическом узле более 2 см, но не более 5 см в наибольшем измерении, или множественные лимфатические узлы, ни один из которых не больше 5 см в наибольшем измерении;
N3 — метастазы в регионарных лимфатических узлах более 5 см в наибольшем измерении.
Критерий М (отдаленные метастазы):
МХ — отдаленные метастазы не могут быть оценены;
М0 — нет отдаленных метастазов;
М1 — отдаленные метастазы.
pTNM — патолого-анатомическая классификация
pT, pN и pM критерии соответствуют критериям T, N и М.
G — гистопатологическая градация
GX — степень дифференцировки не может быть оценена.
G1 — высокодифференцированная опухоль.
G2 — умереннодифференцированная опухоль.
G3 и G4 — низкодифференцированная/недифференцированная опухоль.
Группировка РМП по стадиям:
Таблица 1
| Стадия 0а | Та | N0 | M0 |
| Стадия 0is | Tis | N0 | M0 |
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2a | N0 | M0 |
| T2b | N0 | M0 | |
| Стадия III | T3a | N0 | M0 |
| T3b | N0 | M0 | |
| T4a | N0 | M0 | |
| Стадия IV | T4b | N0 | M0 |
| Любая T | N1,2,3 | M0 | |
| Любая T | Любая N | M1 |
Клиническая картина РМП
Одним из первых признаков болезни является гематурия. При локализации опухоли в области шейки мочевого пузыря больной может отметить примесь крови в моче в конце мочеиспускания. Чаще гематурия бывает тотальной и сопровождается отхождением бесформенных сгустков крови. Степень кровотечения не отражает величины опухоли. Порой гематурия из небольших новообразований может привести к тампонаде мочевого пузыря. При начальных стадиях заболевания кровотечение может быть однократным и затем не повторяться длительное время.
По мере роста опухоли начинают появляться и другие симптомы болезни. Больные жалуются на дизурию, которая может быть первым и единственным проявлением заболевания. Появление дизурии может быть связано с присоединением инфекции, хронической задержкой мочи. Появляются боли над лоном. Первоначально они связаны с актом мочеиспускания, а в последующем становятся постоянными. Чем больше опухоль, степень инфильтрации стенки мочевого пузыря, тем сильнее боли. Присоединяются боли в промежности, в области крестца. Уменьшается емкость мочевого пузыря. Мочеиспускание становится более частым и болезненным, а гематурия — более интенсивной и продолжительной. Появляется анемия. При расположении опухоли в области устьев мочеточников рост новообразования может привести к нарушению оттока мочи из верхних мочевых путей и развитию уретерогидронефроза. В таких случаях больные могут предъявлять жалобы на боль в подреберье и поясничной области. Может развиться почечная недостаточность.
Диагностика РМП
При осмотре и физикальном обследовании больного оцениваются:
— общее состояние,
— степень выраженности клинических симптомов заболевания.
При осмотре иногда можно увидеть деформацию (выпячивание) живота между лоном и пупком, обусловленную увеличенным мочевым пузырем. В обязательном порядке исследуются периферические лимфатические узлы. При пальпации живота обращают внимание на увеличение почек, печени, наличие опухолевидных образований над лоном, в подвздошных областях. Чаще всего опухоль может определяться пальпаторно, если она локализуется в области верхушки мочевого пузыря и на его передней стенке, особенно если она имеет большие размеры и инфильтрирует паравезикальную клетчатку. Следует помнить, что пальпируемая над лоном опухоль может быть новообразованием урахуса, а у женщин, кроме того, следует исключить новообразование яичника. Обязательными являются ректальное и вагинальное исследования, а также бимануальная пальпация, которую лучше выполнять под наркозом. Эти исследования позволяют оценить размеры опухоли, ее подвижность, соотношение со стенками таза, состояние паравезикальной клетчатки, а у мужчин — предстательной железы.
Лабораторная диагностика
Цитологическое и другие методы исследования мочи
Материалом для цитологического исследования служат осадок мочи или промывные воды после цистоскопии, мазки с поверхности опухоли или слизистой. Для большей достоверности и сохранности опухолевых клеток применяются спиртовые смывы либо для фиксации материала в порцию мочи или в полученный центрифугат добавляют спирт. Метод обладает высокой специфичностью. Чувствительность его в большой степени зависит от степени клеточной дифференцировки и достигает при G1 — 28%, G2 — 77%, G3 — 90%, составляя в среднем около 40%. Цитологическое исследование является основным методом диагностики рака in situ.
BTA stat Test является иммунохроматографическим методом. Он позволяет производить быстрое определение антигена опухоли мочевого пузыря в моче с помощью МКА. Большим достоинством метода является простота выполнения и возможность применения в амбулаторных условиях. Тест является более чувствительным, чем цитологическое исследование мочи, особенно при высокодифференцированных опухолях. BTA TRAK Test более сложен в исполнении и производится в лабораториях. Точность его в диагностике РМП несколько выше, чем ВТА stat Test. Он может применяться самостоятельно, а также для подтверждения ВТА stat Test.
В последнее время предложены и применяются другие методы лабораторной диагностики РМП: NMP 22 (nuclear matrix protein), антигена UBC (urinary bladder cancer), теломеразы мочи и др. Boman и соавт. изучили специфичность и чувствительность нескольких методов лабораторной диагностики. Оказалось, что при специфичности 73% чувствительность NMP 22 составила 75%, BTA stat — 78%, UBC — 64%, проточной цитометрии — 61%. Чувствительность цитологического исследования равнялась 42% при специфичности 97%.
Инструментальное обследование
Цистоскопия
Несмотря на то, что в настоящее время появились новые, информативные методы диагностики, основным и обязательным методом исследования остается цистоскопия. Она позволяет поставить диагноз, определить количество новообразований, их локализацию, размеры, характер роста, оценить состояние окружающей слизистой, выполнить биопсию.
До 75% опухолей мочевого пузыря имеют папиллярное строение. Папиллома при цистоскопии выглядит в виде нежно-ворсинчатого образования на тонкой ножке, иногда с просвечивающимися кровеносными сосудами. В тех случаях, когда имеется рак, опухоль выглядит как объемное образование с короткими утолщенными ворсинами, отеком и гиперемией окружающей слизистой. Ножка опухоли утолщена, и слизистая мочевого пузыря у основания опухоли часто инфильтрирована.
Совершенно по-другому выглядят при цистоскопии эндофитные, инфильтративные опухоли. Обычно они определяются как опухолевый узел (узлы), в большей или меньшей степени вдающийся в полость мочевого пузыря и инфильтрирующий его стенку. Слизистая в окружности опухоли отечна, гиперемирована, границы новообразования нечеткие. Нередко опухоль изъязвлена, покрыта фибринозными наложениями. Иногда при кровоточащих новообразованиях на поверхности опухоли видны сгустки крови, которые могут полностью прикрывать собой источник кровотечения.
Обязательным компонентом цистоскопии является уретроскопия. Уретра осматривается на всем протяжении, из подозрительных участков производится биопсия.
При выполнении биопсии мочевого пузыря преследуется две цели:
— во-первых, установить гистологическое строение опухоли;
— во-вторых, определить стадию заболевания (критерий Т).
Информация, получаемая при гистологическом исследовании биопсийного материала, имеет первостепенное значение в определении последующей тактики лечения.
“Холодная” или “щипцевая” биопсия выполняется щипцами через цистоскоп. Ее достоинство в том, что полученный материал не подвергается термическому воздействию и полностью годен для исследования. Это особенно важно при новообразованиях небольших размеров. Недостатком этого метода биопсии является то, что невозможно уточнить глубину инвазии опухоли.
Второй, наиболее часто применяемый метод биопсии, — трансуретральная резекция (ТУР) стенки мочевого пузыря. Этот метод имеет ряд достоинств:
- Возможность удаления всей опухоли с захватом мышечного слоя стенки мочевого пузыря, после чего берут кусочки тканей из основания и убеждаются, насколько радикально удалена опухоль.
- Получение достаточного количества материала для последующего гистологического исследования.
- Возможность установления степени инвазии на основании гистологического изучения полученного материала, что само по себе имеет большое значение для определения характера последующего лечения.
Расширить возможности цистоскопии позволяет применение флуоресцентной диагностики РМП. Метод, разработанный Kriegmair (1996), основан на избирательном накоплении протопорфирина IX в опухолевых клетках при внутрипузырном введении 5-аминолевулиновой кислоты. При освещении мочевого пузыря сине-фиолетовым светом возникает флуоресценция протопорфирина IX, концентрация которого в опухоли значительно выше, чем в здоровой слизистой. Таким образом, врач имеет возможность увидеть новообразования, которые не видны при обычном освещении, в том числе и рак in situ, взять биопсию из флуоресцирующих участков или удалить их. Чувствительность флуоресцентной цистоскопии на 20% превосходит чувствительность цистоскопии при обычном освещении и составляет более 90%.
УЗИ
Ультразвуковая диагностика наряду с цитологическим исследованием мочи и цистоскопией является основным методом в диагностике РМП. Ее привлекательность состоит в неинвазивности, информативности и доступности.
Для диагностики применяются различные варианты УЗКТ — трансабдоминальная, трансректальная, трансвагинальная и трансуретральная. Наиболее распространенной в клинической практике при диагностике РМП является методика трансабдоминального исследования, которая дает возможность определить локализацию опухоли, оценить ее размеры и структуру. Кроме того, этот подход позволяет определить распространенность опухолевого процесса на окружающие органы и ткани, выявить признаки инфильтрации устьев мочеточников и сопутствующие нарушения уродинамики (рис. 1, 2).

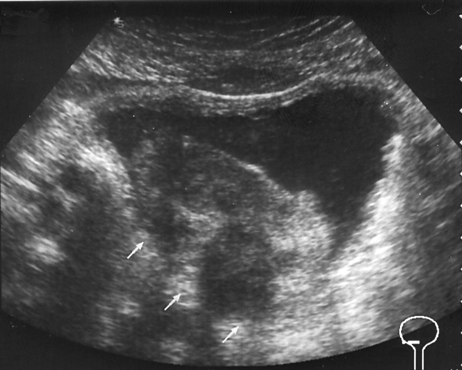
Рисунок 1. Рак мочевого пузыря, стадия T3b
УЗТ мочевого пузыря в поперечной плоскости. Опухоль располагается на правой боковой и задней стенках. Стрелками указана зона инфильтрации околопузырной клетчатки

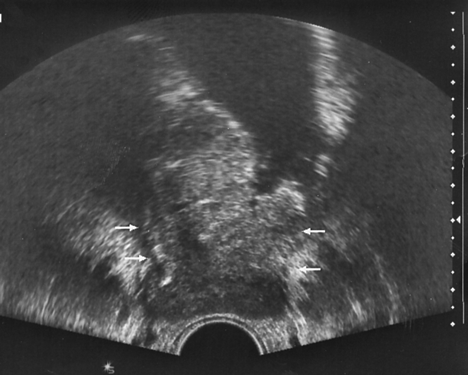
Рисунок 2. Рак мочевого пузыря, стадия T2b
УЗТ мочевого пузыря в поперечной плоскости. Опухоль располагается на правой боковой и задней стенках. Стрелками указано распространение процесса за пределы стенки органа и зона инфильтрации устья мочеточника. По левой боковой стенке — дивертикул
УЗКТ выполняется при наполненном мочевом пузыре. Однако дизурия и малая емкость мочевого пузыря затрудняют исследование и приводят к значительному количеству артефактов, усложняя интерпретацию полученных данных. Эффективность исследования зависит от размеров опухоли. Точность УЗКТ при трансабдоминальной методике достигает 82% при новообразованиях размером более 5 мм, тогда как при размерах опухоли менее 5 мм этот показатель снижается до 38%, а частота диагностических ошибок составляет от 15 до 27%. Особенные сложности в интерпретации полученных данных возникают при локализации опухоли на передней стенке мочевого пузыря, в области шейки и треугольника Льето. В этих случаях рекомендуется использовать внутриполостные методы УЗИ.
Из существующих внутриполостных методов УЗКТ чаще применяется трансректальный. Преимущество его заключается в возможности изучения шейки мочевого пузыря, предстательной железы, семенных пузырьков и тазовой клетчатки. Информативность метода в оценке патологических изменений достигает 94% (рис. 3).

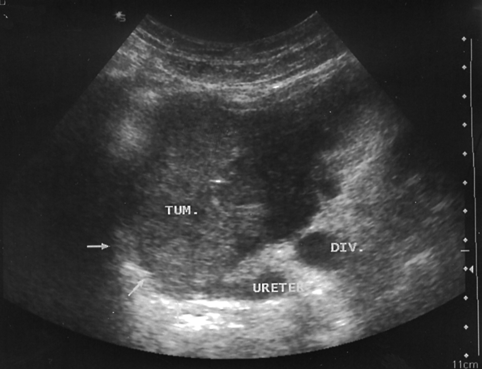
Рисунок 3. Рак мочевого пузыря, стадия T4
УЗТ мочевого пузыря в поперечной плоскости. Опухоль располагается в области шейки пузыря. Стрелками указана инфильтрация предстательной железы
Трансуретральная УЗКТ мочевого пузыря считается наиболее информативным способом оценки местного распространения опухоли мочевого пузыря и, самое главное, достаточно точным методом определения глубины инвазии. Метод особенно ценен, если опухоль ограничена стенкой мочевого пузыря, при расположении опухоли в дивертикуле, а также для контроля степени иссечения стенки при ТУР. Возможности диагностики ограничены в дифференциации стадии Та и Т1 и в установлении вовлечения в опухолевый процесс тазовых лимфатических узлов.
РКТ
РКТ в диагностике РМП сравнима по эффективности с УЗКТ. Диагностическая точность обоих методов составляет около 60%, поэтому РКТ нашла ограниченное применение и используется главным образом для выявления экстравезикального распространения опухоли и уточнения состояния регионарных лимфатических узлов (рис. 4). Для повышения диагностических возможностей РКТ в мочевой пузырь пробовали вводить газ, рентгеноконтрастные вещества, жировые эмульсии, но эти мероприятия не привели к расширению диагностических возможностей метода. По литературным данным, точность стадирования РМП с помощью РКТ колеблется от 60 до 80%.

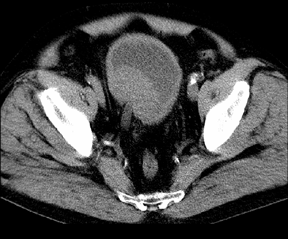
Рисунок 4. На КТ-снимке органов таза отчетливо определяется опухоль на задне-правой стенке мочевого пузыря с инвазией правого мочеточника. Забрюшинные лимфатические узлы не увеличены
МРТ
МРТ более 10 лет применяется для диагностики РМП. Преимущество перед РКТ состоит в более высоком (в 70 раз) контрастном разрешении. Кроме того, исследование производится в трех плоскостях — аксиальной, фронтальной и сагиттальной, вследствие чего получается более полное представление об опухоли и ее взаимоотношениях с окружающими органами (рис. 5). Качество исследования значительно повышается, если его производить с парамагнитным контрастным средством (гадопентеновая кислота, гадодиамид). Это позволяет значительно усилить интенсивность изображения опухоли. При использовании контрастного усиления точность МРТ в определении опухолевого поражения в стадии рТ3 составляет более 80%, тогда как при исследовании без контрастирования она равна 50–60%. МРТ не всегда позволяет обнаружить опухоли размером до 1 см. Ограничены возможности МРТ и в дифференцировании поверхностных опухолей от инвазивных (Т2). Наиболее эффективно это исследование, во-первых, при инвазивных новообразованиях, инфильтрирующих паравезикальную клетчатку, а, во-вторых, при диагностике регионарных метастазов.

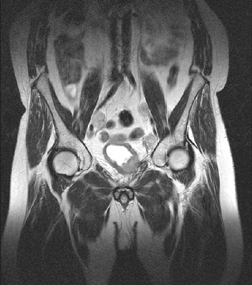
Рисунок 5. МРТ-снимок
На снимке органов таза во фронтальной проекции в нижних отделах мочевого пузыря определяется опухоль неправильной формы сниженной интенсивности сигнала в T2. По ходу подвздошных сосудов отмечаются увеличенные лимфоузлы
Экскреторная урография с нисходящей цистографией
В настоящее время достаточно редко применяется для диагностики новообразований мочевого пузыря, что обусловлено появлением других, более информативных методов диагностики (УЗКТ, РКТ, МРТ). Опухолевое поражение мочевого пузыря выглядит на нисходящей цистограмме в виде дефекта контрастирования, деформации стенки, приподнятости, асимметрии органа. Все эти признаки являются косвенными и могут быть обусловлены другими причинами: рентгенонегативными камнями, сгустками крови, сдавлением и деформацией мочевого пузыря внепузырными образованиями. Кроме того, установление правильного диагноза затруднено при малых размерах новобразования или если ранее было произведено оперативное вмешательство на мочевом пузыре.
Основное достоинство экскреторной урографии — возможность судить о состоянии верхних мочевых путей и, в частности, заподозрить или обнаружить опухоль лоханки или мочеточника.
Прогностические факторы при РМП
На результаты лечения больных РМП оказывают влияние многие факторы. Их можно разделить на клинические, гистологические и биологические.
Подобное разделение достаточно условно, поскольку, например, такой, казалось бы, клинический фактор, как стадия заболевания базируется на результатах морфологического исследования удаленного во время операции материала.
Клинические факторы
Среди многочисленных клинических факторов основное прогностическое значение имеют:
— стадия заболевания,
— количество и размер опухолей,
— состояние верхних мочевых путей,
— общее состояние пациента,
— вид лечения.
Так, 5-летняя выживаемость после цистэктомии при патолого-анатомической стадии рTis равняется 78–100%, при рТ1 — 69–95%, рТ2 — 63–70%, рТ3а — 47–53%, рТ3b — 31–33%, рТ4 — 19–28%; 5-летняя выживаемость пациентов с регионарными метастазами составляет 14,5%, а без метастазов — 64,5%.
Негативное влияние на результаты цистэктомии оказывает гидронефроз. Так, по данным ГУ РОНЦ им. Н.Н. Блохина РАМН, прогрессирование заболевания наблюдалось у 60,71% пациентов с гидронефрозом и у 34,8% — без гидронефроза. Медиана общей выживаемости больных с гидронефрозом и без него составили соответственно 19,5 и 56,1 мес.
Неблагоприятным прогностическим фактором оказывается множественность поражения мочевого пузыря. По данным Б.П.Матвеева (ГУ РОНЦ им. Н.Н. Блохина РАМН), рецидивы РМП появились у 62% больных с множественными поверхностными новообразованиями мочевого пузыря и у 27,8% — при одиночных опухолях.
Гистологические факторы
Значительное влияние на результаты лечения оказывает гистологическое строение опухоли. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, выживаемость больных переходноклеточным раком составляет 87,6%, плоскоклеточным раком — 53%, а при переходноклеточном раке с железистой метаплазией — 26,6%.
Важным прогностическим фактором является степень дифференцировки опухолевых клеток (G). По данным Б.П.Матвеева, у больных переходноклеточным РМП G1 5-летняя выживаемость составила 100%, G2 — 85,1% и G3 — 54,4%. Не менее значимым оказалось наличие опухолевой инвазии в кровеносные сосуды. В группе больных, у которых инвазия была обнаружена, выживаемость составила 51,9%, не обнаружена — 75,8%. Аналогичные результаты получены в группе больных с опухолевой инвазией в лимфатические сосуды. При наличии инвазии 5-летняя выживаемость составила 50,8%, при отсутствии — 82,8%.
Прогностическое значение имеет содержание ДНК в ядрах опухолевых клеток, определяемое с помощью проточной цитометрии. Например, отмечено, что рецидив РМП наступил у 76% больных анеуплоидными опухолями и только у 18% — диплоидными. 5-летняя выживаемость больных с диплоидным набором хромосом в ядрах опухолевых клеток составила 66,7%, а больных анеуплоидными опухолями — 25,2%.
Биологические факторы
В последние годы проводится большое количество исследований по изучению генетических изменений при онкологических заболеваниях, поиску новых биохимических и молекулярных маркеров и способов воздействия на опухоль на молекулярном уровне. Наиболее обещающие результаты получены при изучении гена опухолевой супрессии р53. Продемонстрировано, что экспрессия р53 является независимым прогностическим фактором, указывающим на развитие прогрессии при раке in situ. Показано, что мочевой пузырь может быть сохранен до 10 лет больным со стадией заболевания Т2 и отрицательным р53, если они ответили полной ремиссией на неоадъювантную химиотерапию. Наоборот, больным со стадией заболевания Т2 или Т3 и положительным р53 показана цистэктомия.
Имеются публикации о прогностическом значении матрикс-металлопротеиназы 2 и тканевого ингибитора матрикс-металлопротеиназы 2, sFas антигена, bcl–2, Ki67, pRB.
Лечение РМП
С клинической точки зрения, среди больных РМП выделяют две группы:
1) больные с поверхностными новообразованиями (CIS, Ta, T1);
2) пациенты с инвазивными опухолями (Т2 — Т4).
Течение заболевания в этих двух группах различно, в связи с чем различаются и подходы к лечению. Выбирая метод терапии, следует исходить из современных представлений, согласно которым, во-первых, РМП — это не локальный процесс, а заболевание уротелия и, во-вторых, бóльшая часть больных инвазивным раком к началу лечения уже имеют микрометастазы.
Лечение поверхностного РМП
Особенности поверхностного РМП:
- Склонность к рецидивированию после хирургического лечения.
- Переход в инвазивную опухоль (прогрессия).
Трансуретральная резекция (ТУР) мочевого пузыря
Основным методом хирургического лечения поверхностного РМП является ТУР стенки мочевого пузыря вместе с опухолью.
Для ее осуществления требуется специальное оборудование: резектоскопы с режущими и коагулирующими электродами, высокочастотные электрохирургические генераторы, источники освещения и др. Для постоянного промывания мочевого пузыря может быть использована стерильная дистиллированная вода, однако предпочтительнее применять негемолизирующие растворы: цитол, 1,5%-ный раствор глицина, 5%-ный раствор глюкозы и др.
Показаниями к ТУР являются поверхностные одиночные и множественные новообразовния мочевого пузыря.
Техника ТУР мочевого пузыря
Перидуральная анестезия. Положение больного, как для цистоскопии. Под контролем зрения резектоскоп проводится в мочевой пузырь и производится цистоскопия. Определяется локализация опухоли. Производится биопсия из видимо неизмененных участков слизистой мочевого пузыря. При небольшой по размеру (до 3 см) опухоли петля электрода заводится за нее, и резекция производится только при обратном движени петли во избежание перфорации мочевого пузыря. Последовательно удаляется вся экзофитная часть опухоли. Мочевой пузырь отмывается. Вторым этапом удаляется основание опухоли с захватом мышечного слоя (для гистологического определения стадии) и выполняется биопсия макроскопически не измененного мышечного слоя. Окружающая слизистая удаляется на расстоянии 1–1,5 см от видимого края опухоли. Если опухоль располагается в зоне устья мочеточника, последнее срезается петлей резектоскопа (некоторые авторы советуют перед ТУР катетеризировать мочеточник для профилактики его стриктуры в зоне резекции).
При больших новообразованиях, располагающихся на широком основании, удаление экзофитного компонента опухоли часто сопровождается выраженным кровотечением. Попытки электрокоагуляции исходящего из опухолевой ткани сосуда, как правило, не удаются. В таком случае целесообразно производить частичное удаление экзофитного компонента новообразования до его основания (перпендикулярно стенке мочевого пузыря) с захватом мышечного слоя и уже в мышечном слое стенки мочевого пузыря коагулировать сосуды, питающие опухоль. Обычно кровотечение удается остановить подобным образом. Добившись гемостаза в основании опухоли, продолжают электрорезекцию, опять начиная с экзофитного компонента. После удаления опухоли выполняется тщательный гемостаз. Операция заканчивается установкой в мочевой пузырь на 2–3 дня катетера Фоли.
При множественном поражении мочевого пузыря целесообразнее начать удаление с маленьких опухолей, а уже затем переходить к более крупным. Иначе на фоне развивающегося во время операции отека слизистой мочевого пузыря и окрашивания промывной жидкости кровью небольшие по размеру новообразования могут быть пропущены и не удалены.
Осложнения ТУР
Среди осложнений ТУР мочевого пузыря первое место занимают кровотечения, которые встречаются как во время операции, так и в послеоперационном периоде.
Возможным серьезным осложнением является перфорация стенки мочевого пузыря. При этом следует различать внутрибрюшную и внебрюшную перфорации, т.к. подходы к ведению больных различны. Послеоперационная смертность крайне редка.
ТУР носит не только лечебный характер, но и диагностический, так как на основании гистологического исследования операционного материала морфолог оценивает степень инвазии опухоли в стенку мочевого пузыря и определяет патолого-анатомическую стадию заболевания (рТ).
Частота рецидивов поверхностного папиллярного РМП после ТУР составляет в среднем 60–70%, а частота прогрессии — около 15–20% (при раке Т1 G3 — около 30%). В качестве причин частых рецидивов заболевания, которые необходимо учитывать при планировании лечения, рассматриваются:
— диффузный характер неопластических изменений уротелия, очаги рака in situ, сопутствующие папиллярной опухоли;
— возможность имплантации опухолевых клеток во время операции;
— пропущенные во время ТУР небольшие опухоли.
Проведение цистоскопии через 2–6 нед после ТУР выявляет опухоли, не удаленные во время трансуретральной резекции, у 32–64% больных. Проведение повторной ТУР в ранние сроки значительно снижает частоту рецидивов в последующем.
Методом, позволяющим повысить радикальность ТУР, является флуоресцентный контроль. Больному за 2 ч до операции вводят в мочевой пузырь 3%-ный раствор аминолевулиновой кислоты. Хирург выполняет операцию при обычном освещении, а затем осматривает мочевой пузырь в сине-фиолетовом свете и удаляет флуоресцирующие участки.
В ГУ РОНЦ им. Н.Н. Блохина РАМН ТУР с флуоресцентным контролем была проведена 85 больным РМП. У 60 (70,6%) пациентов после выполнения операции при обычном освещении наблюдалась флуоресценция участков слизистой. После выполнения биопсии святящиеся участки были удалены. При гистологическом исследовании дополнительно удаленных флуоресцировавших участков слизистой у 46 больных из 60 (76,7%) был выявлен РМП, в т.ч. рак in situ — у 14. У остальных 14 (23,3%) пациентов причиной флуоресценции явились дисплазия и воспаление.
Факторы, оказывающие влияние на рецидивирование, прогрессию опухоли и результаты лечения:
— количество опухолей к моменту ТУР;
— частота рецидивов в анамнезе, рецидив в течение 3 мес;
— размер опухолей — чем больше опухоль, тем выше риск рецидива;
— дифференцировка опухолевых клеток (G).
Основываясь на прогностических факторах, выделяют несколько групп риска: опухоли малого риска (стадия Та, дифференцировка G1, единичная опухоль, размеры менее 3 см); опухоли высокого риска (стадия Т1, степень дифференцировки G3, множественные или часто рецидивирующие опухоли, рак in situ); опухоли средней степени риска (все другие опухоли, Та — T1, G1 — G2, множественные, более 3 см в диаметре).
Таким образом, результаты ТУР мочевого пузыря при поверхностном раке неудовлетворительны: часто наблюдаются рецидивы и прогрессия заболевания. Для профилактики рецидивов и предотвращения прогрессирования поверхностного РМП применяется внутрипузырная химиотерапия или иммунотерапия.
Химиотерапия при поверхностном РМП
В настоящее время внутрипузырная химиотерапия редко применяется как самостоятельный метод лечения. Главным образом, она назначается как адъювантная терапия после ТУР мочевого пузыря. Наиболее эффективными препаратами при поверхностном РМП являются доксорубицин, эпирубицин, митомицин, тиотепа.
Тиотепа — один из первых противоопухолевых алкилирующих препаратов. Внутрипузырно применяется в дозе от 20 до 60 мг в 50 мл физиологического раствора с экспозицией 1 ч. Вводится 1–2 раза в неделю, суммарно не более 240–300 мг под контролем анализов крови, т.к. возможна лейкопения.
В 1992 г. Lamm проанализировал опубликованные данные об эффективности адъювантной терапии при поверхностном РМП. Данные о результатах применения тиотепы представлены в таблице 2.
Таблица 2
Сравнение эффективности ТУР и ТУР + тиотепа
у больных поверхностным РМП
| Автор, год опубликования |
Число больных |
Рецидивы после ТУР, % | Рецидивы после ТУР + тиотепа, % |
Преимущество, % | Р |
| Burnand, 1976 | 51 | 97 | 58 | 39 | 0,001 |
| Byar, 1977 | 88 | 60 | 47 | 3 | 0,016 |
| Nooks, 1979 | 42 | 64 | 65 | -1 | NS |
| Asahi, 1980 | 106 | 37 | 37 | NS | |
| Sohulman, 1980 | 144 | 52 | 49 | 3 | NS |
| Macaluso, 1980 | 94 | 60 | 23 | 37 | S |
| Koontz, 1981 | 93 | 66 | 40 | 26 | 0,02 |
| Zincke, 1983 | 58 | 71 | 30 | 41 | 0,002 |
| Prout, 1983 | 90 | 76 | 64 | 12 | 0,05 |
| MRC, 1985 | 243 | 32 | 37 | −5 | NS |
| Total | 1009 | 62 | 45 | 17 |
Из представленных данных видно, что частота рецидивов после ТУР составляет в среднем 62% (32–97%), а после ТУР и адъювантной химиотерапии тиотепой — 45% (23–65%). Из 10 представленных исследований в 4 не получено статистически достоверных различий в частоте рецидивов. Но в целом при анализе результатов лечения более 1000 пациентов отмечено, что применение тиотепы снижает частоту рецидивов на 17%.
Эпирубицин — противоопухолевый антибиотик антрациклинового ряда. Препарат назначается по 30–50 мг в 30–50 мл дистиллированной воды или физиологического раствора 1 раз в неделю в течение 8 нед.
Доксорубицин — противоопухолевый антибиотик антрациклинового ряда. Применяется внутрипузырно по 30–50 мг препарата в 30–50 мл физиологического раствора с экспозицией 1 ч. Инстилляции проводятся 1 раз в неделю в течение 8 нед. Некоторые авторы рекомендуют более интенсивный режим введения препарата — по 50 мг в 50 мл физиологического раствора ежедневно в течение 10 дней. При появлении выраженной дизурии необходимо сделать перерыв в лечении до стихания симптомов. В таблице 3 представлены результаты применения доксорубицина.
Таблица 3
Сравнение эффективности ТУР и ТУР + доксорубицин
у больных поверхностным РМП
| Автор, год опубликования |
Число больных | Рецидивы после ТУР, % | Рецидивы после ТУР + доксорубицин, % | Преимущество, % |
| Niijima, 1983 | 288 | 45 | 30 | 15 |
| Zincke, 1983 | 59 | 71 | 32 | 39 |
| Kurth, 1985 | 155 | 48 | 35 | 13 |
| Rubben, 1988 | 220 | 61 | 56 | 5 |
| Total | 722 | 56 | 38 | 18 |
Частота рецидивов после ТУР составила в среднем 56% (45–71%), а после операции и профилактической химиотерапии — 38% (30–56%). Применение доксорубицина в целом 722 больным привело к снижению частоты рецидивов на 18%. Основным проявлением местной токсичности является развитие лекарственного цистита.
Митомицин — противоопухолевый антибиотик. Назначается внутрипузырно по 30–40 мг в 30–40 мл физиологического раствора 1 раз в неделю в течение 4–8 нед. Экспозиция — 1 ч. Некоторые авторы после еженедельных инстилляций продолжают поддерживающую терапию в более редком режиме. В таблице 4 отражены результаты рандомизированных исследований по сравнению ТУР и ТУР с последующей внутрипузырной химиотерапией митомицином.
Таблица 4
Сравнение эффективности ТУР и ТУР + митомицин
у больных поверхностным РМП
| Автор, год опубликования |
Число больных | Рецидивы после ТУР, % | Рецидивы после ТУР + митомицин, % | Преимущество, % | Р |
| Huland, 1983 | 58 | 40 | 7 | 33 | 0,01 |
| Niijima, 1983 | 278 | 46 | 37 | 9 | NS |
| Kim, 1988 | 43 | 68 | 67 | 1 | NS |
| Tolly, 1988 | 397 | 65 | 42 | 23 | 0,001 |
| Rubben, 1990 | 83 | 42 | 35 | 7 | NS |
| Total | 859 | 52 | 37 | 15 |
Из представленных данных видно, что частота рецидивов при хирургическом подходе к лечению больных поверхностным РМП составила 52% (40–68%), а при адъювантном применении митомицина — 37% (7–67%). В трех исследованиях из пяти не получено достоверных различий. Но суммарно у 859 больных применение митомицина после ТУР уменьшило частоту рецидивов на 15%.
Интересные результаты получены Tolley и соавт., которые изучили частоту рецидивов РМП в 3-х группах больных: в 1-й группе применялась однократная внутрипузырная инстилляция 40 мг митомицина в течение 24 ч после ТУР; во 2-й группе введение митомицина после ТУР дополнялось ежеквартальными профилактическими инстилляциями в течение 1 года; в 3-й группе адъювантная химиотерапия не проводилась. В результате риск рецидива в 1-й группе уменьшился на 34% (р=0,01), а во 2-й — на 50% (р=0,001).
Рекомендации Европейской ассоциации урологов по лечению поверхностного РМП:
1. Полное удаление всехъ опухолей (ТУР).
2. Однократная ранняя (в течение 6 ч) внутрипузырная инстилляция химиопрепарата (по выбору).
3. В группе низкого риска дополнительное лечение может не проводиться.
В группе средней степени риска следует продолжить внутрипузырную химиотерапию (не более 1 года) или внутрипузырную иммунотерапию (БЦЖ) с поддерживающим режимом от 1 до 3 лет
В группе высокого риска:
а) повторная ТУР через 4 — 6 нед;
б) внутрипузырная БЦЖ-терапия с поддерживающим режимом от 1 до 3 лет или радикальная цистэктомия (как метод выбора или при отсутствии эффекта от БЦЖ-терапии).
Внутрипузырная профилактическая химиотерапия не оказывает влияния на частоту прогрессии РМП (табл. 5).
Таблица 5
Влияние адъювантной химиотерапии на частоту прогрессии опухоли у больных поверхностным РМП
| Автор, год опубликования | ТУР + химиотерапия (число больных) | Прогрессия (число больных, %) | ТУР (число больных) | Прогрессия (число больных, %) |
| Green, 1984 | Тиотепа (25) | 1 (4%) | 31 | 6 (19%) |
| Prout, 1983 | Тиотепа (45) | 6 (13,3%) | 45 | 4 (8,9%) |
| MRC, 1985 | Тиотепа (244) | 7 (2,8%) | 123 | 2 (1,6%) |
| Huland, 1983 | Митомицин (28) | 1 (4%) | 30 | 6 (20%) |
| Tolly (MRC),1988 | Митомицин (267) | 6 (2,2%) | 130 | 2 (1,5%) |
| Rubben, 1988 | Доксорубицин (138) | 19 (14%) | 82 | 10 (12%) |
| Kurth, 1989 | Доксорубицин (165) | 20 (12%) | 70 | 7 (10%) |
| Total | 912 | 60 (6,6%) | 511 | 37 (7,2%) |
Ни одно из 7 представленных исследований не подтвердило преимущества адъювантной внутрипузырной химиотерапии в отношении прогрессии по сравнению только с ТУР.
Более поздние рандомизированные исследования, охватывающие значительное количество больных, также подтвердили положительное влияние адъювантной внутрипузырной химиотерапии на снижение частоты рецидивов поверхностного РМП, не выявили достоверных различий в частоте прогрессии опухоли и не отметили различий в отдаленных результатах лечения между больными, получавшими и не получавшими профилактическую химиотерапию после ТУР.
В настоящее время внутрипузырная химиотерапия редко назначается как самостоятельный метод лечения при поверхностных папиллярных новообразованиях мочевого пузыря. Она находит применение при раке in situ, хотя и уступает по эффективности внутрипузырной БЦЖ-терапии. В таблице 6 представлены результаты лечения рака in situ.
Таблица 6
Результаты внутрипузырной терапии первичной карциномы in situ (L. Boccon-Gibod, 1999)
| Препарат | Число больных | Полный ответ, % |
| Тиотепа | 89 | 38 |
| Доксорубицин | 212 | 48 |
| Митомицин | 147 | 53 |
| БЦЖ | 718 | 70 |
Иммунотерапия при поверхностном РМП
Применение вакцины БЦЖ
Иммунотерапия получила широкое распространение после того, как в 1976 г. Morales и соавт. впервые опубликовали данные об эффективном внутрипузырном применении вакцины БЦЖ при поверхностном РМП. С тех пор во многих клинических исследованиях была подтверждена высокая противоопухолевая активность вакцины БЦЖ в отношении поверхностного переходноклеточного папиллярного рака и рака in situ. Многие авторы считают, что сочетание ТУР с профилактической внутрипузырной иммунотерапией вакциной БЦЖ является “золотым стандартом” лечения поверхностного РМП.
Механизм действия вакцины БЦЖ до конца не изучен. В ряде исследований было показано, что БЦЖ не обладает прямым цитотоксическим действием на опухолевые клетки. Продемонстрировано, что при введении БЦЖ в мочевой пузырь развивается воспалительная реакция, но для этого необходим непосредственный контакт микобактерий со стенкой мочевого пузыря. Показана важная роль фибронектина в связывании БЦЖ со стенкой мочевого пузыря и необходимость Т-клеток для развития местной иммунной реакции.
Лечение опухолей, имплантированных бестимусным мышам, оказывается безуспешным, но если этим мышам ввести Т-клетки, проявляется противоопухолевый эффект БЦЖ. Исследования на мышах с нормально функционирующим тимусом, которым для подавления Т-клеточного иммунитета применяли МКА, также подтвердили необходимость присутствия Т-лимфоцитов для проявления противоопухолевой активности БЦЖ. В ряде работ продемонстрировано, что для развития противоопухолевого действия БЦЖ необходимо присутствие CD8 цитотоксических лимфоцитов и CD4 клеток-хелперов. Эти данные позволяют считать, что противоопухолевая активность БЦЖ обусловлена неспецифическим локальным иммунным процессом.
Иммунологический механизм противоопухолевого действия БЦЖ подтверждается тем, что в ответ на инстилляции БЦЖ в моче появляются некоторые цитокины: ИЛ–1, ИЛ–2, ИЛ–6, ТНФ, гамма-интерферон. Повышенная секреция цитокинов отмечается в течение 2–8 ч после инстилляции и снижается до нормального уровня в течение 24 ч у большинства больных. Ни ИЛ–2, ни ТНФ не были обнаружены в моче здоровых людей, и в очень редких случаях и низких концентрациях ИЛ–2 определялся при неспецифическом цистите. Наибольший уровень цитокинов определялся после 5 и 6 введений БЦЖ. Отмечалась выраженная корреляция между уровнем ИЛ–2 в моче и временем наступления рецидива (р = 0,003) (у ИЛ–2-позитивных больных были поздние (позже 6 мес), а у ИЛ–2-негативных — ранние рецидивы).
Таким образом, многочисленными исследованиями показано, что в основе механизма противоопухолевого действия вакцины БЦЖ лежит локальная иммунная реакция, в которой задействованы Т-лимфоциты, макрофаги, целый ряд цитокинов.
Результаты адъювантного применения вакцины БЦЖ, полученные в 5 рандомизированных исследованиях, охватывающих 367 больных, представлены в таблице 7.
Таблица 7
Сравнение эффективности ТУР и ТУР + БЦЖ
у больных поверхностным РМП
| Автор, год опубликования |
Число больных | Рецидивы после ТУР, % | Рецидивы после ТУР + БЦЖ, % | Преимущество, % | Р |
| Lamm, 1985 | 57 | 52 | 20 | 32 | <0,001 |
| Herr, 1985 | 86 | 95 | 42 | 53 | <0,001 |
| Herr, 1986 (CIS) | 49 | 100 | 35 | 65 | <0,001 |
| Pagano, 1989 | 98 | 83 | 15 | 68 | <0,001 |
| Rubben, 1990 | 77 | 42 | 35 | 7 | NS |
| Total | 367 | 74 | 29 | 45 | <0,000 |
Из представленных данных видно, что профилактическая иммунотерапия привела к снижению частоты рецидивов по сравнению с только оперативным лечением на 45%.
В ряде исследований было показано, что профилактическая иммунотерапия не только снижала частоту рецидивов, но и отодвигала сроки их появления.
На эффективность профилактической БЦЖ-терапии влияют:
— стадия заболевания (Та или Т1),
— степень дифференцировки опухолевых клеток,
— проводимая ранее внутрипузырная химиотерапия.
Отмечается целесообразность проведения повторных курсов профилактической иммунотерапии при рецидивах, развившихся после уже проведенной адъювантной БЦЖ-терапии. Большое значение в профилактике рецидивов заболевания некоторые авторы придают проведению поддерживающей терапии в дополнение к 6-недельному индукционному курсу.
Несмотря на более чем 25-летнюю историю применения БЦЖ, неясным оставался вопрос: снижает ли БЦЖ-терапия частоту прогрессии поверхностного РМП. Sylvester и соавт. провели анализ 24 рандомизированных исследований, охватывающих 4863 больных РМП в стадиях Ta, T1 и раком in situ. Среднее время наблюдения за больными составило 2,5 года. Частота прогрессии составила 9,8% в группе ТУР+БЦЖ и 13,8% в группе ТУР или ТУР+любое лечение, кроме БЦЖ. Отмечено достоверное (р = 0,001) уменьшение частоты прогрессии в группе больных, получавших БЦЖ-терапию.
Таким образом, внутрипузырная БЦЖ-терапия зарекомендовала себя как высокоэффективный метод профилактики рецидивов и предупреждения прогрессии поверхностного переходноклеточного РМП.
Внутрипузырная терапия вакциной БЦЖ является методом выбора лечения больных РМП in situ. Данные об эффективности внутрипузырной иммунотерапии рака in situ представлены в таблице 8. Полная регрессия опухоли наблюдается в среднем у 70% больных.
Обычно проводится 6-недельный индукционный курс внутрипузырной иммунотерапии. Если при контрольном обследовании наблюдается персистенция опухоли без признаков прогрессии, проводится второй подобный курс лечения. Если после двух курсов иммунотерапии в мочевом пузыре остается рак in situ, дальнейшее применение БЦЖ считается нецелесообразным.
При поверхностном папиллярном раке иммунотерапия вакциной БЦЖ в настоящее время редко применяется как самостоятельный метод лечения, хотя эффективность ее по данным проведенных ранее исследований составляет от 41 до 81%.
Таблица 8
Результаты внутрипузырной БЦЖ-терапии больных РМП in situ
| Авторы, год опубликования | Число больных |
Полная регрессия | % полной регрессии |
| De Kernion, 1985 | 19 | 15 | 79 |
| Brosman, 1985 | 33 | 31 | 94 |
| Haaff, 1986 | 19 | 13 | 68 |
| Schellhammer, 1986 | 28 | 20 | 71 |
| Mydlo, 1986 | 25 | 10 | 40 |
| Lamm, 1985 | 43 | 35 | 81 |
| Morales, 1984 | 17 | 10 | 59 |
За более чем 25-летний период применения вакцины БЦЖ при поверхностном РМП были апробированы многие схемы лечения, однако предметом дискуссии остается вопрос об оптимальном варианте. До сих пор некоторые исследователи применяют внутрипузырные инстилляции в сочетании с внутрикожной сенсибилизацией, хотя в ряде рандомизированных исследований не отмечено преимущества подобного сочетания.
Используются различные разовые дозы вакцины БЦЖ — 120 мг, 81 мг, 75 мг, 50 мг, 27 мг. Во многих исследованиях продемонстрировано, что низкие дозы столь же эффективны, как и высокие.
Наиболее часто применяется 6-недельный индукционный курс иммунотерапии, предложенный Morales и соавт. Однако в ряде случаев проведение только одного 6-недельного индукционного курса иммунотерапии не является оптимальным: приблизительно у 40% больных не отмечается эффекта, тогда как у большинства из них ответ на лечение появляется после повторного 6-недельного курса.
Неоднозначным является мнение относительно длительности проведения иммунотерапии. Многими авторами доказана целесообразность проведения поддерживающей БЦЖ-терапии у больных, достигших полной регрессии опухоли в результате индукционного курса. В некоторых исследованиях преимущество поддерживающего лечения не нашло подтверждения.
Токсичность внутрипузырной БЦЖ-терапии проявляется в виде локальных и системных проявлений. Наиболее часто местное побочное действие внутрипузырной БЦЖ-терапии выражается в развитии дизурических явлений и цистита, появление которых отмечают до 80% больных, и макрогематурии, которую отмечают до 40% пациентов. Обычно подобные симптомы появляются после 2–3 введений БЦЖ, начинаются через 2–3 ч после инстилляции и продолжаются в течение 1–2 суток. С увеличением количества инстилляций выраженность побочных проявлений может нарастать. Чаще указанные проявления проходят самостоятельно, или может быть проведено симптоматическое лечение. Системным проявлением побочного действия БЦЖ-терапии является повышение температуры тела, не превышающее 38,5°C, которое отмечают до 40% пациентов в день инстилляции. Обычно продолжительность лихорадки не составляет более 48 ч. Специального лечения не требуется, или могут применяться жаропонижающие препараты.
До 20% больных отмечают локальные осложнения в виде выраженных циститов, не проходящих к моменту следующей инстилляции. В таких случаях лечение должно быть прервано. После исключения бактериального цистита иной этиологии назначается терапия противотуберкулезными препаратами до исчезновения симптомов и в течение 2 нед после нормализации состояния. БЦЖ-терапия может быть затем продолжена сниженной до 30% и даже до 10% дозой. Относительно редко (3–5%) наблюдаются локальные осложнения — симптоматические грануломатозные циститы, простатиты, эпидидимиты. У ряда больных развитие грануломатозных инфильтратов в области устьев мочеточников может привести к нарушению пассажа мочи из верхних мочевых путей и потребовать временного их дренирования. При развитии подобных осложнений показана терапия изониазидом (300 мг/сут) и рифампицином (600 мг/сут) в течение 3 мес.
Имеются немногочисленные наблюдения развития в ответ на внутрипузырное введение БЦЖ системных осложнений типа сепсиса с очагами специфического воспаления в печени, легких, почках и других органах. В развитии системных осложнений ведущую роль играют два главных механизма: гематогенное распространение БЦЖ и иммунноаллергическая реакция. Как правило, системные осложнения развиваются после грубых травматичных катетеризаций мочевого пузыря с последующим введением БЦЖ или при слишком раннем начале иммунотерапии после ТУР мочевого пузыря. Клинически системное БЦЖ-поражение характеризуется острым началом: повышением температуры тела более 38,5°C, ознобом, резким ухудшением общего состояния. Иногда отмечается падение АД. Быстро развивается печеночная и почечная недостаточность. Назначается терапия тремя противотуберкулезными препаратами: изониазидом (300 мг/сут), рифампицином (600 мг/сут) и этамбутолом (1200 мг/сут). В обязательном порядке к терапии добавляется антибиотик широкого спектра действия для лечения возможного уросепсиса не БЦЖ этиологии. Антибактериальную терапию сочетают с применением кортикостероидов: гормональная терапия предотвращает угрожающую жизни гиперэргическую реакцию.
К системным осложнения могут быть отнесены и аллергические реакции на введение БЦЖ. Их частота составляет менее 1%. Они могут проявляться в виде кожной сыпи, артритов, артралгий.
Применение интерферона
Другим иммуномодулятором, применяющимся при поверхностном РМП как с лечебной, так и с профилактической целью, является интерферон (интерферон альфа–2б). Действие интерферона многостороннее: антипролиферативное, иммуностимулирующее, противовирусное, цитотоксическое. Механизм действия, посредством которого интерферон проявляет свою противоопухолевую активность, представляется комплексным. В этот процесс может быть вовлечено прямое ингибирующее воздействие на опухолевые клетки. Кроме того, многочисленными исследованиями показано, что в стенке мочевого пузыря в ответ на интрапузырное введение интерферона развивается местный иммунный процесс, который, видимо, и является основным действующим началом в достижении противоопухолевого эффекта.
Традиционный режим внутрипузырного введения при поверхностном РМП — 1 раз в неделю в течение 12 нед, затем ежемесячно до 1 года. Используются различные разовые дозы — от 10 до 100 млн МЕ.
Отмечено, что эффективность лечения зависит от дозы препарата. По данным исследователей, применявших интерферон альфа–2б при раке in situ, полная регрессия отмечена у 43% больных при использовании разовой дозы 100 млн МЕ и у 5% — при применении дозы 10 млн МЕ. Связь между высокой дозой препарата и его эффективностью прослеживается и в работах других авторов.
Наряду с работами, связывающими положительный результат лечения с высокой дозой препарата, имеются сообщения об эффективности низких доз интерферона, если увеличивается время нахождения препарата в мочевом пузыре. Так, внутрипузырное применение интерферона альфа–2б в разовой дозе 3 и 6 млн МЕ при экспозиции 6 ч/сут позволило добиться безрецидивного течения заболевания у 30 из 35 (85,7%) больных.
В ряде исследований отмечена высокая эффективность сочетанного внутрипузырного применения интерферона альфа и химиопрепаратов: митомицина, фторурацила и др.
Кроме вакцины БЦЖ и интерферона-альфа, при поверхностном РМП изучаются другие иммуномодуляторы: ИЛ–2 (интерлейкин–2 человека рекомбинантный), KLH, ОК–432, бропиримин и т.д. Однако широкого клинического применения указанные препараты пока не нашли.
Таким образом, ведущее значение в лечении папиллярного поверхностного РМП принадлежит ТУР в сочетании с внутрипузырной иммуно— или химиотерапией. При раке in situ методом выбора является внутрипузырная БЦЖ-терапия. Лучевая терапия редко применяется при поверхностном РМП ввиду низкой эффективности. В тех случаях, когда ТУР и внутрипузырная терапия оказываются неэффективными, выполняется цистэктомия.
Лечение инвазивного РМП
Хирургический метод является основным в лечении больных инвазивным РМП. Ведущее значение имеет цистэктомия. Кроме того, применяются резекция мочевого пузыря и ТУР.
Цистэктомия
Показаниями к цистэктомии являются:
1) инвазивный рак, локализация и размеры которого не позволяют выполнить радикальную резекцию с сохранением достаточной емкости мочевого пузыря;
2) прогрессия поверхностного РМП (увеличение критерия “Т”);
3) быстро рецидивирующий поверхностный папиллярный РМП, когда не удается добиться излечения или длительной ремиссии после применения ТУР и внутрипузырной иммуно— или химиотерапии, особенно высокозлокачественные опухоли T1 G3;
4) рак in situ, не поддающийся внутрипузырной БЦЖ-терапии;
5) множественное (субтотальное и тотальное) опухолевое поражение мочевого пузыря.
Стандартным объемом радикальной цистэктомии у мужчин является двухсторонняя тазовая лимфаденэктомия в сочетании с удалением единым блоком предстательной железы, семенных пузырьков и мочевого пузыря с покрывающей его висцеральной брюшиной и околопузырной клетчаткой. У женщин удаляются единым блоком тазовые лимфатические узлы, уретра, мочевой пузырь с покрывающей его брюшиной и околопузырной клетчаткой, передняя стенка влагалища, шейка матки и матка с придатками.
Предоперационная подготовка
Накануне операции после завтрака до полуночи разрешается употреблять внутрь только жидкость. После полуночи прием жидкости запрещается. В 9.00 накануне операции больной получает внутрь 50 мл касторового масла. С этого же времени начинается антибактериальная терапия: назначаются внутрь эритромицин по 1,0 в 12.00, 16.00, 20.00 и в 24.00 ч и неомицина сульфат по 1,0 в 13.00, 14.00 и в 23.00 ч. За 1 ч до операции парентерально вводится антибиотик широкого спектра действия.
Техника операции
Положение больного на спине. В полость мочевого пузыря устанавливается катетер Foley для дренирования. Выполняется нижняя и средняя срединная лапаротомия. У пупка пересекается урахус, который должен быть удален единым блоком с мочевым пузырем. Мочеточники выделяются от уровня перекреста с общими подвздошными артериями дистально до впадения в мочевой пузырь. Отступя 2 см от мочевого пузыря, они пересекаются. Дистальные концы их перевязываются. Резецируются небольшие участки проксимальных концов и посылаются для срочного гистологического исследования. Затем мочеточники мобилизуются проксимальнее общих подвздошных артерий. Дилатированные мочеточники стентируются для оттока мочи. Нерасширенные мочеточники могут быть перевязаны: под действием гидростатического давления мочи за время цистэктомии они расширятся, что облегчит наложение уретеро-интестинальных анастомозов. Выполняется тазовая лимфодиссекция: удаляются жировая клетчатка с расположенными в ней лимфатическими узлами вдоль подвздошных сосудов и из запирательной ямки. Выделяется боковая стенка мочевого пузыря. Рассекается брюшина ректовезикального кармана. Мобилизуется задняя поверхность мочевого пузыря и предстательной железы (у женщин пересекаются и лигируются кардинальные связки матки, задняя стенка влагалища отделяется от прямой кишки на протяжении 4–5 см и на этом уровне рассекается. Разрез продолжается кпереди и дистально к наружному отверстию уретры, так что передняя стенка влагалища остается связанной с мочевым пузырем и удаляется в дальнейшем вместе с ним). Аналогично производятся лимфодиссекция и выделение боковой и задней стенок мочевого пузыря и простаты с противоположной стороны. Выделяются боковые и передняя поверхности предстательной железы до уретры. Сразу у верхушки предстательной железы на уретру накладывается изогнутый зажим, дистальнее которого уретра пересекается (у женщин уретра иссекается вместе с передней стенкой влагалища. Сшиваются между собой оставшиеся боковые стенки влагалища, в результате чего последнее представляет собой узкую трубку. Важно фиксировать оставшееся ушитое влагалище к Куперовым связкам с обеих сторон для предотвращения выпадения влагалища или развития энтероцеле). Контролируется гемостаз. При кровотечении из зоны дорсального венозного сплетения кровоточащие сосуды дополнительно прошиваются. Операция заканчивается дренированием полости малого таза.
Деривация мочи
Основным вопросом, который приходится решать после выполнения радикальной цистэктомии, является отведение мочи. На сегодняшний момент можно выделить три варианта:
1) наружное отведение мочи (уретерокутанеостомия, кишечная пластика с формированием “сухих” и “влажных” уростом);
2) внутреннее отведение мочи в непрерывный кишечник (уретеросигмостомия, операция Mainz-pouch II);
3) создание кишечных резервуаров, выполняющих функцию мочевого пузыря и обеспечивающих возможность самостоятельного контролируемого мочеиспускания.
Такие операции, как уретерокутанеостомия или уретеросигмостомия, в настоящее время применяются крайне редко из-за большого числа осложнений: развиваются восходящая инфекция верхних мочевых путей, пиелонефрит, почечная недостаточность, гиперхлоремический ацидоз. Больные в большей степени погибают от осложнений, чем от прогрессирования заболевания.
Остановимся на некоторых вариантах отведения мочи, которые широко применяются в настоящее время.
Операция Брикера (уретероилеокутанеостомия, илеальный кондуит)
Предложенная Брикером (Bricker) в 1950 г. операция по созданию илеального кондуита для отведения мочи до сих пор применяется большинством авторов и стала стандартом, с которым сравнивают результаты других операций по деривации мочи.
Техника операции
Выполняется стандартная цистэктомия, аппендэктомия. Левый мочеточник переводится на правую сторону под брыжейкой сигмовидной кишки. Резецируется сегмент терминального отдела подвздошной кишки длиной приблизительно 15 см. Брыжейка отводящего конца сегмента ileum мобилизуется до корня, чтобы обеспечить сегменту максимальную мобильность. В области приводящего конца сегмента илеум брыжейка рассекается минимально, чтобы обеспечить сегменту широкую питающую ножку. Приводящий конец сегмента илеум зашивается. Анастомозом “конец в конец” или “бок в бок” восстанавливается непрерывность кишечника. Концы мочеточников косо срезаются или рассекаются вдоль на протяжении 1 см для создания широкого анастомоза с подвздошной кишкой. Делаются овальные отверстия на стенке сегмента илеум на расстоянии 3–4 см от ее приводящего конца, соответствующие размерам срезов мочеточников. Накладываются прямые анастомозы между мочеточниками и подвздошной кишкой четырьмя-шестью рассасывающимися атравматичными 4–0 швами. Возможны другие варианты наложения анастомоза, например, по методу Wallace. Фиксируется проксимальный конец отрезка илеум к задней брюшине. Зашиваются все отверстия, в которые может проскользнуть и затем ущемиться петля кишки. Операция заканчивается выведением отводящего конца сегмента илеум на кожу правой подвздошной области. Канал в брюшной стенке должен быть прямым и не являться причиной перегибов и сужений сегмента илеум. В сегмент устанавливается катетер Foley № 18–20 Ch для предупреждения возможной задержки мочи (особенно если не применялась интубация мочеточников). Малый таз дренируется через контрапертуры в передней брюшной стенке.
Основным недостатком этой операции является наличие у больного влажной уростомы. Однако применение мочеприемников, герметично фиксируемых к краям уретероилеостомы и обеспечивающих улавливание всей выделяющейся мочи, позволяет сохранять пациентам достаточно высокое качество жизни, трудоспособность и не быть обременительными в семье и коллективе.
Операция Mainz-pouch II
Техника операции
Сигмовидная кишка складывается U-образно (основание ‘U’ обращено вправо) и рассекается вдоль taenia libera на протяжении 20 см. Стенки рассеченной кишки, обращенные кзади, сшиваются между собой двумя рядами непрерывных 4–0 рассасывающихся швов. Анастомозы с мочеточниками накладываются с обеих сторон от линии шва задней стенки резервуара параллельно ему. Для этого на слизистую кишки с одной стороны от шва накладывают 4 поддерживающих шва, при растягивании которых образуется площадка. В основании площадки, обращенном краниально, вырезается участок стенки кишки для проведения мочеточника. Во избежание стриктуры в последующем важно, чтобы размер отверстия был в 2 раза больше диаметра мочеточника. Начиная от образованного отверстия, делается подслизистый туннель длиной 4–5 см, у дистального конца которого слизистая кишки рассекается. Мочеточник проводится через туннель и фиксируется к стенке кишки двумя закрепляющими швами, расположеными на 5 и 7 часах, и четырьмя муко-мукозными швами. В мочеточник устанавливается катетер № 8 Ch, который выводится через прямую кишку. Аналогичным образом выполняется имплантация второго мочеточника. Проксимальный конец шва задней стенки резервуара эвагинируется кзади и фиксируется к передней продольной связке промонториума двумя швами. Этим достигается фиксация резервуара и профилактика его дислокации и перегиба или натяжения мочеточников. Передняя стенка резервуара зашивается двумя рядами узловых рассасывающихся швов. В кишку устанавливается интубационная трубка на 4–5 дней. Мочеточниковые стенты удаляются на 8–10 день после операции.
По мнению хирургов, выполняющих данный вариант деривации мочи, функциональные результаты удовлетворительные. У ряда больных наблюдаются раздельные акты дефекации и мочеиспускания.
Создание удерживающего мочу резервуара из подвздошной кишки (операция Kock)
Техника операции
На участке между a. ileocolica и конечными тонкокишечными ветвями верхней брыжеечной артерии пересекается подвздошная кишка и ее брыжейка до корня (для обеспечения наибольшей мобильности отводящего конца резервуара). В проксимальном направлении отмеряются и отграничиваются лигатурами участки подвздошной кишки длиной 17 см (для отводящего от резервуара сегмента), два участка по 22 см (для собственно резервуара) и 17 см (для приводящего к резервуару сегмента). На этом уровне тонкая кишка пересекается. Таким образом, изолируется сегмент подвздошной кишки, из которого будет конструироваться резервуар и клапанные механизмы. Проксимальный конец изолированного илеального сегмента зашивается двухрядным швом: внутренний ряд накладывается рассасывающимся шовным материалом (для профилактики возможного образования камней в будущем). Восстанавливается непрерывность кишечника. Изолированный сегмент ileum складывается U-образно в каудальном направлении так, чтобы граница между двумя участками по 22 см была самой нижней точкой. Участки по 22 см сшиваются между собой бок-в-бок серо-серозными швами, отступя от края брыжейки 1–2 см. Затем они рассекаются вдоль по противобрыжеечному краю, отступив латерально от серосерозных швов. Разрезы продолжаются на афферентный и эфферентный отрезки на 2–3 см дальше серосерозных швов, чтобы можно было правильно расположить и зафиксировать инвагинированые клапаны. Затем внутренние края рассеченных сегментов сшиваются двумя рядами обвивных рассасывающихся швов — формируется задняя стенка резервуара. Непосредственно у серозы кишки отделяется брыжейка вдоль приводящего и отводящего сегментов на протяжении 7–8 см, начиная от резервуара. В просвет приводящего сегмента проводятся два зажима Allis, захватывается слизистая лишенного брыжейки участка кишки приблизительно на расстоянии 2/3 его длины, и последний инвагинируется в резервуар. На переднюю полуокружность инвагинированного участка накладываются 3 ряда швов с помощью сшивающего аппарата. Для профилактики камнеобразования 5–6 скрепок, расположенных у верхушки инвагината в каждом ряду, целесообразно вынуть или не заряжать в картридж сшивающего аппарата. Четвертым рядом швов, расположенным на задней полуокружности, инвагинат в дальнейшем фиксируется к стенке резервуара для профилактики деинвагинации. Основание инвагината фиксируется к стенке сегмента отдельными не рассасывающимися швами. Подобная операция выполняется на отводящем сегменте. Для нормального функционирования клапана длина инвагинированного участка должна быть 2,5–3 см. Следующим этапом U-образно расположенные и сшитые между собой сегменты илеум складываются в поперечном направлении и герметично сшиваются двумя рядами обвивных рассасывающихся атравматичных 3–0 швов, заканчивая формирование резервуара. Последний ротируется таким образом, что приводящее колено может быть фиксировано к области промонториума, что и выполняется. Концы обоих мочеточников расщепляются, и накладываются анастомозы с приводящим отрезком илеум. В мочеточники предварительно устанавливают стенты или интубирующие трубки, проведенные проксимально в лоханки почек; дистальные концы интубирующих трубок остаются в просвете резервуара (некоторые авторы рекомендуют дистальные отрезки интубирующих трубок выводить из резервуара через отводящий сегмент). После наложения анастомозов зашиваются все отверстия в брюшине, в которые может проскользнуть петля кишки и ущемиться. Следующим этапом отводящий от резервуара сегмент выводится на кожу брюшной стенки в заранее запланированное место (чаще — в область пупка) и тщательно фиксируется. Следует предусмотреть, чтобы отводящий отрезок располагался по возможности перпендикулярно к резервуару и имел прямой ход (для легкой катетеризации). Избыток отводящей кишки отсекается. В резервуар проводится катетер Foley № 30 и оставляется на 3 нед. Операция заканчивается дренированием брюшной полости.
Послеоперационное ведение больных
Резервуар орошается физиологическим раствором через катетер Foley для отмывания слизи через каждые 4 ч или по необходимости. Через 3 нед катетер удаляется и производится резервуароскопия обычным цистоскопом, во время которой удаляются мочеточниковые интубирующие трубки. Выполняется экскреторная урография и “резервуарография”. Если нет затеков контрастного препарата, больной инструктируется относительно самостоятельных катетеризаций. Приблизительно через 6 мес емкость резервуара составляет около 500 мл. Давление в резервуаре составляет 4–8 мм водн. столба при наполнении на 2/3.
Илеальный мочевой пузырь (операция Hautmann)
Техника операции
Выполняется стандартная радикальная цистэктомия. Пересекается подвздошная кишка между a. ileocolica и дистальной тонкокишечной ветвью верхней брыжеечной артерии. Изолируется сегмент подвздошной кишки длиной 60–70 см. Восстанавливается непрерывность кишечника. Участок сегмента кишки, наиболее легко подтягиваемый к уретре, прошивается шелковой лигатурой по противобрыжеечному краю для тракции. В зависимости от того, где находится прошитый участок, кишка складывается в виде М или W так, чтобы прошитый участок находился наиболее низко по направлению к уретре. Колена сложенной кишки фиксируются друг к другу удерживающими швами, после чего кишка рассекается по противобрыжеечному краю на всем протяжении за исключением 5 см, где разрез спереди огибает прошитый участок, предназначенный для анастомоза с уретрой. В этом месте кишка складывается U-образно, прошитый участок находится наиболее низко, чтобы облегчить анастомоз с уретрой. После этого колена рассеченной сложенной кишки сшиваются между собой однорядным непрерывным рассасывающимся швом 4–0, формируется плоская поверхность. U-образно сложенный участок формируется как шейка “нового мочевого пузыря”. В центре ранее прошитого участка кишки делается отверстие такого диаметра, чтобы через него проходил кончик мизинца. Трансуретрально через сделанное отверстие проводится катетер Foley. Затем шейка необладдера анастомозируется с уретрой рассасывающимися 1–0 матрацными швами, обычно накладывают 6 швов. Завязываются швы внутри “мочевого пузыря”. Наложению швов помогает умеренная тракция за катетер Foley. Имплантация мочеточников выполняется, когда резервуар помещен в таз и подшит к уретре. Пересадка мочеточников в этот момент позволяет выбрать их оптимальную длину и препятствует натяжению мочеточнико-резервуарного анастомоза. Мочеточники интубируют и имплантируют по антирефлюксной методике (Le Duc или Camey), левый мочеточник предварительно переводится на правую сторону под брыжейкой сигмовидной кишки. Передняя стенка резервуара зашивается непрерывным швом. Когда создание необледдера закончено, по уретре вводится катетер Foley 22 Ch, резервуар наполняется водой, чтобы оценить емкость и определить герметичность. Места протекания жидкости зашиваются. Катетер Foley держат 22 дня, перед его удалением делают цистограмму. Дополнительно катетер 12 Ch ставится как цистостома для контроля остаточной мочи. Устанавливают два силиконовых дренажа: один — в малый таз и один — к анастомозу с мочеточниками.
В 1999 г. Hautmann и соавт. представили результаты лечения первых 363 больных РМП, прослеженных 11 лет после создания ортотопического мочевого пузыря (в среднем — 57 мес). Периоперативная смертность составила 3% (11 человек). Обусловленные резервуаром ранние и поздние осложнения наблюдались соответственно у 56 (15,4%) и 85 (23,4%) больных; ранние и поздние повторные операции потребовались 0,3% и 4,4% пациентов соответственно. 96,1% больных мочились самостоятельно, 3,9% непостоянно катетеризировались, 1,7% — регулярно катетеризировались. 95,9% больных оценивали дневное удержание как хорошее, 4,1% требовалось более 1 прокладки в день. 95% больных оценивали ночное удержание как удовлетворительное, а 5% нуждались более чем в одной прокладке за ночь. Авторы считают, что функциональные результаты хорошие, и данная операция должна применяться.
Операция Studer
Техника операции
Выполняется стандартная тазовая лимфаденэктомия и цистэктомия. Мембранозный отдел уретры пересекается как можно ближе к верхушке простаты. Нейроваскулярные ветви дорсолатерально от простаты по возможности сохраняются.
Для создания резервуара резецируется сегмент ileum длиной 54–60 см, отступив от илеоцекального угла приблизительно на 25 см. Восстанавливается непрерывность кишечника. Оба конца резецированного сегмента зашиваются. Дистальные 40 см сегмента рассекаются по противобрыжеечному краю. Мочеточники расщепляются, и накладывается анастомоз “конец в бок” между мочеточниками и проксимальной частью нерассеченного афферентного сегмента ileum, который имеет длину около 14–20 см. Мочеточники при этом стентируются катетерами № 7–8 Ch. Для конструкции резервуара два медиальных края U-образно сложенной рассеченной части илеального сегмента сшиваются между собой непрерывным серозномышечным рассасывающимся швом. Получившаяся площадка сгибается так, что основание “U” помещается между его двумя концами. В результате этого получается сферический резервуар. Зашивается нижняя половина передней стенки и часть верхней половины. Через оставшееся отверстие хирург пальцем определяет самую нижнюю точку резервуара, где вырезается отверстие 8–10 мм в диаметре, снаружи от линии шва. Шесть рассасывающихся 2–0 серозномышечных швов накладываются между сделанным отверстием в стенке резервуара и мембранозным отделом уретры. Перед затягиванием и завязыванием швов в резервуар по уретре проводится катетер Foley № 18 Ch. Перед полным зашиванием передней стенки резервуара мочеточниковые стенты и № 12 Ch цистостомический дренаж проводятся через его стенку наружу. Отверстие в стенке резервуара прикрывается брыжейкой подвздошной кишки, что позволяет прикрыть каналы в стенке резервуара после удаления мочеточниковых стентов на 7–10 сутки после операции.
Цистостомический дренаж удаляется на 10–12 день после выполнения “цистографии” и исключения мочевых затеков. Уретральный катетер удаляется двумя днями позже.
Функциональные результаты
В 1995 г. Studer и соавт. представили опыт лечения первых 100 пациентов. По их данным, средняя функциональная емкость резервуара сразу после операции — 120 мл, через 6 мес — 450 мл и через 1 год — 500 мл. Базальное давление в резервуаре через 3 мес равнялось 20 см водн. столба при увеличении емкости резервуара до 300 мл. При переполнении резервуара контрастным веществом возникал рефлюкс, однако перистальтика мочеточников и афферентного сегмента быстро выводили контрастное вещество в резервуар. Во время мочеиспускания давление в резервуаре не повышалось, т.к. не было координированного сокращения резервуара. Через 1 год 92% больных удерживали мочу днем, хотя 1 настаивал на постоянном катетере и 1 нуждался в постоянной катетеризации в связи с нерасслабляющимся тазовым дном; в течение 2 лет 80% больных удерживали мочу ночью.
Кроме представленных выше вариантов деривации мочи, используются и другие методики, в т.ч. для создания ортотопического мочевого пузыря применяются толстая кишка и желудок.
Осложнения цистэктомии
Осложнения раннего послеоперационного периода наблюдаются в среднем у 20–40% больных. Чаще встречаются ранние осложнения:
— длительный парез кишечника;
— недостаточность уретро-резервуарного и межкишечного анастомозов;
— пиелонефрит;
— раневая инфекция.
— ТЭЛА (1–3%);
— инфаркт миокарда.
Поздние осложнения (у 12–30% больных):
— обструкция мочеточнико-кишечного соустья;
— рефлюкс мочи в верхние мочевые пути;
— стриктура уретры;
— стеноз инвагинационного клапана (2–4,3% наблюдений);
— недостаточность “сухой” стомы (до 3,5%);
— образование камней в резервуаре (около 4–5% больных).
У 6–27,3% больных, перенесших цистэктомию с формированием ортотопического мочевого пузыря, имел место гиперхлоремический ацидоз.
Развитие хронической диареи отмечено у 11% пациентов после формирования резервуара из сегмента подвздошной кишки и у 23% — при использовани илеоцекального угла кишечника.
Периоперационная смертность составляет около 3%.
Результаты цистэктомии
По данным разных авторов, до 60% пациентов страдают от рецидива заболевания. Локальные и локорегиональные рецидивы РМП развиваются у 4,8–33% больных, отдаленные метастазы появляются у 20,8–25%. Отдаленными метастазами РМП чаще поражаются легкие, кости, печень, лимфатические узлы.
5-летняя выживаемость больных РМП (без учета стадии заболевания) после цистэктомии составляет 51–73%. Решающее влияние на отдаленные результаты лечения имеет стадия заболевания. Результаты лечения больных, у которых опухоль ограничена стенкой мочевого пузыря, лучше, чем при опухолевой инвазии паравезикальной клетчатки или смежных органов. 5-летняя выживаемость больных в стадии рТ0 — рТ2 составляет 82–85%, а при рТ3 — рТ4а — 42–53%.
Резекция мочевого пузыря
На долю резекций мочевого пузыря приходится не более 10% оперативных пособий. Как правило, речь идет об инвазивном раке. Считается, что эта операция может быть произведена:
1) при первичном поражении мочевого пузыря;
2) опухоль должна быть одиночной,
3) опухоль должна локализоваться на подвижных стенках мочевого пузыря и отстоять от шейки не менее чем на 3 см;
4) размеры опухоли не должны превышать 5–6 см в диаметре;
5) в окружающей макроскопически не измененной слизистой и простатическом отделе уретры не должно быть рака in situ или тяжелых диспластических изменений.
Техника операции
Обычно операция выполняется из срединного внебрюшинного доступа (хотя некоторые авторы отдают предпочтение трансперитонеальным подходам к мочевому пузырю). Производится разрез кожи, подкожной клетчатки и апоневроза прямых мышц живота от пупка до лона. Тупо разводятся прямые мышцы живота. Переходная складка брюшины отодвигается вверх, и таким образом открывается передняя стенка мочевого пузыря. В зависимости от стороны поражения мобилизуется тот или иной участок мочевого пузыря. При расположении опухоли в области верхушки мочевого пузыря вскрывается брюшная полость, и покрывающая мочевой пузырь брюшина резецируется вместе с пораженной стенкой. Если опухоль локализуется в зоне устья мочеточника, последний выделяется, пересекается у места впадения в мочевой пузырь; дистальный конец перевязывается, а проксимальный интубируется полихлорвиниловой трубкой. После достаточной для выполнения резекции мобилизации стенки мочевого пузыря выполняют цистотомию. Производят ревизию полости мочевого пузыря и, отступив от видимого края опухоли на 2–2,5 см, выполняют резекцию его стенки вместе с опухолью. Если это необходимо, выполняется реимплантация мочеточника в мочевой пузырь по одной из антирефлюксных методик. Интубационная трубка мочеточника выводится из мочевого пузыря через дополнительное отверстие в его стенке. Мочевой пузырь зашивается хромированным кетгутом с наложением двух рядов швов и оставлением в его полости дренажной трубки, которая выводится над лоном. При операции у женщин можно воздержаться от надлобкового дренирования мочевого пузыря, а установить по уретре катетер Foley. После того как мочевой пузырь зашит, выполняется тазовая лимфаденэктомия на стороне поражения или двусторонняя, если опухоль располагалась вблизи от средней линии. Операция заканчивается дренированием околопузырного пространства.
Паравезикальные дренажи удаляются по мере уменьшения количества раневого отделяемого. Эпицистостомический дренаж извлекается на 12–14 сутки после выполнения цистографии и при рентгенологическом подтверждении отсутствия мочевых затеков.
Частота послеоперационных осложнений невелика.
Локорегиональные рецидивы рака после резекции мочевого пузыря наблюдаются в 55–65% случаев, у 40–60% больных появляются отдаленные метастазы. 5-летняя выживаемость больных инвазивным РМП (Т2 — Т3) после резекций мочевого пузыря различного объема составляет 32,5–79,4%. Подобно рецидивам заболевания, она зависит от стадии опухолевого процесса и вида выполненной операции.
Вопрос о целесообразности применении ТУР мочевого пузыря при инвазивных опухолях не решен. Большинство авторов считают данный объем операции недостаточным. Некоторые авторы допускают выполнение ТУР при РМП стадии Т2а N0 M0.
Лучевая терапия
Лучевая терапия применяется при инвазивном РМП в нескольких вариантах: по радикальной программе как самостоятельный метод лечения, предоперационная лучевая терапия, интраоперационная и послеоперационная лучевая терапия.
<
Лучевая терапия по радикальной программе
Критериями отбора больных для лучевой терапии по радикальной программе являются:
1) морфологическое подтверждение диагноза;
2) опухоли мочевого пузыря Т2, Т3а, а также Т3b размером не более 5–7 см, без сопутствующей carcinoma in situ;
3) желательно, чтобы у пациентов не было воспалительных заболеваний таза, толстой кишки и симптомов хронической спаечной болезни вследствие ранее перенесенных хирургических вмешательств;
4) у больных должна быть нормальная емкость мочевого пузыря и отсутствовать большие дивертикулы.
Для проведения дистанционной лучевой терапии применяются терапевтические гамма-установки типа “Рокус”, в которых источником излучения является 60Со. Используются методики статического и подвижного облучения. Более современными аппаратами являются линейные ускорители мощностью 10–25 МэВ. Преимуществом последних является возможность подведения большой дозы излучения к опухоли при минимальном повреждении смежных органов.
Объем облучаемых тканей включает в себя мочевой пузырь с паравезикальной клетчаткой и лимфатические узлы таза, расположенные ниже бифуркации общей подвздошной артерии. Однако до настоящего времени не ясно, улучшаются ли отдаленные результаты вследствие облучения регионарных лимфатических узлов.
Наиболее часто применяется РОД 1,8–2,0 Гр, СОД на область опухоли должна составлять не менее 60–65 Гр, а на область регионарных лимфатических узлов — 40–45 Гр. Продолжительность лучевой терапии составляет 6–7 нед.
Важнейшее значение для эффективности лучевой терапии и защиты окружающих тканей имеют топометрия и дозиметрия. Радиолог должен точно знать размеры и локализацию новообразования мочевого пузыря, расположено оно в стенке мочевого пузыря или выходит за ее пределы, соотношение мочевого пузыря с окружающими органами. Наиболее точное представление об этих параметрах дает КТ. Поэтому она обязательно должна применяться при планировании лучевой терапии. Лучшие результаты достигаются при использовании конформного облучения.
На эффективность лучевой терапии влияют:
— стадия заболевания,
— размеры новообразования,
— степень клеточной дифференцировки,
— состояние верхних мочевых путей, в частности, наличие гидронефроза.
По данным Sengelov и von der Maase, проанализировавших данные литературы о результатах радикальной лучевой терапии, проводившейся в 70–80 гг. ХХ в., острые осложнения, обусловленные лучевыми повреждениями кишечника (диарея, боль), развивались у 24–70% пациентов, а обусловленные повреждением мочевого пузыря (дизурия, боль) — у 53%. Тяжелые осложнения (илеус, перитонит, свищи) имели место у 3,5–8% пациентов. Уремия или сморщенный мочевой пузырь наблюдались в течение 5 лет после лучевой терапии у 8–12% больных. Частота осложнений не зависела от доз: 60–72 Гр или 50–57 Гр. Смертность после радикальной лучевой терапии составляла 2–3%.
Для больных, пролеченных в 80-х гг. ХХ в., 5-летняя выживаемость для всех стадий в целом равнялась 24–34%, а опухолеспецифическая выживаемость — 31–45%; локальный контроль отмечался у 27–35%. 5-летняя выживаемость больных, которым лучевая терапия проводилась в связи с тем, что невозможно было выполнить радикальную операцию, составляла 18–28%, а опухолеспецифическая — 24–31%, локальный контроль заболевания был возможен у 13% пациентов. 5-летняя выживаемость после лучевой терапии по радикальной программе составляла для стадии Т1 (по классификации ТNM 1987 г.) 35–71%; Т2 — Т3а — 26–46%, Т4 — 0–8%.
Предоперационная лучевая терапия
Для улучшения результатов цистэктомии при инвазивном РМП многие авторы применяли предоперационную лучевую терапию. Ее цели:
— снижение жизнеспособности опухолевых клеток,
— уменьшение метастатического потенциала,
— воздействие на экстравезикальный компонент опухоли.
Предлагались различные варианты лечения: облучение до СОД 20–25 Гр с последующей цистэктомией или лучевой терапией в течение 5 нед до СОД 50 Гр с цистэктомией через 4 нед. Некоторые авторы отмечали улучшение отдаленных результатов у больных, “ответивших” на предоперационную лучевую терапию уменьшением опухоли. Однако в рандомизированных исследованиях не получено убедительных данных, что применение предоперационного облучения улучшает выживаемость по сравнению с одной цистэктомией.
Послеоперационная лучевая терапия
Как правило, послеоперационная лучевая терапия назначается в тех случаях, когда у хирурга нет уверенности в радикальности выполненной операции. Цель послеоперационного облучения заключается в воздействии на оставшиеся опухолевые клетки для уменьшения вероятности местного рецидива.
Целесообразность применения послеоперационного облучения не доказана. Оценить эффективность послеоперационной лучевой терапии сложно, т.к. отличаются показания к ее проведению и отбор больных, используются различные РОД и СОД, различные режимы облучения. Рандомизированных исследований, посвященных эффективности послеоперационного облучения, нет.
Осложнения послеоперационной лучевой терапии наблюдаются часто и главным образом со стороны кишечника. Это обусловлено тем, что после выполнения цистэктомии ложе мочевого пузыря заполняют петли кишок, которые фиксируются спайками к стенкам таза. Поэтому планирование лучевой терапии должно быть очень тщательным.
Интраоперационная лучевая терапия
Интраоперационная лучевая терапия может проводиться на саму опухоль, если она не удаляется, на ложе опухоли после ее удаления или на зоны регионарного метастазирования. Этот вид лечения требует специального оборудования и применяется достаточно редко.
Внутриполостная лучевая терапия
Применяется при поверхностном РМП в единичных клиниках у больных, которым не подходят другие методы лечения. Источник излучения (радиоактивный радий или цезий) помещается в центр мочевого пузыря с помощью катетера Foley. Поэтому непременным условием проведения внутриполостного облучения является хорошая емкость мочевого пузыря.
Брахитерапия рака мочевого пузыря
Может применяться как самостоятельный метод лечения и в сочетании с дистанционной лучевой терапий или операцией (трансуретральной или трансвезикальной резекцией мочевого пузыря). Методика заключается во введении радиоактивных источников в опухоль или в стенку мочевого пузыря вдоль линии резекции и проведении интерстициальной лучевой терапии. Наиболее распространена техника с имплантацией пластиковых трубок, в которые затем вводят радиоактивный источник (чаще — 192 Ir). Брахитерапия может выполняться больным с солитарными опухолями Т1–Т2 не более 5 см в диаметре, которые способны перенести надлобковую цистотомию.
По данным ряда авторов, применение интерстициальной лучевой терапии в сочетании с дистанционным облучением позволяет добиться 75% 5-летней выживаемости при частоте рецидивов 15–20%.
Ретроспективное изучение результатов ТУР и ТУР с интерстициальной лучевой терапией показало значительное уменьшение частоты рецидивов, прогрессии, отдаленных метастазов и улучшение отдаленных результатов в группе больных, получавших интерстициальную лучевую терапию.
При низкодифференцированных опухолях (G3) доля рецидивов после ТУР составляла 88%, а после ТУР с интерстициальным облучением — 16%.
5-летняя выживаемость больных РМП в стадии Т2а, получавших интраоперационную или интерстициальную лучевую терапию, составляла 55–60%, а безрецидивная выживаемость 20–25%.
Таким образом, лучевая терапия остается одним из основных методов лечения больных инвазивным РМП. У тщательно отобранных больных этот метод позволяет добиться регрессии опухоли, обеспечивает длительный безрецидивный период и сохраненную функцию мочевого пузыря.
Химиотерапия при раке мочевого пузыря
Широкое применение при системной химиотерапии переходноклеточного РМП нашли следующие химиопрепараты.
Метотрексат — антиметаболит, входит в комбинации химиопрепаратов CMV и M-VAC.
Цисплатин — алкилирующее средство, входит в комбинации химиопрепаратов CMV, M-VAC, CAP, GC.
Доксорубицин — противоопухолевый антибиотик антрациклинового ряда, входит в состав комбинаций M-VAC, CAP.
Винбластин — противоопухолевое средство растительного происхождения, входит в состав комбинаций M-VAC, CMV.
Циклофосфамид — алкилирующее средство входит в состав комбинации CAP (CISCA).
Гемцитабин — антиметаболит, входит в комбинацию GC, трехкомпонентные комбинации 2-й линии химиотерапии.
Таксаны — паклитаксел, доцетаксел; применяются в схемах химиотерапии 2-й линии.
Системная химиотерапия при РМП стала бурно развиваться в 80-е гг. ХХ в. и применялась первоначально при диссеминированных опухолях. После того как была доказана эффективность метотрексата и других противоопухолевых агентов, таких как доксорубицин, цисплатин, винбластин, настала очередь применения комбинаций этих препаратов. Были разработаны схемы химиотерапии, основными из которых являлись CMV (цисплатин + метотрексат + винбластин), CISCA (цисплатин + доксорубицин + циклофосфамид), M-VAC (метотрексат + винбластин + доксорубицин + цисплатин). Наибольшая эффективность была отмечена при применении режима M-VAC: объективный эффект был зарегистрирован у 72% больных, причем у 36% — полная ремиссия. Результаты лечения были лучше у больных с метастазами в лимфатические узлы, чем у больных с висцеральными метастазами. У больных с полной регрессией опухоли отмечалась длительная выживаемость.
В последующем было проведено рандомизированное исследование по сравнению эффективности двух режимов химиотерапии: CISCA и M-VAC. Полная и частичная регрессия опухоли отмечалась в 65% при использовании режима M-VAC и в 46% — при применении схемы CISCA (р<0,05). Средняя выживаемость была 11,2 мес и 8,4 мес после применения M-VAC и CISCA соответственно. Таким образом, схема M-VAC подтвердила свое преимущество перед другими видами комбинированной химиотерапии и до последнего времени считалась основным режимом при лечении больных распространенным уротелиальным раком мочевого пузыря.
Успехи химиотерапии диссеминированных уротелиальных опухолей привели к тому, что она стала применяться при местнораспространенном РМП в качестве неоадъювантного и адъювантного лечения.
Неоадъювантная химиотерапия
Задачи:
1) уменьшение размеров или понижение стадии опухоли;
2) повышение абластичности операции и увеличение резектабельности опухоли;
3) воздействие на микрометастазы.
При проведении неоадъювантной химиотерапии возникает возможность определения чувствительности опухоли к противоопухолевым агентам in vivo. Это очень важный момент, т.к. он позволяет своевременно сориентироваться относительно дальнейшего лечения больного. В тех случаях, когда химиотерапия оказалась неэффективной, больному предлагается цистэктомия. Если же после проведения двух курсов лечения отмечается значительное уменьшение опухоли (более 50%), то может быть продолжена химиотерапия до полной регрессии или добавлена лучевая терапия. Предполагая, что “ответ” микрометастазов будет таким же, как и первичной опухоли, можно надеяться на улучшение результатов лечения. Раннее начало лечения микрометастазов повышает возможности химиотерапии, т.к. препараты воздействуют на малые объемы наиболее активной части клеток. Наконец, при полной регрессии новообразования появляется возможность сохранить мочевой пузырь.
Наряду с вышеперечисленными достоинствами, неоадъювантная химиотерапия имеет и определенные недостатки:
— во-первых, не все больные нуждаются в химиотерапии по поводу микрометастазов;
— во-вторых, используемая комбинированная химиотерапия достаточно токсична, наблюдаются летальные исходы от осложнений лечения;
— в-третьих, если неоадъювантная химиотерапия будет неэффективна, упускается время для выполнения радикальной операции.
Оценка эффекта неоадъювантной химиотерапии является наиболее сложным моментом. Несмотря на применение самых современных методов исследования (КТ, МРТ), ошибка достигает 30–40%. По данным ГУ РОНЦ им. Н.Н. Блохина РАМН, у 75% больных с клинически полной регрессией опухоли, которым была произведена цистэктомия, гистологически находили опухолевые клетки в толще стенки мочевого пузыря, т.е. достижение клинически полной регрессии не говорит об излечении больного. Поэтому большинство специалистов выполняют цистэктомию даже больным с клинически полной регрессией опухоли.
Результаты применения неоадъювантной химиотерапии противоречивы. Некоторые авторы сообщают об улучшении отдаленных результатов лечения, другие показывают, что улучшение касается только больных с поздними стадиями заболевания — Т3 — Т4, третьи не отмечают преимущества в выживаемости больных, получавших предоперационную терапию, по сравнению с теми, кому было проведено только хирургическое лечение. Существует мнение, что неоадъювантная химиотерапия лишь разделяет больных на пациентов с хорошим прогнозом (тех, кто достиг полной регрессии опухоли) и плохим прогнозом (пролеченные с частичным эффектом или без эффекта).
Адъювантная химиотерапия
Проводится больным с высоким риском развития рецидива после радикальной операции. К факторам, повышающим вероятность рецидива, относят:
— гистологически подтвержденные метастазы в удаленных регионарных лимфатических узлах;
— опухолевую инфильтрацию паравезикальной клетчатки;
— инвазию опухоли в лимфатические или кровеносные сосуды.
Положительное качество адъювантной химиотерапии в том, что она воздействует на предполагаемые микрометастазы; минимальный объем опухоли создает наиболее благоприятные условия для достижения положительного результата. Кроме того, химиотерапия проводится после операции, и в случае ее неэффективности не теряется время до радикального хирургического лечения, как это может быть при проведении неоадъювантной химиотерапии. Основным недостатком послеоперационной химиотерапии является отсутствие контроля за ее эффективностью. Предполагается, что часть пациентов получают заведомо неэффективную терапию, которая может привести к нежелательным последствиям.
Было проведено несколько проспективных контролируемых исследований по изучению эффективности адъювантной химиотерапии. В исследование Skinner и соавт. включали больных, которым была произведена цистэктомия по поводу местнораспространенного РМП (рТ3 — pT4, pN+). Применялась комбинации химиопрепаратов CISCA. Проводили 3–4 курса послеоперационной химиотерапии. Только 61% больных смогли перенести запланированную терапию. Контрольную группу составили пациенты, не получавшие лечения после операции. Средняя выживаемость в группе химиотерапии была 4,3 года, а в контрольной группе — 2,4 года. Послеоперационная химиотерапия позволила увеличить безрецидивный период на 14 мес. Однако различие результатов было недостоверным.
В исследовании Stockle и соавт. у больных РМП рТ3-pT4а pN1-pN2 для адъювантной химиотерапии применяли схему M-VAC; 69% больных получили 2–3 курса химиотерапии. В контрольной группе лечения после цистэктомии не проводили. При среднем сроке наблюдения 24 мес рецидив заболевания выявлен у 17% больных, получавших послеоперационное лечение, и у 78% — в контрольной группе. Достоверных различий в общей выживаемости не получено, хотя безрецидивная выживаемость была выше в группе химиотерапии.
Единого мнения об эффективности адъювантной химиотерапии не существует. Некоторые авторы считают, что она позволяет улучшить отдаленные результаты лечения в группе больных с высоким риском развития рецидива — в среднем на 20–30%. Однако вопрос о целесообразности адъювантного лечения и о сроках его проведения остается предметом исследований.
Лечение диссеминированного РМП
Ведущее место в лечении диссеминированного РМП занимает химиотерапия.
Как уже упоминалось, наиболее эффективной схемой химиотерапии при переходноклеточном РМП до последнего времени являлась комбинация М-VAC, применение которой позволяло получить объективный эффект у 60–70% больных с частотой полных регрессий 30–35%. Применение данной комбинации связано с существенной токсичностью (развитие нейтропении и инфекционных осложнений на ее фоне; выраженные мукозиты, вызывающие трудности в приеме пищи, и диарея), которая ухудшает общее состояние больного, приводя к потере веса, слабости. Кроме того, наблюдаются тошнота и рвота, почечная, кардиальная и неврологическая токсичность. Несмотря на успехи химиотерапии при диссеминированных опухолях, средняя продолжительность жизни составляет около 1 года, длительная выживаемость наблюдается лишь у 15–20% больных. Менее 5% пациентов переживают 5 лет. Поэтому требовалось создание новых подходов к лечению, которые могли бы снизить токсичность терапии и улучшить отдаленные результаты.
1) Увеличение доз химиопрепаратов с одновременным применением КСФ. EORTC (European Organisation for Research and Treatment of Cancer) было проведено рандомизированное исследование, в котором сравнивались стандартный режим M-VAC и высокодозный M-VAC на фоне применения Г-КСФ. Исследование показало, что в группе больных, получавших высокодозный режим, уменьшилась частота мукозитов и проявлений миелотоксичности, однако доля объективных ремиссий и продолжительность жизни была одинаковой в обеих группах (Sternberg C.N. et al., 2000). В настоящее время высокодозный режим M-VAC не рекомендован в качестве стандартного лечения.
2) Новые режимы и схемы лечения стали изучаться в связи с появлением новых химиопрепаратов. Одним из наиболее перспективных является гемцитабин — противоопухолевый агент из группы антиметаболитов, который показал высокую активность у больных переходноклеточным РМП. При применении гемцитабина в монотерапии объективный эффект наблюдался у 22,5–28% больных переходноклеточным РМП, а в комбинации с цисплатином — у 42–66%.
Высокая эффективность и хорошая переносимость комбинации гемцитабина с цисплатином сделали возможным начать ее сравнение со стандартной схемой M-VAC. К настоящему времени закончено крупное рандомизированное мультинациональное мультицентровое исследование в рамках III фазы. В исследовании приняло участие 405 пациентов с IV стадией РМП, которые до этого не получали химиотерапии. В первую группу вошло 203 больных (гемцитабин + цисплатин — схема GC), во вторую 202 больных (схема M-VAC). Общая выживаемость, время до прогрессирования, прогрессирование на фоне лечения, количество ремиссий (49% при применении комбинации GC и 46% — при использовании режима M-VAC) были одинаковы в обеих группах. Однако проявления токсичности были меньше, и переносимость была лучше при лечении по схеме GC. Кроме того, при лечении по этой схеме в меньшей степени использовались вспомогательные средства и поддерживающие препараты (переливание крови, антиэметики, анальгетики) (Von der Maase H. et al., 2000).
Таким образом, лечение по схеме GC оказалось более безопасным и является альтернативой режиму M-VAC при местнораспространенном и диссеминированном РМП. Схему GC можно использовать в качестве стандартного лечения этих больных.
Другой класс противоопухолевых препаратов представляют таксаны. Применение доцетаксела больным метастатическим уротелиальным раком в качестве химиотерапии 1-й линии привело к объективной ремиссии у 31% больных. Однако использование доцетаксела больным, ранее получавшим химиотерапию другими препаратами, позволило добиться ответа лишь у 13% пациентов (de Wit R. et al., 1998; McCaffrey J.A. et al., 1997).
Применение паклитаксела в комбинации с метотрексатом и цисплатином привело к объективной регрессии опухоли у 40% больных, ранее получавших химиотерапию M-VAC. В дальнейшем были изучены сочетания паклитаксела с цисплатином, карбоплатином, однако наиболее перспективным оказалось введение паклитаксела в комбинацию гемцитабина с цисплатином (Tu S.M. et al., 1995; Bellmunt J. et al., 2000).
В исследовании приняли участие ранее не леченные пациенты с местнораспространенным или метастатическим РМП, имеющие измеряемые проявления заболевания. Цисплатин вводили в 1 день в фиксированной дозе — 70 мг/м2. Паклитаксел и гемцитабин вводились в 1 и 8 дни с эскалацией доз. Всего проводилось до 6 курсов химиотерапии с интервалом 3 нед. В исследование был включен 61 больной, в т.ч. 15 — в I фазе. Дозолимитирующей токсичностью оказалась астения. Для II фазы исследования рекомендован паклитаксел — 80 мг/м2 и гемцитабин — 1000 мг/м2. Данный режим в окончательном виде получили 49 пациентов. Основной негематологической токсичностью была астения 2 степени у 18 больных, с ранним появлением у 5 из них, и астения 3 степени у 4 пациентов. Нейтропения и тромбоцитопения 3–4 степени наблюдались у 27 (55%) и 11 (22%) больных соответственно. Фебрильная нейтропения зафиксирована у 11 больных, и 1 пациент умер от нейтропенического сепсиса. Комбинация показала себя активной при всех дозовых уровнях. Эффект оценен у 58 из 61 пациента. Достигнуто 16 (27,6%) полных и 29 (50%) частичных эффектов, общая эффективность терапии составила 77,6% (60–98% при 95% доверительном интервале). Медиана выживаемости известна только у больных из I фазы исследования и составила 24 мес. Авторы делают вывод, что комбинация паклитаксела, цисплатина и гемцитабина показала себя безопасной и высокоэффективной (Bellmunt J. et al., 2000).
Таблица 9
Схемы химиотерапии и иммунотерапии
при поверхностном РМП
| Препарат | Режим введения |
| Тиотепа | Внутрипузырно в разовой дозе от 20 до 60 мг, которые растворяются в 50 мл физиологического раствора; удерживается в мочевом пузыре в течение 1 ч. Вводится 1 — 2 раза в неделю, суммарно не более 240-300 мг на курс лечения |
| Эпирубицин | Внутрипузырно — 30-50 мг препарата растворяют в 30-50 мл дистиллированной воды или физиологического раствора; удерживается в мочевом пузыре в течение 1 ч. Инстилляции проводятся 1 раз в неделю в течение 8 нед |
| Доксорубицин | Внутрипузырно — 30-50 мг препарата растворяют в 30-50 мл дистиллированной воды или физиологического раствора; удерживается в мочевом пузыре в течение 1 ч. Инстилляции проводятся 1 раз в неделю в течение 8 нед |
| Митомицин | Внутрипузырно — 30-40 мг препарата растворяют в 30-40 мл дистиллированной воды или физиологического раствора; удерживается в мочевом пузыре в течение 1 ч. Инстилляции проводятся 1 раз в неделю в течение 8 нед |
| Митомицин | Внутрипузырно — 40 мг препарата растворяют в 40 мл дистиллированной воды или физиологического раствора; вводят однократно в течение 24 ч после ТУР |
| Вакцина БЦЖ | Внутрипузырно в разовой дозе 100-120 мг 1 раз в неделю. Препарат растворяется в 50 мл физиологического раствора. Удерживается в мочевом пузыре в течение 2 ч. Индукционный курс состоит из 6 еженедельных инстилляций. Инстилляции начинаются не ранее чем через 3-4 нед после ТУР. После завершения индукционного курса возможна поддерживающая терапия в той же дозе 1 раз в 3 месяца до 2 лет |
| Интерферон альфа-2б (препарат Интрон А) | Внутрипузырно в разовой дозе от 10 до 100 млн МЕ. Препарат растворяется в 50 мл физиологического раствора. Вводится в мочевой пузырь 1 раз в неделю на 1 ч в течение 12 нед, затем ежемесячно до 1 года |
| Интерферон альфа-2б (препарат Интрон А) | Внутрипузырно в разовой дозе 3 или 6 млн МЕ. Препарат растворяется в 50 мл физиологического раствора. Ежедневно проводятся 2 внутрипузырных инстилляции на 3 ч каждая. Проводят 5 трехдневных курсов лечения с интервалом между курсами 3 нед |
| Интерлейкин-2 человека рекомбинантный | Внутрипузырно. Разовая доза 1 млн МЕ растворяется в 50 мл физиологического раствора. Ежедневно проводятся 2 внутрипузырных инстилляции на 3 ч каждая. Проводят 5 четырехдневных курсов лечения с интервалом между курсами 3 нед |
Hussain M. et al. (2001) изучили эффективность комбинации паклитаксела, карбоплатина и гемцитабина у 49 больных распространенным уротелиальным раком, не получавших ранее химиотерапии. Лечение проводилось по схеме: паклитаксел — 200 мг/м2 в 1 день, карбоплатин — AUC–5 в 1 день и гемцитабин — 800 мг/м2 в 1 и 8 дни. У 43 больных был переходноклеточный, а у 6 — плоскоклеточный или смешанный рак. Всего проведено 272 курса химиотерапии, в среднем каждый больной получил по 6 курсов (от 1 до 15). Основной токсичностью оказалась гематологическая: нейтропения 3–4 степени (у 17 и 19 больных соответственно), тромбоцитопения 3 степени — у 15 больных, 4 степени — у 6, анемия 3 и 4 степени зарегистрирована у 10 и 2 больных соответственно. Периферическая нейропатия 3 степени отмечена у 4 больных, диарея — у 2 больных. Частота фебрильной нейтропении составила 1,4%, летальных исходов вследствие токсичности отмечено не было. Оценить эффективность лечения удалось у 47 больных из 49. У 15 пациентов (32%) отмечена полная регрессия заболевания, у 17 (36%) — частичная регрессия. Объективный эффект встречался при всех локализациях опухоли, в т.ч. у 15 (68%) из 22 больных с висцеральными метастазами. Средняя продолжительность жизни составила 14,7 мес, 1 год прожили 59% больных. Таким образом, комбинация паклитаксела, карбоплатина и гемцитабина показала высокую эффективность при лечении больных распространенным раком уротелия.
Дальнейшие перспективы лекарственной терапии РМП связаны с разработкой режимов химиотерапии 2-й линии, преодолением механизмов резистентности опухоли.
Основные схемы и режимы лекарственной терапии РМП приведены в таблицах 9 и 10.
Таблица 10
Схемы химиотерапии при диссеминированном
и местно-распространенном РМП
| Комбинация | Лекарственное средство, доза и режим лечения |
| CISCA | Цисплатин — 70 мг/м2 в/в капельно в 1 день, Доксорубицин — 40 мг/м2 в/в в 1 день, Циклофосфамид — 400 мг/м2 в/в в 1 день |
| CMV | Цисплатин — 100мг/м2 в/в капельно во 2 день, Метотрексат — 30 мг/м2 в/в в 1 и 8 дни, Винбластин — 4 мг/м2 в/в в 1 и 8 дни |
| M-VAC | Метотрексат — 30 мг/м2; в/в в 1, 15 и 22 дни, Винбластин — 3 мг/м2; в/в во 2, 15 и 22 дни, Доксорубицин — 30 мг/м2; в/в во 2 день, Цисплатин — 70 мг/м2; в/в капельно во 2 день |
| M-VЕC | Метотрексат — 30 мг/м2 в/в в 1, 15 и 22 дни, Винбластин — 3 мг/м2 в/в во 2, 15 и 22 дни, Эпирубицин — 50 мг/м2 в/в во 2 день, Цисплатин — 70 мг/м2 в/в капельно во 2 день |
| GC | Гемцитабин — 1000 мг/м2 в/в капельно в 1, 8 и 15 дни, Цисплатин — 70-100 мг/м2 в/в капельно в 1 или 2 день |
| Цисплатин + Паклитаксел + Гемцитабин | Цисплатин — 70 мг/м2 в/в капельно в 1 день, Паклитаксел — 80 мг/м2 в/в капельно в 1 и 8 дни, Гемцитабин — 1000 мг/м2 в/в капельно в 1 и 8 дни |
| Паклитаксел + Карбоплатин + Гемцитабин | Паклитаксел — 200 мг/м2 в 1 день в/в капельно, Карбоплатин — AUC-5 в 1 день в/в капельно, Гемцитабин — 800 мг/м2 в 1 и 8 дни в/в капельно |
Литература
Давыдов М.И. и др. Злокачественные новообразования в России и странах СНГ в 2000 г.— М., 2002.
Матвеев Б.П. и др. Рак мочевого пузыря.— М., 2001.
Schatte E. et al. Epidemiology of bladder cancer/Comprehensive textbook of Genitourinary Oncology. Eds N.J. Vogelzang et al.— 2nd ed.— Lippincott Williams and Wilkins, Philadelphia, 2000.— Ch. 16.— P. 282–288.
Mostofi F.K., Davis C.J., Sesterhenn I.A. in collaboration with Sobin L.H. and pathologists in 10 countries. Histological typing of urinary bladder tumours/World Health Organization, International Histological Classification of tumours.— 2nd ed.
UICC International Union Against Cancer. TNM classification of malignant tumours/Ed. by L.H. Sobin et al.— 5th ed.— 1997.— P. 187–190.
Boman H. et al. ...J. Urol.— 2002.— V. 168 (5).— P. 1955–1959.
Tolley D.A. et al. ...J. Urol.— 1996.— V. 155 (4).— P. 1233–1238.
Oosterlinck W. et al. ...Europ. Urol.— 2002.— V. 41 (2).— P. 105–112.
Lamm D.L. ...Anti-Cancer Drugs.— 1992.— V. 3 (1).— P. 39–47.
Sylvester R.J. et al. ...J. Urol.— 2002.— V. 168 (5).— P. 1964–1970.
Rischmann P. et al. ...Eur. Urol.— 2000.— V. 37 (suppl. 1).— P. 33–36.
Benson M.C. et al. ... Campbell’s Urology. /Ed. by Patrick C. Walsh et al.— 6th ed.— 1992.— V. 3.— Ch. 72.— P. 2654–2720.
Sengelov L. et al. ...Radiother.Oncol.— 1999.— V. 52.— P. 1–14.
Rose M.A. et al. ...Raghaven D. (ed.) The management of bladder cancer. — London, Edward Arnold Ltd., 1988.— P. 154–173.
Parsons J.T. et al. ...Seminars in oncology.— 1990.— V. 17.— P. 566–582.
Sternberg C.N. et al. ...Cancer.— 1989.— V. 64.— P. 2448–2458.
Skinner D.G. et al. ...J. Urol.— 1991.— V. 145.— P. 459–464.
Stockle M. et al. ...J. Urol.— 1992.— V. 148.— P. 302–307.
Von der Maase H. et al. ...J. Clin. Oncol.— 2000.— V. 17.— P. 3068–3077.
Bellmunt . et al. ...J. Clin. Oncol.— 2000.— V. 18.— P. 3247–3255.
Hussain M. et al. ...J. Clin. Oncol.— 2001.— V. 19.— P. 2527–2533.
Описание проверено экспертом
Оцените статью:
- Рак мочевого пузыря
- Злокачественная опухоль мочевого пузыря
- Карцинома мочевого пузыря
- Опухоль мочевого пузыря
- Рак мочевого пузыря поверхностный
- Злокачественные новообразования мочевого пузыря
- Метастатический рак мочевого пузыря
- Переходноклеточный рак мочевого пузыря
- Опухоли мочевого пузыря
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).




