- Клинико-патологические особенности вторичных опухолей печени
- Диагностика вторичных опухолей печени
- Лечение и прогноз у больных вторичными опухолями печени
- Лечение по поводу метастазов колоректального рака в печень
-
Локальное аблативное и циторедуктивное лечение метастазов колоректального рака в печень
- Внутрисосудистое чрескатетерное лечение метастазов колоректального рака в печень
- ЭПА
- ХИПА
- ХЭПА
- МХЭПА
- Сочетание МХЭПА и МХЭВВ
- Внутриартериальная радиоэмболизация радиоактивным 90Y
- Системное лекарственное лечение больных метастазами колоректального рака в печень
- Комбинированное хирургическое и чрескатетерное внутрисосудистое лечение
-
Лечение неколоректальных метастазов в печень
- Хирургическое лечение
- Различные методы и виды локального циторедуктивного лечения больных с неколоректальными метастазами в печени (методики рассмотрены выше)
- Внутрисосудистое чрескатетерное (рентгеноэндоваскулярное) лечение
- Системное лекарственное лечение больных c метастазами неколоректального рака в печень
- Комбинированное лечение больных с метастазами неколоректального рака в печень (применяемые варианты комбинированного лечения)
C78.7 Вторичное злокачественное новообразование печени, МКБ-10
Отредактировано: 02.04.2024
Клинико-патологические особенности вторичных опухолей печени
Считается, что общее число больных с метастазами в печень составляет приблизительно одну треть от количества всех больных злокачественными опухолями. В России ежегодно выявляют около 450 тыс. новых больных злокачественными опухолями. У значительной части из них уже имеются метастазы в печени, у других пациентов метастазы в печени будут выявлены в разные сроки после установления диагноза злокачественного новообразования. Количество всех больных с метастазами в печени в России составляет более 100 тыс. человек, что в десятки раз превосходит количество всех больных первичными злокачественными опухолями печени и внутрипеченочных желчных протоков. Вообще, из всех больных с опухолевым поражением печени на долю страдающих от метастазов приходится 95%. Если учесть в целом плохой прогноз при метастазах в печени, то метастатический рак печени — чрезвычайно значимая медицинская и социально-экономическая проблема.
Наиболее частые локализации первичной опухоли при метастазах в печень: толстая кишка, легкие, желудок, поджелудочная железа, молочная железа. Более редкие локализации первичных опухолей, метастазирующих в печень, — желчевыводящие пути, пищевод, яичники, меланома, предстательная железа, почки. Наиболее значимый путь метастазирования — портальная эмболия опухолевых клеток в печень. При этом процесс метастазирования сложнее, чем просто механическое поступление опухолевых клеток в печень с током крови. Макроскопические характеристики метастатических опухолей печени в целом повторяют таковые первичных опухолей — источников метастазирования в печень. Для большинства метастазов в печень аденокарциномы пищеварительного тракта, молочной железы, легкого характерны сóлидные плотные белесоватые узлы неправильной или округлой формы. Метастазы рака яичников в печень представлены чаще множественными белесоватыми очагами с четкими контурами, кистозного или сóлидно-кистозного строения и мягкой консистенции. Консистенция опухоли вообще зависит от ряда факторов, среди которых основные — соотношение опухолевой паренхимы и фиброзной стромы, степень кровоснабжения, наличие зон некроза, сóлидная или кистозная структура образования, степень выраженности фиброза в прилежащей к опухоли ткани печени и другие. Метастазы светлоклеточного рака почки, как правило, имеют четкие контуры, светло-коричневый цвет и практически неотличимы по консистенции от печени. Метастазы эндокринноклеточных опухолей имеют четкие контуры, разный цвет (от темно-коричневого до светло-желтого), сóлидное строение, не намного более плотную консистенцию по сравнению с паренхимой не пораженной циррозом печени.
Чаще гематогенные метастазы поражают правую долю печени.
Гистологическое строение метастазов в печени
Чаще всего повторяет гистологическое строение первичных опухолей. В ряде случаев метастазы отличаются от первичных опухолей степенью дифференцировки опухолевых клеток, что затрудняет установление оргáнной принадлежности первичной опухоли. Трудно различимыми могут оказаться патолого-анатомические данные первичных и метастатических опухолей печени, имеющих схожий гистогенез. Например, холангиоцеллюлярного рака печени и метастазов в печень аденокарциномы толстой кишки. Иммуногистохимические исследования с использованием МКА к цитокератинам 7 и 20 помогают в уточнении органной принадлежности и гистогенеза этих опухолей. Опухолевым клеткам холангиокарцином свойственна экспрессия цитокератина 7 и цитокератина 20 в 96% и 70% случаев соответственно, чего не наблюдается при метастазах колоректального рака.
Классификация метастатического поражения печени по Gennari L. с соавт. (1982, 1984)
В классификации осуществлена попытка определить прогноз в зависимости от распространенности поражения. Все больные делятся на четыре группы в соответствии со стадиями. Классификация рассматривает следующие признаки.
H (объем опухоли):
Н1 — менее 25% печени;
Н2 — 25–50%;
Н3 — более 50% печени.
S — одиночный узел, m — множественные узлы, b — билобарное поражение, I — инфильтрация соседних органов и тканей, f — нарушение функции печени, A — небольшое внепеченочное поражение, B — значительное внепеченочное распространение рака.
I стадия — H1 s (5-летняя выживаемость после резекции печени — 20–42%);
II стадия — H2 s, H1 m, b (средняя выживаемость после резекции — 10–14 мес, рецидив возникает у большинства больных);
III стадия — H2 m, b, или H3 s, m, b, I (прогноз после резекции плохой из-за развития рецидива в печени у 100% оперированных);
IV стадия — то же, что и при III стадии, + A или B (неоперабельные больные, хотя при A прогноз несколько лучше).
Как правило, метастатические опухоли в печени редко наблюдаются у больных циррозом печени. Это можно объяснить плохими условиями для фиксации и размножения опухолевых клеток в цирротически измененном органе.
Метастатический рак печени в целом характеризуется быстрым прогрессированием и отсутствием специфической клинико-лабораторной симптоматики. Нарастающая слабость, ухудшение аппетита, похудание, неинтенсивные давящие боли в эпигастральной области, увеличенная печень, эпизоды повышенной температуры тела у больных с метастазами в печени — свидетельствуют, как правило, о значительном поражении печени, вовлечении обеих долей. Частота отдельных симптомов при изолированном метастатическом поражении печени: боли в правом подреберье — у 72% больных, гепатомегалия — у 22%, общая слабость — у 36%, похудание — у 18%, повышение температуры тела до 38 °С — у 2%, сочетание общей слабости, похудания и субфебрильной температуры — у 18% пациентов (Комаров И.Г. и Комов Д.В., 2002).
Представляется обоснованным деление всех больных с метастазами в печени на две группы независимо от источников метастазирования (Шалимов А.А. с соавт., 1993):
1) больные с солитарными и единичными метастазами в печени;
2) больные с множественными метастазами в печени.
Под единичными метастазами следует понимать два или три метастаза. Более трех метастазов считаются множественными.
У пациентов первой группы симптомы заболевания в определенной степени напоминают проявления массивной формы ПРП. У небольшого числа пациентов пальпируется опухоль печени и отмечаются тупые давящие боли в правом подреберье. Естественно, указанные симптомы отмечаются при значительных размерах опухоли.
У пациентов второй группы локальные и общие симптомы более выражены. Клиническая картина характеризуется нарастающей печеночной недостаточностью и осложнениями в виде механической желтухи, некроза опухолевых узлов и их разрыва других проявлений. Отек нижних конечностей и расширение вен передней стенки живота свидетельствуют о сдавлении НПВ. У 30% больных уже в момент установления диагноза имеется асцит. Асцит отражает вовлечение в процесс брюшины, в редких случаях — тромбоз воротной вены. Деление больных с метастазами в печени на две вышеуказанные группы в действительности отражает индивидуальные биологические особенности конкретной опухоли и иммунобиологические особенности организма больного человека. Это, в свою очередь, позволяет выделять больных — кандидатов на хирургическое удаление метастазов в печени. Таковыми, прежде всего, являются больные с солитарными и единичными метастазами в печени.
Диагностика вторичных опухолей печени
Как и при первичных злокачественных опухолях печени и внутрипеченочных желчных протоков, только доклиническая диагностика метастазов в печени позволяет надеяться на более или менее удовлетворительные результаты лечения. Онкологические больные, у которых метастазы в печени обнаруживаются при инструментальном обследовании спустя разное время после лечения по поводу первичной опухоли, то есть больные метахронными метастазами, имеют лучший прогноз по сравнению с пациентами, у которых метастазы в печени выявлены синхронно с обнаружением первичной опухоли или во время лечения по поводу первичной опухоли. Лабораторный и инструментальный мониторинг больных, получавших ранее лечение по поводу злокачественных новообразований, позволяет относительно рано выявлять метастазы в печени и проводить соответствующее лечение. Немалое значение у таких больных играет определение в крови повторного повышения концентрации соответствующих иммунохимических и активности биохимических онкомаркеров, уровень концентрации и активности которых ранее снижался в результате проводимого лечения, например, удаления первичной опухоли.
К основным иммунохимическим онкомаркерам относятся: АФП — при метастазах печеночноклеточного рака, герминогенных опухолях яичка и яичников, гепатобластоме; РЭА — у 50–90% больных с метастазами рака органов пищеварения и дыхания, у 30–50% больных при метастазах рака молочной железы; СА 19–9 — у больных с метастазами рака поджелудочной железы, рака внутри- и внепеченочных желчных протоков, большого дуоденального сосочка, желчного пузыря; СА 15–3 — у больных с метастазами рака молочной железы; СА 125 — у большинства больных с метастазами серозной карциномы яичников; SCC — у 80% больных с метастазами плоскоклеточного рака шейки матки, у 60% больных с метастазами плоскоклеточного рака носоглотки и уха, у 31% больных с метастазами плоскоклеточной карциномы легких; NSE — у больных МРЛ, у больных с метастазами опухолей нейроэктодермального и нейроэндокринного происхождения, при нейробластоме; ХГ — у больных с метастазами герминогенных опухолей гонад, при гепатобластоме, у 14% больных раком легкого, у 60% больных с метастазами рака органов пищеварительного тракта, у 30% больных с метастазами рака органов мочеполовой системы; ПСА — у больных с метастазами рака предстательной железы.
К основным биохимическим маркерам метастатического поражения печени относятся: ЩФ; ЛДГ; гамма-ГТ. Если концентрация в сыворотке билирубина, а также активность гамма-ГТ, ЩФ, ЛДГ, трансаминаз в норме, то вероятность отсутствия метастазов в печени составляет 98% (Белохвостов А.С., Румянцев А.Г., 2002; Шерлок Ш., Дули Дж., 1999).
При обследовании больных, у которых подозреваются метастазы в печени, целесообразно решить диагностические задачи двух групп аналогичные тем, что решаются при первичных злокачественных опухолях печени (см. выше).
Возможности применения УЗИ в диагностике вторичных опухолей печени, как, впрочем, и других лучевых методов, в значительной степени основываются на множественности очагов, их размерах, выявляемой тенденции к быстрому росту и появлению новых фокусов в печеночной ткани. При этом каждый специалист-лучевой диагност должен учитывать данные анамнеза, иммунохимического и биохимического исследования крови на соответствующие онкомаркеры, результатов ПБ и других методов исследования. Прямой корреляции между эхогенностью и гистогенезом метастазов не установлено. Эхогенность вторичных опухолей печени очень полиморфна и зависит от многих факторов, в частности, от размеров очагов. В крупных очагах нередко выявляются гипоэхогенные участки, свидетельствующие о распаде опухолевых узлов. Для метастазов в печень аденокарциномы различных органов пищеварительной системы более характерны гиперэхогенные очаги и очаги неоднородной акустической структуры. Напротив, для метастазов меланомы более характерны гипоэхогенные акустические фокусы в печени. Наиболее сложны для интерпретации множественные мелкие гипоэхогенные очаги на фоне дистрофии печени. В целом УЗИ позволяет дифференцировать от окружающей ткани печени очаги размерами уже 2–3 мм. Применение ЦДК и эхоконтрастирования в выявлении метастазов в печени, их локализации, связи с крупными сосудами и протоками печени, делает УЗИ методом диагностики, позволяющим решить большинство диагностических задач. Интраоперационное УЗИ позволяет выявить дополнительные непальпируемые метастазы в печени, обнаружить в паренхиме печени соответствующие ветви воротной вены и печеночных вен для их транспаренхиматозной обработки, обеспечить интраоперационное применение методов локального аблативного и циторедуктивного воздействия на метастазы в толще паренхимы печени.
Диагностика метастазов с помощью РКТ не более эффективна, чем с помощью УЗИ. Специфичность РКТ-признаков меньше, чем при исследовании первичных опухолей печени, негомогенность очагов, широкий разброс денситометрических показателей — 10–45 ед.Н., наличие ободков пониженной плотности, нечеткие контуры, множественность очагов в печени. Наличие кальцинатов наиболее характерно для метастазов колоректального рака и остеосаркомы. Также трудны для выявления мелкие субкапсулярные метастазы. При нативной РКТ не выявляются метастазы размерами менее 1 см, а также более крупные очаги, изоденсивные окружающей печеночной ткани. Значимым дифференциально-диагностическим симптомом, отличающим метастазы от доброкачественных образований печени, является нечеткость контуров метастазов. Внутривенное усиление позволяет улучшить визуализацию метастазов только у части больных (при печеночноклеточном раке, раке почки, эндокринноклеточных опухолях, хорионэпителиоме, меланоме), то есть при метастазах в печень высококровоснабжаемых опухолей. Спиральная РКТ с болюсным контрастированием позволяет сканировать печень в период, когда изображения метастазов, в большинстве своем получающие артериальное кровоснабжение, выглядят “усиленными”. Благодаря этому чувствительность в выявлении очагов более 1 см достигает 90%, при очагах менее 1 см — 50%. Спиральная динамическая РКТ с болюсным усилением также наиболее эффективна при метастазах в печень высококровоснабжаемых опухолей за счет их гиперденсивности в артериальной фазе контрастирования.
Вместо РКТ может быть выполнена МРТ. Для метастазов рака колоректальной локализации характерны низкая интенсивность сигнала на T1-взвешенных изображениях, умеренная и высокая интенсивность сигнала на T2-взвешенных изображениях. Это позволяет при трактовке МРТ-грамм отличать метастазы рака колоректальной локализации от доброкачественных образований печени. МРТ — лучший метод неинвазивной визуализации печеночных вен и НПВ. Магнитно-резонансная холангиография — неинвазивная методика исследования билиарного дерева, позволяющая представить взаимоотношения опухоли и крупных протоков печени. Использование МРТ с ферритами — специфическими для печени контрастными средствами — является шагом в сторону более точного установления природы опухолей печени.
Несмотря на то что ПЭТ с 18 F-фтордезоксиглюкозой у больных с метастазами рака колоректальной локализации в печени обнаруживает высокую точность в выявлении внепеченочных метастазов, роль и место метода еще не определены (Кармазановский Г.Г. и др., 1997; Бацков С.С., 1998; Шотемор Ш.Ш., 2001; Fong Y., 1999).
ПБ
Показана при: множественном билобарном поражении печени метастазами, исключающем резекцию печени; единичных метастазах в печени у больных — кандидатов на проведение локальной циторедуктивной или иной противоопухолевой терапии; во всех случаях, когда природа очагов в печени вызывает сомнения.
АГ
При хорошо кровоснабжаемых метастазах в печени, даже при их малых рамерах — менее 1 см — метод чрезвычайно информативен: позволяет установить опухолевую природу очагов, в ряде случаев — с высокой вероятностью предположить гистогенез опухолевого поражения печени, указать точную локализацию и взаимосвязь опухоли с глиссоновыми и кавальными воротами органа, дать исчерпывающие представления о сосудистой анатомии печени. При аваскулярных метастазах, особенно локализующихся в левой полупечени, диагностические возможности метода существенно меньше.
Диагностический комплекс УЗИ + в случае необходимости, РКТ или МРТ + данные иммунохимического анализа сыворотки крови на онкомаркеры + ПБ достаточен, чтобы иметь точные представления о морфологической структуре, количестве и локализации метастазов в печени. Полученная информация позволяет далее решать комплекс вопросов, связанных с первичной опухолью, и сформировать план лечения по поводу метастатического поражения печени.
Следует отметить, что АГ целесообразна при планировании обширной резекции печени или проведении внутрисосудистого регионарного чрескатетерного лечения по поводу метастазов. Если операция и регионарное внутрисосудистое лечение не планируются или в результате обследования обнаружены множественные билобарные метастазы в печени или внепеченочные метастазы, АГ нецелесообразна.
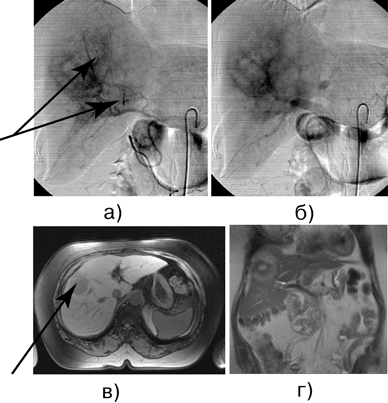
Рисунок 2. Б-ная И., 64 года. Рак прямой кишки, состояние после брюшно-промежностной экстирпации прямой кишки. Метастаз аденокарциномы прямой кишки в правую долю печени:
а — целиакография, поздняя артериальная фаза, метастатический узел в правой доле печени; б — целиакография, венозная фаза, метастатический узел в правой доле печени; в — МРТ: поперечный срез, метастатический узел в проекции V-VIII сегмента; г — МРТ: фронтальный срез, метастатический узел в проекции V-VIII сегмента.
В дальнейшем выполнена правосторонняя гемигепатэктомия
При планируемом хирургическом лечении, локальной циторедуктивной и комбинированной терапии проводится исследование функционального состояния паренхимы печени и других органов, как об этом рассказано выше в разделе, посвященном ПРП. У подавляющего большинства больных с метастазами в печени функциональный статус органа вполне удовлетворительный. Последнее уменьшает вероятность острой печеночной недостаточности после резекции печени по поводу метастазов.
Лечение и прогноз у больных вторичными опухолями печени
Классификация методов и видов лечения больных опухолями печени, данные о хирургической анатомии печени, о методах, способах резекций печени, способах предотвращения кровотечений, данные о непосредственных результатах резекций печени представлены выше в разделе, посвященном ПРП.
Лечение больных по поводу метастазов в печень имеет особенности, отличные от лечения по поводу первичных злокачественных опухолей печени и внутрипеченочных желчных протоков:
1. Резекция печени и комбинированное лечение с включением резекции печени по поводу метастазов, ввиду своего характера, являются лечением по поводу отдаленных метастазов, которые редко бывают солитарными и единичными, и показаны не более чем 10% больных с метастазами колоректального рака и не более чем 5–7% больных с метастазами неколоректального рака в печень. Одновременно хирургическое лечение по поводу первичных злокачественных опухолей печени показано относительно большему количеству пациентов — 15–30%.
2. Ввиду многократного превалирования (в десятки раз) больных с метастатическим раком печени над больными ПРП, резекций печени по поводу метастазов должно выполняться в 4–5 раз больше, чем по поводу первичного рака.
3. Гепатэктомия с трансплантацией трупной донорской печени или части печени от живого родственного донора по поводу метастатического рака печени в настоящее время не показана в силу угрозы генерализации заболевания на фоне неизбежной иммуносупрессорной терапии.
4. Переносимость однотипных резекций печени по поводу ее метастатического поражения в целом несколько лучше, чем по поводу ПРП, что связано с более низкой частотой печеночной недостаточности после операции у больных первой группы.
Ввиду биологически обусловленных особенностей рака толстой кишки и его метастазирования, больные с метастазами колоректального рака в печень выделены в отдельную группу.
Лечение по поводу метастазов колоректального рака в печень
Хирургическое лечение резекции печени по поводу ее поражения метастазами колоректального рака
Отдаленная выживаемость больных метастазами колоректального рака в печень, перенесших резекцию печени: 5-летняя выживаемость — 25–35%, медиана продолжительности жизни — 19–40 мес. При солитарном, метахронном (метастаз выявлен при очередном тщательном контрольном обследовании больного спустя не менее, чем 1 год после удаления первичной опухоли) метастазе колоректального рака в печени, отсутствии внепеченочных метастазов и рецидива заболевания, размерах метастаза не более 5 см, резекции печени на расстоянии не менее 1 см от опухоли, концентрации РЭА в крови не выше 100 нг/мл 5-летняя выживаемость среди оперированных достигает 50% и более, медиана продолжительности жизни после резекции печени — 26–59 мес. Указанные характеристики являются наиболее благоприятными с точки зрения отдаленной выживаемости больных.
В ГУ РОНЦ им. Н.Н. Блохина РАМН при метастазах колоректального рака в печень и проведении хирургического лечения обнаружены нижеследующие прогностически значимые факторы:
1) характер роста опухоли (при аппозиционном росте 5-летняя выживаемость составляет 59%, при инфильтративном — 32%);
2) наличие фиброзной капсулы опухоли (при наличии фиброзной капсулы 5-летняя выживаемость составляет 59%, без капсулы — 32%);
3) лимфоидная инфильтрация в печени вокруг опухолевого узла (при лимфоидной инфильтрации 5-летняя выживаемость составляет 58%, без лимфоидной инфильтрации составляет 26%);
4) инвазия сосудов печени за пределами опухоли (без инвазии сосудов 5-летняя выживаемость составляет 48%, с инвазией сосудов — 23%);
5) врастание метастатической опухоли в окружающие печень органы и структуры (при инвазии окружающих органов 3-летняя выживаемость составляет 11%, 4-летней выживаемости нет);
6) количество метастазов в печени (при солитарных метастазах 5-летняя выживаемость составляет 41%, при единичных — 17%, при множественных — 9%);
7) унилобарное или билобарное поражение печени единичными метастазами (при унилобарном поражении 5-летняя выживаемость составляет 35%, при билобарном поражении единичными метастазами 4-летняя выживаемость — 57%);
8) степень дифференцировки опухоли (при высоко- и умеренно дифференцированной опухоли 5-летняя выживаемость составляет 30–42%, при низкой дифференцировке 5-летней выживаемости нет, 3-летняя выживаемость — 40%);
9) размеры опухоли являются негативным прогностическим фактором, когда обусловливают расширенную гемигепатэктомию с расстоянием от линии резекции до опухоли менее 1 см, при этом нет 3-летней выживаемости;
10) мутантный ген p53 в клетках опухоли (без мутации p53 5-летней выживаемости нет, при мутантном гене p53 5-летняя выживаемость — 22%);
11) экспрессия протеина Bax (при экспрессии Bax 5-летняя выживаемость — 38%, при отсутствии указанного белка нет 2-летней выживаемости);
12) прогностически положительным фактором является экспрессия гена nm 23;
13) сосудистый эндотелиальный фактор роста (VEGF) (при его обнаружении нет 2-летней выживаемости);
14) объем операции (при нерасширенных анатомических резекциях и экономных атипичных резекциях печени 5-летняя выживаемость колеблется от 33 до 46%, при расширенных гемигепатэктомиях нет 3-летней выживаемости);
15) расстояние от линии резекции до опухоли (при расстоянии более 2 см 5-летняя выживаемость составляет 34%, при расстоянии менее 1 см 3-летняя выживаемость составляет 22%, 5-летней выживаемости нет);
16) объем кровопотери во время резекции печени (при кровопотере менее 2000 мл 5-летняя выживаемость составляет 39%, при кровопотере более 2000 мл — 13%);
17) адьювантная химиотерапия (при адьювантной химиотерапии 5-летняя выживаемость составляет 48%, без адьювантной химиотерапии — 30%) (Fong Y., 1999; Патютко Ю.И. и Сагайдак И.В., 2003).
Попытка связать продолжительность жизни больных после удаления синхронных с первичной опухолью метастазов в печени и местную распространенность первичной опухоли обнаружила следующее. При местном распространении колоректального рака, соответствующем стадии В (по Dukes C., 1929) (инвазия мышечной оболочки толстой кишки без метастазов в регионарные лимфоузлы), 5-летняя выживаемость составила 36–47%, что достоверно выше, чем при стадии С (врастание опухоли в околомышечную клетчатку как без регионарных метастазов, так и с регионарными метастазами), 5-летняя выживаемость составляет 23–25% (Hughes K.S. et al., 1986; Вишневский В.А. и др., 1998).
Влияние времени обнаружения метастазов в печени по отношению ко времени удаления первичной опухоли — метахронные или синхронные — оценивается неоднозначно. При удалении метастазов в печени, выявленных с интервалом больше года после удаления первичной опухоли, достигнута 5-летняя выживаемость 44%, менее года — 24%. Некоторые авторы, напротив, отрицают значение времени выявления метастазов в печени после удаления первичной опухоли, как прогностически значимого фактора. Реально влияющий на прогноз фактор — количество метастазов. При множественном унилобарном поражении 5-летняя выживаемость после резекции печени может достигать 17% (Scheele J. et al., 1991). Внепеченочные метастазы (в лимфоузлы гепатодуоденальной связки, забрюшинные лимфоузлы, в легкие, яичники и другие органы) синхронные с метастазами колоректального рака в печень, естественно, ухудшают прогноз. Резекция печени по поводу метастазов колоректального рака с удалением внепеченочных метастазов в лимфоузлы гепатодуоденальной связки обусловливает 3-летнюю выживаемость 28,5% и 5-летнюю выживаемость 14,3%, что пока недостижимо при химиотерапевтическом лечении. Резекция печени представляется оправданной только при удалении и других внепеченочных метастазов, например метастазов в легкие (Патютко Ю.И., Сагайдак И.В., 2001).
При первично нерезектабельных метастазах колоректального рака в печень возможна комбинированная системная или регионарная химиотерапия, включающая оксалиплатин, фторурацил с кальция фолинатом (неоадьювантная химиотерапия). При этом только у 16% пациентов становится возможной резекция печени (Bismuth H. et al., 1996).
В первые два года у большинства оперированных больных развивается рецидив заболевания после резекции печени по поводу метастазов колоректального рака. К концу третьего года без рецидива остаются только 28% оперированных больных. Рецидив метастазов в печени отмечается у 40–60% оперированных. Вероятность рецидива в печени максимальна при билобарном поражении печени и при линии резекции печени от опухоли на расстоянии менее 1 см. Изолированное поражение печени бывает у каждого третьего больного. Поражение легких (изолированное и вместе с другими органами) — у 17–31% больных.
Повторные резекции печени по поводу изолированного рецидива метастазов колоректального рака в печени обусловливают 5-летнюю выживаемость после повторной резекции у 32% больных и медиану продолжительности жизни 29 мес, что оправдывает активную хирургическую тактику при печеночном рецидиве.
Принципы и этапы хирургического лечения больных опухолями печени в виде аутотрансплантации печени рассмотрены выше в соответствующем разделе, посвященном лечению ПРП. Практически единичные наблюдения в настоящее время не позволяют дать оценку и определить место этого вида хирургического лечения при метастатическом поражении печени.
Локальное аблативное и циторедуктивное лечение метастазов колоректального рака в печень
Принципы и методики проведения, переносимость больными и особенности различных видов такого лечения также описаны выше в соответствующем разделе, посвященном лечению ПРП.
Радиочастотная термодеструкция, криодеструкция, иньекционное введение в опухоль этанола и другие виды локального аблативного и циторедуктивного лечения метастазов колоректального рака в печень применяются в следующих случаях:
1) больные с солитарными и единичными метастазами (каждый не более 5 см), у которых резекция печени представляет неоправданно высокий риск для жизни;
2) больные, у которых после резекции печени в оставшейся части имеются единичные метастазы размерами не более 5 см каждый (Seifert J.K. et al., 1998; Pearson A.S. et al., 1999).
Данные по применению радиочастотной термодеструкции метастазов в печени в ГУ РОНЦ им. Н.Н. Блохина РАМН свидетельствуют об удовлетворительной переносимости больными этого вида лечения. При патоморфологическом исследовании опухолевых участков резецированного фрагмента печени, в котором находились метастазы колоректального рака диаметром 3 см, подвергнутые радиочастотной термодеструкции, обнаруживались II и III степени лечебного патоморфоза — по периферии узла четко определялись комплексы опухолевых клеток в состоянии дистрофии. Бoльшая часть опухолевого узла была некротизирована. Несомненным достоинством радиочастотной термодеструкции является возможность осуществления лечения путем чрескожной пункции под местной анестезией в комбинации с внутривенной (или перидуральной) анестезией.
Внутрисосудистое чрескатетерное лечение метастазов колоректального рака в печень
Проводится больным с изолированным, билобарным поражением печени множественными метастазами. Методики, механизмы терапевтического действия, осложнения описаны выше в соответствующем разделе, посвященном лечению ПРП.
ЭПА
В силу низкой васкуляризации метастазов колоректального рака и, следовательно, неполного некроза опухоли, эффективность методики недостаточна. Данные о продолжительности жизни после ЭПА противоречивы, многие сообщают о медиане 12–15 мес, что достоверно не отличается от результатов системной химиотерапии.
ХИПА
Ниболее эффективные схемы:
1) Цисплатин — по 24 мг/м2 в день непрерывно в течение 5 суток; фторурацил — 250–500 мг/м2 в день в/в с 1 по 5 дни (6 циклов).
2) Цисплатин — по 55 мг/м2 за 4 ч в течение 5 суток; фторурацил — по 900 мг/м2 за 20 ч в течение 5 суток (каждые 5 нед).
3) Фторурацил — 1000 мг/м2 1 раз в неделю.
4) Флоксуридин (FUDR) — 0,3 мг/кг/сут с кальция фолинатом — 15 мг/м2 /сут в течение 14 суток (каждый месяц).
5) Фторурацил — 2200–2600 мг/м2 + фолиниевая кислота 500 мг/м2 за 24 ч 1 раз в неделю в течение 6 нед.
В ГУ РОНЦ им. Н.Н. Блохина РАМН используются 2 режима ХИПА:
1) фторурацил — 1200–1300 мг/м2 /сут в течение 4 дней;
2) фторурацил — 1200 мг/м2 /сут в течение 2–3 дней + доксорубицин — 60–80 мг/м2 /сут в течение 1 суток + цисплатин — 100 мг/м2 в течение 2 ч после гипергидратации.
Медиана продолжительности жизни — 14–22 мес (Борисов А.Е. и др., 1998; Егоров Г.Н., Рощин Е.М., 2001; Гранов Д.А., Таразов П.Г., 2002; Комов Д.В. и др., 2002; Hanazaki K. et al., 1998; Urtasun F. et al., 1999).
ХЭПА
Традиционно используются доксорубицин, митомицин, препараты платины, фторурацил.
Стандартные схемы лечения:
1) митомицин — 3 мг/мл + доксорубицин — 3 мг/мл + цисплатин — 10 мг/мл (максимально 9 мл) + ангиостат;
2) доксорубицин — 30 мг + митомицин — 10 мг + микросферы из крахмала;
3) митомицин — 3 мг/мл + фторурацил — 750 мг/м2 + вискоза;
4) фторурацил — 750 мг/м2 + интерферон альфа–2 + Ivalon;
5) митомицин — 3 мг/мл + доксорубицин — 3 мг/мл + цисплатин — 10 мг/мл (максимально 8,8 мл) + ангиостат + системная химиотерапия фторурацилом и кальция фолинатом.
В ГУ РОНЦ им. Н.Н. Блохина РАМН используется следуюшая химиоэмболизирующая смесь: доксорубицин — 80–90 мг/м2 (или эпирубицин) + йогексол (5 мл контрастного вещества на 10 мг цитостатика с добавлением 10 мл йодсодержащего МРП). Эмболизация проводится за 8–10 приемов по 4–5 мл смеси за 2–3 мин. Несмотря на объективный эффект у 20–30% больных, выживаемость невысока. Медиана продолжительности жизни — 8–14 мес.
Методика показана при неэффективности системной химиотерапии и ХИПА.
МХЭПА
Доксорубицин — 40–100 мг + смесь дистилированной воды и 60% раствора рентгеноконтрастного вещества + 5–20 мл МРП или Диоксадэт — 10–30 мг в 1 мл 96% этанола + 5–20 мл МРП.
Объективный частичный ответ при использовании Диоксадэта (жирорастворимый цитостатик) и доксорубицина — 13–25%. Медиана продолжительности жизни 8–12 мес. При частичном ответе 1-летняя выживаемость — 67–100%. Сообщается о достижении 2-летней выживаемости у 20–27% больных, в т.ч. при сочетанном лечении ХИПА+МХЭПА. Отмечается несколько бoльшая эффективность при МХЭПА с доксорубицином. По мнению Д.А. Гранова и П.Г. Таразова (2002), эффективность МХЭПА с доксорубицином несколько выше, чем при ХИПА.
Сочетание МХЭПА и МХЭВВ
Объективный ответ — у 31% больных. При проведении 3-х курсов удается достичь 3-летней выживаемости у 50% больных, что практически недостижимо при других методиках внутрисосудистого чрескатетерного лечения.
Чрескатетерная химиотерапия в воротную вену по поводу метастазов колоректального рака допустима в комбинации с внутриартериальной химиоинфузией или химиоэмболизацией, при окклюзии артериального русла печени.
Внутриартериальная радиоэмболизация радиоактивным 90Y
90Y — источник бета-излучения с периодом полураспада 64 ч и энергией дезинтеграции 0,937 МэВ, бета-частицы проникают в окружающие ткани не более чем на 10 мм. Достигается значительное превышение дозы радиации в опухоли по сравнению с непораженной паренхимой печени — 34–147 против 9–75 Гр. Радиоэмболизация переносится относительно легко. У большинства пациентов достигается стойкая стабилизация — от 2 до 12 мес. В целом эффективность лечения невысока.
Системное лекарственное лечение больных метастазами колоректального рака в печень
Колоректальный рак относительно резистентен к цитостатической терапии. Системная химиотерапия по поводу колоректальных метастазов в печени основывается на использовании фторурацила, в том числе с кальция фолинатом, УФТ (тегафур + урацил), капецитабина, ралтитрекседа, иринотекана, оксалиплатина.
Схемы на основе фторурацила:
1) фторурацил — 425 мг/м2 в/в с 1 по 5 дни, кальция фолинат — 20 мг/м2 в/в с 1 по 5 дни (каждые 28 дней);
2) фторурацил — 375 мг/м2 в/в с 1 по 5 дни, кальция фолинат — 200 мг/м2 в/в с 1 по 5 дни за 1 ч до введения фторурацила (каждые 28 дней);
3) фторурацил — 400 мг/м2 в/в струйно 1 день, фторурацил — 600 мг/м2 22-часовая инфузия во 2 день, кальция фолинат — 200 мг/м2 2-часовая инфузия до фторурацила (еженедельно 6 нед);
4) фторурацил — 200 мг/м2/сут, постоянная инфузия в течение 6–8 нед;
5) фторурацил — 2,5 г/м2 инфузия в течение 24 ч (еженедельно);
6) фторурацил — 2,6 г/м2 инфузия в течение 24 ч, кальция фолинат — 500 мг/м2 (еженедельно).
Схемы на основе применения пероральных фторпиримидинов (УФТ и капецитабин):
1) УФТ — 300 мг/м2 в сутки в течение 14–28 суток с интервалами 1–2 нед;
2) капецитабин — 2500 мг/м2 в сутки в течение 14 дней с интервалами 2 нед.
Схемы на основе других препаратов:
1) ралтитрексед — 3 мг/м2, 15-минутная инфузия 1 раз в 3 нед;
2) иринотекан — 350 мг/м2 1 раз в 3 нед;
3) оксалиплатин — 130 мг/м2, 2-часовая инфузия 1 раз в 3 нед или 85 мг/м2, 2–6-часовая инфузия 1 раз в 2 нед;
4) оксалиплатин в комбинации с фторурацилом и кальция фолинатом: фторурацил — 400 мг/м2, 2-часовая инфузия + 600 мг/м2 22-часовая инфузия, 1–2 дня, каждые 2 нед + оксалиплатин — 85 мг/м2, 2-часовая инфузия 1 день, каждые 2 нед.
Объективный эффект при разной выраженности токсичности наблюдается у 14–50% больных. Медиана продолжительности жизни — 14–20 мес. Лечение производными фторпиримидинов (фторурацил и др.) ограничено активностью в опухолевых клетках тимидилатсинтетазы и дигидропиримидиндегидрогеназы. При высокой активности указанных ферментов лечение фторурацилом нецелесообразно. Предпочтение следует отдать иринотекану и оксалиплатину.
Разработка биотерапии и молекулярно нацеленной лекарственной терапии диссеминированных форм колоректального рака, в том числе — с поражением печени, находится на стадии клинического эксперимента. Можно рассчитывать на эффект следующих препаратов:
1) трастузумаб — МКА к экстрацеллюлярному домену рецептора Her–2;
2) ZD 1839 (Иреса) — ингибитор трансфосфорилирования EGFR (рецепторы эпидермального фактора роста), потенцирует эффект производных платины;
3) целекоксиб и рофекоксиб — ингибиторы COX–2 (циклооксигеназа 2 — фермент, влияющий на неоангиогенез);
4) SU 5416 (семаксиниб) и SU 6668 — ингибиторы VEGF (сосудистый эндотелиальный фактор роста);
5) аутологичная вакцина: (ее эффективность) оценивается противоречиво (Переводчикова Н.И., 2001; Тюляндин С.А., 2001; Vermorken J. et al., 1996; Harris J.E. et al., 2000; Нариманов М.Н. и др., 2001).
Комбинированное лечение больных с метастазами колоректального рака в печень определяет наилучшие отдаленные результаты
Адьювантную химиотерапию целесообразно осуществлять после удаления метастазов в печени. Комбинированное лечение с дооперационной химиотерапией менее эффективно.
В ГУ РОНЦ им. Н.Н. Блохина РАМН с успехом осуществляется комбинированное лечение по следующей схеме:
На I этапе выполняется резекция печени того или иного объема.
Через 2–3 нед после операции проводится курс ХИПА: фторурацил — 600 мг/м2 в сутки непрерывно в течение 96 ч + кальция фолинат — 100 мг/м2 в/а струйно с 1 по 4 день.
II и III курсы системно: фторурацил — 500 мг/м2 в/в капельно с 1 по 3 дни+ кальция фолинат — 100 мг/м2 в/в с 1 по 3 дни. Интервал между курсами — 3 нед. При этом 5-летняя выживаемость — 48%. Применение именно фторурацила с кальция фолинатом оправдано, поскольку убедительных данных о более высокой эффективности в качестве адьювантной химиотерапии других противоопухолевых препаратов нет (Патютко Ю.И., Сагайдак И.В., 2001; Kemeny N. et al., 1993).
Послеоперационная химиоэмболизация печеночной артерии (ХЭПА) способствует продлению безрецидивного периода с 9,6 до 18,8 мес (Гранов Д.А., Таразов П.Г., 2002).
Комбинированное хирургическое и чрескатетерное внутрисосудистое лечение
Предоперационная ХЭПА по поводу метастазов колоректального рака сомнительна:
— во-первых, метастазы колоректального рака аваскулярны, что не приводит к желаемому циторедуктивному эффекту и уменьшению интраоперационной кровопотери;
— во-вторых, возможны осложнения — постэмболизационный синдром и другие;
— в-третьих, не отмечено улучшение показателей отдаленной выживаемости больных с предоперационной ХЭПА.
Предоперационная эмболизация воротной вены по поводу метастазов колоректального рака в печень проводится за 4–6 нед до операции и показана при наличии резектабельной опухоли, удаление которой возможно только вместе со значительным объемом непораженной опухолью паренхимы печени, когда остающийся объем органа менее 30%. Осуществляется окклюзия ветви воротной вены пораженной доли печени (чаще правой). Предоперационная эмболизация воротной вены может сочетаться с МХЭПА. Достигается девитализация опухоли с последующим уменьшением вероятности ее диссеминации во время резекции печени и гипертрофируется остающаяся часть органа. Отмечается повышение резектабельности опухоли на 19%, некоторое улучшение показателей отдаленной выживаемости (Azoulay D., et al., 2000).
Допустимы:
— комбинация циторедуктивной резекции печени и послеоперационной ХИПА;
— резекция печени с одновременным или последующим аблативным и циторедуктивным лечением по поводу единичных метастазов в оставшейся части печени;
— комбинация методик локальной аблативной и циторедуктивной терапии (радиочастотная термодеструкция, криодеструкция, локальная микроволновая и лазерная коагуляция, введение этанола) с ХИПА и ХЭПА при билобарном поражении печени множественными метастазами колоректального рака.
— комбинация ХЭПА или МХЭПА, включая суперселективное внутриартериальное введение ферромагнетиков с последующей регионарной СВЧ-гипертермией.
Характеризуя успехи того или иного метода лечения больных колоректальными метастазами в печень, необходимо помнить, что биологические особенности самого колоректального рака таковы, что при наличии солитарных, резектабельных метастазов в печени и удаленной первичной опухоли возможна 5-летняя выживаемость 4–8% пациентов без противоопухолевого лечения.
Лечение неколоректальных метастазов в печень
Хирургическое лечение
Резекция печени по поводу неколоректальных метастазов.
Клиническая классификация неколоректальных метастазов в печень основана на отдаленных результатах хирургического лечения. Выделены три группы больных.
I группа — больные, которым показано выполнение резекции печени по поводу солитарных и единичных метастазов в печень первичных опухолей следующих локализаций: почка, надпочечник, желудок, нейроэндокринные опухоли любой локализации.
II группа — больные, которым показана резекция печени в составе комбинированного лечения по поводу солитарных и единичных метастазов в печень первичных опухолей следующих локализаций: яичник, яичко, молочная железа.
III группа — больные с метастазами в печень рака поджелудочной железы, большого дуоденального сосочка, легкого, меланомы кожи, которым резекции печени не показаны.
При хирургическом лечении неколоректальных метастазов в печень не прослеживаются достоверные различия в выживаемости между больными в зависимости от сроков обнаружения метастазов после удаления первичной опухоли — синхронные или метахронные, объема операций — обширные или экономные резекции печени, размера метастазов (при условии радикальной резекции печени), количества метастазов (также при условии радикальной резекции печени).
Показатели отдаленной выживаемости после резекций печени в первых двух группах достоверно выше, чем при лекарственной терапии. Так, при резекции печени по поводу изолированного поражения ее метастазами рака почки 5-летняя выживаемость составляет 25%, рака надпочечника — 100%, метастазами нейроэндокринных опухолей — 40%.
Даже при изолированном поражении печени резектабельными метастазами рака желудка достижима 5-летняя выживаемость, и составляет 9–20%. При химиотерапии недостижима и 3-летняя выживаемость. Естественно, солитарные и единичные метастазы рака желудка с изолированным унилобарным поражением печени — редкость, которая в большей степени отражает биологические особенности конкретной опухоли и иммунобиологический статус больного.
При повторных резекциях печени по поводу метастазов гепатоцеллюлярного рака для двух третей оперированных больных достижима 5-летняя выживаемость.
При изолированном поражении печени метастазами рака молочной железы, яичка, яичников после проведенного лекарственного лечения показана резекция печени, при которой достижима 5-летняя выживаемость. При изолированном поражении печени солитарными и единичными метастазами рака молочной железы и выполнении микроскопически радикальной резекции печени (R0) 5-летняя выживаемость составляет 22%, медиана продолжительности жизни — 42 мес (Raab R.et al., 1996; Miyazaki M. et al., 1997; Патютко Ю.И. и Подлужный Д.В., 2002).
Непременным условием резекций печени по поводу метастазов является полное удаление первичной опухоли. При наличии внепеченочных метастазов неколоректального рака, помимо резектабельных метастазов в печени, резекция печени также допустима при условии удаления внепеченочных метастазов.
Аутотрансплантация печени выполнена пока незначительному количеству больных.
Различные методы и виды локального циторедуктивного лечения больных с неколоректальными метастазами в печени (методики рассмотрены выше)
Криодеструкция, микроволновая гипертермическая коагуляция, внутриопухолевое введение этанола, уксусной кислоты, ультразвуковая фокусная, лазерная, радиочастотная термодеструкция метастазов в печени самостоятельно, в комбинации с паллиативной резекцией печени, регионарной или системной химиотерапией носят исключительно циторедуктивный характер и направлены на увеличение продолжительности жизни больных. Характеризуются удовлетворительной переносимостью.
Внутрисосудистое чрескатетерное (рентгеноэндоваскулярное) лечение
При метастатических опухолях отдаленный эффект зависит от объема опухолей в печени и степени кровоснабжения метастазов.
Учитывая аваскулярный характер большинства метастазов экзокринного рака пищеварительного тракта, лечебный эффект сомнителен.
ЭПА
ЭПА по поводу метастазов в печень гормональноактивной опухоли эффективна у 50% больных с удаленной первичной опухолью — выраженный симптоматический эффект, длительная ремиссия. При метастазах в печень гормональнонеактивных опухолей непосредственные и отдаленные результаты скромнее, хотя и лучше, чем при симптоматическом лечении.
ХЭПА
ХЭПА при метастазах в печень гормонпродуцирующих опухолей: медиана продолжительности жизни 15–33 мес, есть случаи 5-летней выживаемости. Наиболее перспективной считается методика МХЭПА. Лучший противопухолевый эффект связан с более длительной задержкой цитостатика в опухоли.
Используются: доксорубицин и его аналоги, препараты платины, митомицин, сверхжидкий МРП. Целесообразно проведение нескольких курсов (каждые 2–4 нед). Осложнения развиваются у 23–45% больных. Летальность — 1–4%.
При осуществлении МХЭПА по поводу высококровоснабжаемых метастазов нейроэндокринных опухолей в печень симптоматический эффект отмечается у 70–81% больных — исчезновение гормональных проявлений, объективный эффект развивается у 30–60% больных, 5-летняя выживаемость достигает 40%.
При метастазах гормонально неактивных опухолей результаты значительно хуже. МХЭПА по поводу метастазов рака ЖКТ, но неколоректального: объективный ответ развивается у 38% больных, 1-летняя выживаемость — 32–43%. Средняя продолжительность жизни при метастазах РЯ 13,5 мес, рака желудка — 8,1 мес, РМЖ — 9,4 мес. Влияющим на прогноз фактором является количество курсов МХЭПА.
ХИПА
ХИПА при неколоректальных метастазах рака ЖКТ с использованием фторурацила, доксорубицина, митомицина обусловливает объективный ответ у 25–73% больных, среднюю продолжительность жизни — 11–16 мес. При метастазах рака желудка в печень ХИПА оказывается достоверно эффективнее по сравнению с ХЭПА. Выживаемость в течение 1 года при ХИПА — 75%, при ХЭПА — 44%. Это позволяет при соответствующих условиях (см. ниже) начинать регионарное лечение по поводу метастазов рака желудка с ХИПА.
При метастазах РМЖ используется фторурацил и эпирубицин. Объективный ответ достигается у 50–81% больных, средняя продолжительность жизни — 5–16 мес.
При метастазах меланомы глаза в печень используются цисплатин, фотемустин. Объективный эффект получен у 38–40% больных, медиана продолжительности жизни — 14 мес.
При метастазах рака ПЖ в печень ХИПА неэффективна, как впрочем и другие виды регионарной лекарственной терапии. Медиана продолжительности жизни — 2–5 мес.
Примеры схем ХИПА:
1) фторурацил — 750–1000 мг/сут с 1 по 4 дни, каждые 2 мес;
2) фторурацил — 330 мг/м2 /нед + доксорубицин — 20 мг/м2 1 раз в 4 нед + митомицин — 2,7 мг/м2 1 раз в 2 нед;
3) фторурацил — 1000–1500 мг/м2/сут в течение 5 суток + доксорубицин — 50–75 мг/м2 на 4 сутки;
4) фторурацил — 1000–1500 мг/м2 /сут в течение 4–5 суток + эпирубицин — 20 мг/м2 1 раз в неделю;
5) цисплатин — 300 мг/м2 1 раз в 2 недели;
6) фотемустин — 100 мг/м2 /нед 1 раз в неделю в течение 3–4 нед, перерыв 5 нед.
(Поликарпов А.А. и др., 2000; Tamamori Y. et al., 2000; Yao K.A. et al., 2001; Proye C. et al., 2001; Гранов Д.А., Таразов Н.Г., 2002; Комов Д.В. и др., 2002; ).
Условиями проведения чрескатетерного внутрисосудистого лечения по поводу метастазов в печень являются:
— удаленная первичная опухоль,
— изолированное поражение печени,
— удовлетворительная функция печени.
Указанные условия резко сокращают количество кандидатов на регионарное лечение.
Системное лекарственное лечение больных c метастазами неколоректального рака в печень
При метастазах в печень плоскоклеточного рака легкого применяются следующие препараты: цисплатин, доксорубицин, метотрексат, этопозид, ифосфамид, циклофосфамид, винкристин, ломустин, винбластин, виндезин, винорелбин, фторурацил, прокарбазин, гемцитабин, доцетаксел, паклитаксел.
При метастазах в печень аденокарциномы легкого применяют цисплатин, ифосфамид, митомицин, циклофосфамид, доксорубицин, нимустин, ломустин, этопозид, винорелбин, фторурацил, гемцитабин, паклитаксел, доцетаксел, иринотекан.
При метастазах в печень рака желудка используют фторурацил, митомицин, цисплатин, этопозид, ломустин, метотрексат, тегафур, доксорубицин, кармустин, стрептозоцин, иринотекан.
При метастазах в печень протокового рака ПЖ применяют фторурацил, митомицин, стрептозоцин, доксорубицин, ифосфамид, гемцитабин.
При метастазах в печень РМЖ применяют циклофосфамид, метотрексат, фторурацил, доксорубицин, эпирубицин, митоксантрон, тиотепа, цисплатин, митомицин, винорелбин, винкристин, мелфалан. Для эндокринной терапии используется тамоксифен, аминоглутетимид, а также эстрогены, андрогены, прогестины, препараты глюкокортикоидов, препараты класса LH - RH.
Предпочтение отдается комбинациям препаратов.
Комбинированное лечение больных с метастазами неколоректального рака в печень (применяемые варианты комбинированного лечения)
1) Оптимальной является комбинация резекции печени с предварительной системной химиотерапией и возможной химиотерапией после операции по поводу изолированного поражения печени метастазами химиочувствительных опухолей (РМЖ, РЯ, рак яичка).
2) Резекция печени + различные виды локального аблативного и циторедуктивного лечения (радиочастотная термодеструкция, криодеструкция, введение в опухоль этанола и др.).
3) Резекция печени + внутрисосудистое чрескатетерное лечение: ХЭПА (в т.ч. МХЭПА) печеночной артерии + резекция печени; ХИПА + резекция печени.
4) Перспективно сочетание локального аблативного и циторедуктивного воздействия с системной или регионарной химиотерапией при множественных метастазах неколоректального рака в печень.
Описание проверено экспертом
Оцените статью:
- Метастазы в печень
- Метастатические поражения печени
- Опухоли печени метастатические
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
метастазы в печени
метастатическим поражением печени более 70 %, метастазами в печени, метастазами в печень, метастатическом поражении печени,


