- Определение, эпидемиология, этиологические факторы, патогенез
- Морфология
- Клиника
- Диагностика
- Лечение
- Химиотерапия
- Лечение больных благоприятной прогностической группы
- Лечение больных промежуточной прогностической группы
- Лечение больных неблагоприятной прогностической группы
- Лечение рецидивов
- Высокодозная химиотерапия (ВДХ)
- Лимфома Ходжкина у пожилых больных
- Качество жизни больных лимфомой Ходжкина
- Современные критерии оценки эффективности терапии больных лимфомой Ходжкина
C81 Болезнь Ходжкина [лимфогранулематоз], МКБ-10
- C81.0 Лимфоидное преобладание
- C81.1 Нодулярный склероз
- C81.2 Смешанно-клеточный вариант
- C81.3 Лимфоидное истощение
- C81.7 Другие формы болезни Ходжкина (лимфогранулематоз доброкачественный)
- C81.9 Болезнь Ходжкина неуточненная
Отредактировано: 02.04.2024
к.м.н. Демина Е.А.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Определение, эпидемиология, этиологические факторы, патогенез. Морфология. Клиника. Диагностика. Лечение. Лечение рецидивов. Высокодозная химиотерапия. Лимфома Ходжкина у пожилых больных. Качество жизни больных лимфомой Ходжкина. Современные критерии оценки эффективности терапии больных лимфомой Ходжкин
Определение, эпидемиология, этиологические факторы, патогенез
Лимфома Ходжкина (название введено ВОЗ в 2001 г., синонимы — болезнь Ходжкина, ЛГМ) — это злокачественная опухоль лимфатических узлов и лимфатической системы с последующим возможным вовлечением других органов; патоморфологическим субстратом опухоли являются крупные многоядерные клетки Березовского — Рид — Штернберга.
В конце 70-х годов лимфома Ходжкина стала одной из первых злокачественных опухолей, в отношении которой была сформулирована концепция потенциальной излечимости. История поиска путей излечения от этого заболевания столь показательна, что позволила в начале 80-х годов одному из крупнейших онкологов мира, директору Национального института рака США, создателю программы радикальной лучевой терапии Генри Каплану написать: “Болезнь Ходжкина занимает особое место в истории понимания онкологических заболеваний, потому что многие принципы, важные для современной диагностики, стадирования и лечения были впервые использованы в управлении этой болезнью”. Этот тезис актуален и по сей день, поскольку многие онкологические проблемы и сегодня впервые приходится решать у больных лимфомой Ходжкина.
Заболевание первым описал Томас Ходжкин в 1832 г. В 1865 г. S. Wilks предложил название — “болезнь Ходжкина”, и с тех пор термин “Hodgkin’s disease” прочно закрепился в научной англоязычной литературе. В 1890 г. С.Я. Березовский, а в 1898 г. Карл Штернберг описали крупные многоядерные клетки, которые встречались только в пораженных опухолью лимфатических узлах. В 1902 г. Дороти Рид дала подробную морфологическую характеристику этих клеток, сопроводив ее рисунками. С.Я. Березовский и Д. Рид в разное время предположили, что именно эти крупные многоядерные клетки являются субстратом болезни и впоследствии они получили название клеток Рид — Штернберга (в России за ними закрепилось название клеток Березовского-Штернберга). В дальнейшем изложении для обозначения этих клеток будет использоваться название — “клетки Березовского — Рид — Штернберга”.
Термин “лимфогранулематоз” был введен в 1904 г. на VII Съезде немецких патологов в Вене. В самой последней классификации опухолей кроветворной и лимфоидной тканей Всемирной организации здравоохранения (ВОЗ) 2001 г. для обозначения этой болезни предложен термин “лимфома Ходжкина”.
В России заболеваемость лимфомой Ходжкина составляет 2,3 на 100 тыс. населения, а в США — 2,8. Мужчины болеют несколько чаще, чем женщины. Заболевание встречается в любом возрасте, но кривая заболеваемости имеет два пика — первый приходится на возраст 15–35 лет, а второй постепенно нарастает после 50. В последнее время наличие второго пика подвергается сомнению. Среди молодых больных преобладают женщины, а среди больных старших возрастных групп — мужчины. Лимфома Ходжкина в одной семье встречается крайне редко.
Результаты многочисленных исследований по изучению зависимости между инфицированностью вирусом Эпштейна — Барр и частотой возникновения лимфомы Ходжкина показали, что риск развития болезни среди тех, кто перенес инфекционный мононуклеоз, т.е. инфицирован вирусом Эпштейна — Барр, в 3 раза выше по сравнению с неинфицированной популяцией. Тем не менее роль вируса Эпштейна — Барр у больных с отрицательной серологической реакцией как и роль других вирусов в патогенезе лимфомы Ходжкина, остается не вполне ясной.
В последнее десятилетие значительное развитие получили методы иммунофенотипирования и цитогенетики в изучении и диагностике лимфомы Ходжкина. Долгое время расшифровать природу клеток Березовского — Рид — Штернберга было затруднительно в связи с тем, что они редко разбросаны в окружении эозинофилов, лимфоцитов, плазматических и др. клеток. Только разработка и внедрение методик, позволяющих работать с одной отдельно выделенной клеткой, внесли ряд уточнений в происхождение клеток Березовского — Рид — Штернберга.
В настоящее время большинством исследователей принята гипотеза патогенеза лимфомы Ходжкина, выдвинутая группой немецких ученых во главе с профессором V. Diehl в 1997 г. Современные взгляды на патогенез классической лимфомы Ходжкина основываются на том, что в большинстве случаев клетки Ходжкина (крупные одноядерные клетки) и Березовского — Рид — Штернберга являются результатом моноклональной пролиферации зрелых В-клеток, происходящих из зародышевого центра фолликула лимфатического узла. Эти клетки, избежав апоптоза (запрограммированной клеточной смерти), получили возможность неконтролируемой пролиферации. События, которые происходят в зародышевом центре фолликула лимфатического узла, играют решающую роль в патогенезе лимфомы Ходжкина, а основным механизмом, определяющим начало злокачественной пролиферации, является блок апоптоза. Т-клеточная природа клеток Березовского — Рид — Штернберга документирована в редких (менее 2%) случаях.
Иммунологическими маркерами, имеющими дифференциально-диагностическое значение, являются антигены CD15 и CD30 обычно при отсутствии CD45 и редкой экспрессии CD20 клетками Березовского — Рид — Штернберга.
Лимфома Ходжкина может сопровождаться угнетением Т-клеточного иммунитета. Больные подвержены различным вирусным инфекциям и, в первую очередь, герпетическим — у 16% развивается Herpes zoster. Опоясывающий лишай (Herpes zoster) у больных лимфомой Ходжкина часто характеризуется тяжелым рецидивирующим течением, имеет тенденцию к генерализации и развитию некротических форм.
У 5% больных наблюдается сочетание лимфомы Ходжкина с туберкулезом. Важно иметь в виду, что у больных лимфомой Ходжкина туберкулиновая реакция (реакция Манту) бывает отрицательной.
Морфология
Диагноз лимфомы Ходжкина устанавливается исключительно гистологически и считается достоверным только в том случае, если найдены специфические двуядерные или многоядерные клетки Березовского — Рид — Штернберга. Цитологическое исследование обязательно на первом этапе диагностики для выработки плана обследования. Однако этим методом не всегда возможно установить вариант лимфомы Ходжкина и провести дифференциальный диагноз с различными типами крупноклеточных неходжкинских лимфом. Для адекватного гистологического исследования лимфатический узел должен быть удален целиком, ибо полноценная диагностика возможна только при исследовании структуры всего узла. Это связано с тем, что нередки ситуации, когда опухолью поражена лишь часть удаленного лимфатического узла. В сложных дифференциально-диагностических ситуациях необходимо проводить иммуноморфологическое исследование опухолевой ткани.
В классификации ВОЗ (2001 г.) выделено два типа лимфомы Ходжкина — классическая и нодулярная с преобладанием лимфоцитов (парагранулема).
Согласно современной международной морфологической классификации выделяются 4 гистологических варианта классической лимфомы Ходжкина:
1) с нодулярным (узловатым) склерозом (рис. 1);
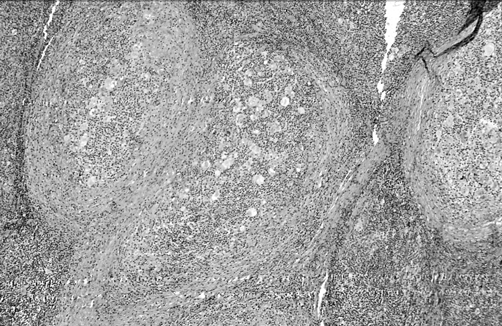
Рисунок 1. Лимфома Ходжкина. Вариант: нодулярный склероз
2) смешанно-клеточный (рис. 2);
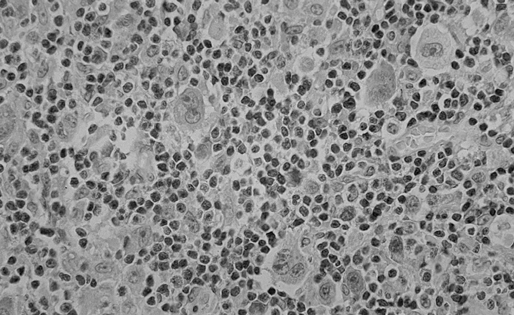
Рисунок 2. Лимфома Ходжкина. Вариант: смешанно-клеточный
3) богатая лимфоцитами классическая лимфома Ходжкина (Lymphocyte-rich сlassical Hodgkin’s Lymphoma);
4) c лимфоидным истощением (или подавлением) по типу диффузного фиброза или по так называемому ретикулярному типу.
В свою очередь, вариант с нодулярным склерозом подразделяется на два типа в зависимости от клеточного состава “нодулей”: тип I — со смешанно-клеточным составом нодулей и тип II — с лимфоидным истощением в них.
По существу, последняя классификация ВОЗ базируется на ранее использовавшейся классификации R.J. Lukes и J.J. Butler.
Все эти варианты в классификации ВОЗ 2001 г. объединены в рубрике “Классическая лимфома Ходжкина” (Classical Hodgkin’s Lymphoma), потому что отражают различные морфологические проявления одного заболевания. Опухолевые клетки имеют одинаковый иммунологический фенотип и характеризуются экспрессией антигенов CD15, CD30 и отсутствием CD45. Экспрессия CD20, обнаруживаемая на небольшой части клеток Березовского — Рид — Штернберга, не противоречит диагнозу лимфомы Ходжкина.
Отдельно выделенная т.н. “нодулярная с лимфоидным преобладанием лимфома Ходжкина” (Nodular Lymphocyte predominant Hodgkin’s Lymphoma) — парагранулема — является особой формой, отличающейся от классической лимфомы Ходжкина. Она имеет своеобразное морфологическое строение и клиническое течение. Сведения об этом варианте лимфомы Ходжкина представлены в конце раздела.
Своеобразие классической лимфомы Ходжкина определяется ее морфологическим субстратом: наличием полиморфноклеточной гранулемы, образованной лимфоцитами, нейтрофилами, эозинофилами, гистиоцитами, плазматическими клетками, среди которых редко располагаются крупные одноядерные клетки Ходжкина и гигантские дву— или многоядерные клетки Березовского — Рид — Штернберга. В различной степени могут быть выражены явления фиброза, встречаются очаги некроза. Нормальный рисунок строения в пораженном лимфатическом узле постепенно стирается. Из всего многообразия элементов гранулемы только клетки Ходжкина и Березовского — Рид — Штернберга являются опухолевыми (доказана их анеуплоидия и клональность). Все остальные клеточные элементы — лимфоциты, гистиоциты, плазматические клетки, эозинофилы и т.д. — составляют реактивный компонент и не являются опухолевыми; считается, что они отражают реакцию лимфоидной ткани на пролиферацию клеток Березовского — Рид — Штернберга.
Вариант с нодулярным склерозом чаще встречается у молодых больных, среди которых преобладают женщины. При этом варианте больше ранних стадий с поражением лимфатических узлов только выше диафрагмы. Своеобразие архитектоники опухолевой ткани обусловлено наличием тяжей коллагена, делящих узел на участки округлой формы — нодули.
Смешанно-клеточный вариант встречается преимущественно у больных старшей возрастной группы. Этот вариант имеет классическую морфологическую картину, когда рисунок строения лимфатического узла стерт, а клетки Ходжкина и опухолевые клетки Березовского — Рид — Штернберга редко разбросаны среди лимфоцитов, эозинофилов, гистиоцитов и др.
Богатая лимфоцитами классическая лимфома Ходжкина встречается редко. При гистологическом исследовании в лимфатическом узле среди реактивных клеток преобладают малые лимфоциты, а клетки Ходжкина и Березовского — Рид — Штернберга немногочисленны. Этот вариант лимфомы Ходжкина имеет наиболее благоприятное течение — 15-летняя выживаемость больных достигает 90%.
Вариант с лимфоидным истощением весьма редок. Среди диффузного фиброза обнаруживаются небольшие скопления различных клеточных элементов, преобладают опухолевые клетки Березовского — Рид — Штернберга. Вариант характеризуется плохим прогнозом.
Наиболее часто и приблизительно в равных соотношениях встречаются варианты с нодулярным склерозом и смешанно-клеточный (30–45% каждый) и одинаково редко (до 10%) — богатый лимфоцитами и с лимфоидным истощением.
Дифференциальная диагностика лимфомы Ходжкина проводится с крупноклеточными лимфомами, как В-, так и Т-клеточной природы, а также с неспецифическими лимфаденитами. Клетки, напоминающие клетки Ходжкина и типа Пирогова — Лангханса (крупные многоядерные клеточные элементы) могут встречаться при туберкулезе и актиномикозе и вызывать диагностические затруднения. Однако отсутствие многоядерных клеток Березовского — Рид — Штернберга позволяет, как правило, провести дифференциальный диагноз даже на уровне световой микроскопии.
Клиника
Основным клиническим проявлением лимфомы Ходжкина является увеличение лимфатических узлов. Заболевание из очага первичного поражения в лимфатическом узле на первых этапах распространяется путем лимфогенного метастазирования, преимущественно в сопредельные лимфатические коллекторы. Гематогенная диссеминация происходит позже. Увеличенные лимфатические узлы имеют плотноэластическую консистенцию, обычно не спаяны с кожей и безболезненны. Менее чем у 25% больных отмечается характерный симптом — боли в увеличенных лимфатических узлах после приема алкоголя. Изъязвление лимфатических узлов и образование свищей встречается редко и всегда требует исключения туберкулеза, актиномикоза или вторичной инфекции. Чаще всего поражаются надключичные и медиастинальные лимфатические узлы (50–55% каждая из зон), реже — подмышечные (рис. 3).
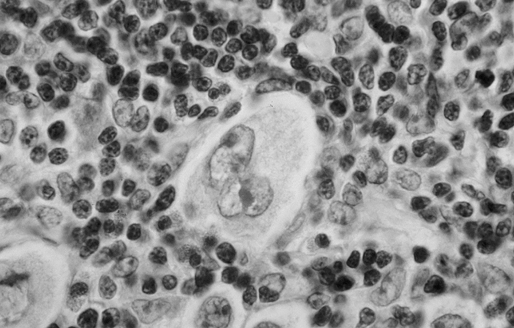
Рисунок 3. Лимфома Ходжкина. Биопсия увеличенного лимфатического узла. Типичные клетки Березовского — Рид — Штернберга
У 90% первичных больных отмечается поражение лимфатических узлов выше диафрагмы. Первичная локализация только ниже диафрагмы встречается лишь у 10% больных. Кольцо Вальдейера, околоушные, затылочные и локтевые лимфатические узлы поражаются крайне редко и всегда требуют уточнения диагноза для исключения других вариантов лимфом. Изолированное увеличение внутригрудных лимфатических узлов отмечается у 15% больных и нередко длительно существует бессимптомно (рис. 4).
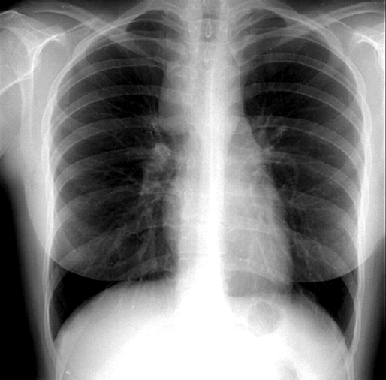
Рисунок 4. Лимфома Ходжкина. Рентгенограмма грудной клетки в прямой проекции
Увеличение лимфатических узлов средостения
При значительном увеличении медиастинальных лимфатических узлов иногда возникает сухой кашель. Однако боли в грудной клетке и синдром сдавления верхней полой вены возникают только при очень большом увеличении лимфатических узлов средостения. При больших конгломератах лимфатических узлов в средостении возможно прорастание опухоли в плевру, легочную ткань, перикард, трахею и бронхи, пищевод, грудину и мягкие ткани передней грудной стенки. Нередко возникает плеврит (как правило — транссудат) и реже — перикардит. Диагностические клетки Березовского — Рид — Штернберга при микроскопии осадка плевральной жидкости обнаруживаются редко. У части больных с массивными медиастинальными лимфатическими узлами, при сдавлении ими верхней полой вены, плеврит или перикардит (всегда транссудат) могут развиваться при отсутствии опухолевого поражения плевры или перикарда. Кроме того, при массивном поражении лимфатических узлов средостения почти всегда отмечается умеренное увеличение печени, что не является признаком ее метастатического поражения, а вызвано сдавлением верхней полой вены.
Значительное увеличение забрюшинных лимфатических узлов сопровождается болями в пояснице. Боли чаще возникают ночью и несколько уменьшаются в положении больного “на корточках”. Селезенка поражается у 1/4 больных, однако значительное увеличение органа отмечается не часто. Явления гиперспленизма даже при больших размерах селезенки развиваются крайне редко.
Из нелимфоидных органов чаще всего поражаются легкие — 20–30%. Аускультативная картина, как правило, крайне скудна. Клетки Березовского — Рид — Штернберга в мокроте обнаруживаются очень редко даже при массивных метастазах. Поражение легочной ткани может носить как очаговый, так и инфильтративный характер, иногда с распадом и образованием полостей. Выявление полостей распада в легких у больных лимфомой Ходжкина всегда требует исключения вторичной инфекции — туберкулеза, актиномикоза, бактериальной и грибковой пневмонии. В абсолютном большинстве случаев изменения в легочной ткани выявляются у больных с увеличением лимфатических узлов средостения и могут сочетаться с поражением плевры.
Метастазы в кости наблюдаются у 14–20% больных. Очаги поражения чаще локализуются в позвонках, грудине (возможно прорастание из лимфатических узлов средостения), ребрах, костях таза. Трубчатые кости поражаются редко. Обычно боли в костях возникают за 3–6 мес до выявления явных литических очагов на рентгенограммах.
У 10–12% первичных больных встречается поражение печени. Однако при прогрессировании заболевания метастазы в печени отмечаются в половине случаев. Метастазы лимфомы Ходжкина в печень могут длительно существовать бессимптомно и практически не встречаются у больных без поражения лимфоидных органов ниже диафрагмы. Патогномоничных клинических и лабораторных признаков специфического поражения печени нет: ни увеличение размеров органа, ни очаговые изменения в ней, ни повышение уровня щелочной фосфатазы, взятые в отдельности, не могут служить доказательством поражения органа. Достоверно вовлечение печени в опухолевый процесс устанавливается только при гистологическом исследовании биоптата печеночной ткани.
Столь же редко и также малосимптомно, как и поражение печени, встречается поражение костного мозга. Стойкая тенденция к лейкопении, тромбоцитопении и анемия у первичных больных служат основанием для предположения о вовлечении костного мозга. Вовлечение костного мозга при лимфоме Ходжкина подтверждается только при гистологическом исследовании материала, полученного при плановой трепанобиопсии подвздошной кости. Стернальная пункция в этих ситуациях не информативна, т.к. поражение носит очаговый характер.
Поражение ЦНС встречается крайне редко и характеризуется врастанием опухоли из лимфатических узлов по миелиновым оболочкам со сдавлением спинного мозга. В литературе имеются лишь единичные описания очагового поражения головного мозга. Остальные органы — почки, молочные железы, яичники, щитовидная железа и другие, вовлекаются крайне редко — 1–3%. Желудок, как правило, поражается вторично при прорастании из ретрогастральных лимфатических узлов.
Характерных изменений в анализах крови не отмечается. У части больных отмечается ускорение СОЭ, иногда — тенденция к нейтрофильному лейкоцитозу или лимфоцитопения. Из биохимических проб обращает на себя внимание повышение уровня фибриногена, альфа2-глобулина, гаптоглобина, церулоплазмина, ЩФ, которые, как и СОЭ, хотя и отражают активность процесса, но не являются специфическими. Повышение уровня ЛДГ встречается редко.
Приблизительно у 1/3 больных заболевание сопровождается симптомами интоксикации. Лихорадка чаще носит волнообразный характер и обусловлена повышением активности ПГЕ2, поэтому хорошо купируется его ингибиторами — НПВС (фенилбутазон, индометацин, диклофенак и др.). Проливные поты (преимущественно ночные) могут сопровождать лихорадку или возникать самостоятельно. Нередко к этим симптомам присоединяется прогрессирующее похудание и иногда мучительный до расчесов кожный зуд, который почти не контролируется симптоматическими средствами.
Современная клиническая классификация лимфомы Ходжкина создавалась радиологами в эпоху, когда основным методом лечения этой болезни была радикальная лучевая терапия — метод локального противоопухолевого воздействия. Впервые классификация была принята на международном симпозиуме в Ray в 1965 г. Дополнения вносились дважды: в 1971 г. — в Ann-Arbor и в 1989 г. — в Cotswald. Классификация отражает степень распространения опухоли. В основу ее положена гипотеза о постепенном распространении заболевания из первичного очага сначала лимфогенно в соседние, а затем в отдаленные участки лимфатической системы, и лишь впоследствии, путем гематогенной диссеминации — в нелимфоидные органы.
Международная клиническая классификация со всеми дополнениями представлена в таблице 1.
Таблица 1
Клиническая классификация лимфомы Ходжкина (Ann-Arbor, 1971 г., дополненнная в Cotswald, 1989 г.)
| Символ | Значение |
| Стадия I | Поражение одной лимфатической зоны или структуры (I) или локализованное поражение одного экстралимфатического органа или ткани (I E) в пределах одного сегмента. К лимфатическим структурам относятся лимфатические узлы, селезенка, вилочковая железа, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки |
| Стадия II | Поражение двух или более лимфатических зон по одну сторону диафрагмы (например, средостение — одна зона, корни легких — отдельные от средостения самостоятельные зоны); или локализованное поражение одного экстралимфатического органа или ткани и их регионарных лимфатических узлов с или без поражения других лимфатических областей по ту же сторону диафрагмы (II E). Для II стадии следует указывать число пораженных лимфатических зон, например, II 4 |
| Стадия III | Поражение лимфатических узлов или структур по обе стороны диафрагмы, которое может сочетаться с локализованным поражением одного экстралимфатического органа или ткани (III E) или с поражением селезенки (III S) или поражением того и другого (III E+S). Рекомендуется выделять верхние абдоминальные лимфатические узлы (в воротах печени, селезенки, чревные) — III 1 и нижние абдоминальные (парааортальные, мезентериальные) — III 2 |
| Стадия IV | Диссеминированное (многофокусное) поражение одного или нескольких экстралимфатических органов с или без поражения лимфатических узлов или изолированное поражение экстралимфатического органа с поражением отдаленных (не регионарных) лимфатических узлов. Поражение печени и/или костного мозга — всегда IV стадия |
| “А” | Симптомы интоксикации отсутствуют |
| “Б” — симптомы интоксикации* | Наличие одного или более из следующих симптомов: 1) повышение температуры выше 38 oC не менее 3 дней подряд без признаков воспаления; 2) ночные профузные поты; 3) похудение на 10% массы тела за последние 6 мес |
| “E” | Локализованное (в пределах одного сегмента) экстранодальное поражение (стадии I E, II E, III E) |
| “S” | Поражение селезенки (стадии I S, II S, III S) |
| МТИ | Медиастинально-торакальный индекс (МТИ) — отношение максимальной ширины срединной тени к диаметру грудной клетки в самом широком ее месте — на уровне Th5-6 на прямых рентгенограммах |
| “Х” | Массивные (“bulky”) поражения лимфатических узлов: медиастинальные лимфатические узлы, если МТИ больше или равно 1/3 или любые другие опухолевые массы диаметром >10 см |
| “CS” — clinical stage | Клиническая стадия устанавливается в результате подробного клинического обследования и диагностической биопсии лимфатического узла (или ткани) и костного мозга |
| “PS” — pathologic stage | Патологическая стадия подразумевает морфологическое подтверждение каждой локализации поражения, установленное в результате комплексного обследования с применением хирургических процедур. Наиболее часто под патологической стадией понимают стадию, установленную в результате лапаротомии со спленэктомией, биопсией печени и внутрибрюшных лимфатических узлов |
| “CR u” | “недоказанная/неуверенная полная ремиссия” (unconfirmed/uncertain complete remission) для обозначения сомнительной полной ремиссии, когда после окончания лечения определяются увеличенные до 1-1,5 см в диаметре лимфатические узлы |
* Кожный зуд исключен из симптомов интоксикации
При установлении стадии заболевания учитываются число пораженных лимфатических коллекторов, вовлечение нелимфоидных органов, наличие массивных очагов поражения и симптомов интоксикации.
В связи с признанием потенциальной излечимости лимфомы Ходжкина, эффективно лечеными стали считаться только те больные, у которых получена полная ремиссия (понятие “полная ремиссия” см. в конце главы). Частичная ремиссия и стабилизация процесса исключены из критериев эффективности лечения. Поэтому в Cotswald был введен еще один критерий “неуверенная полная ремиссия” — “CR u” (complete remission uncertain) для обозначения сомнительной полной ремиссии, когда после окончания лечения определяются увеличенные до 1–1,5 см в диаметре лимфатические узлы (см. табл. 1).
В соответствии с клинической классификацией больные лимфомой Ходжкина были разделены на две большие группы:
1) больные с ранними (early) стадиями, для которых на момент создания классификации радикальная лучевая терапия была методом выбора;
2) больные с распространенными (advanced) стадиями, для лечения которых использовалась полихимиотерапия или комбинированное химио-лучевое лечение.
Самое последнее дополнение в клиническую классификацию было внесено на V международном симпозиуме по лимфоме Ходжкина, проходившем в Кельне в 2001 г., и касалось разделения понятий “область” (area) и “зона” (region). Подробнее об этом будет сказано ниже в разделе о современной тактике лечения первичных больных лимфомой Ходжкина.
В четвертом издании Классификации злокачественных опухолей по системе TNM предлагается дополнительно устанавливать стадию рецидива опухоли. Целесообразность установления стадии рецидива у больных лимфомой Ходжкина обусловлена тем, что лечение поздних рецидивов высокоэффективно при использовании стандартных программ 1-й линии. Выбор программы лечения в этом случае осуществляется в соответствии со степенью распространенности опухоли при рецидиве. Рекомендуется обозначать стадию рецидива значком “R” или “r”. При этом необходимо указать сначала стадию с максимальным предшествующим распространением болезни, а затем, обозначив символом “r” — стадию рецидива. Например: Лимфома Ходжкина III 2 B S, R (r или “рецидив”) II 2 A. Полностью диагноз лимфомы Ходжкина рекомендуется писать с обозначением морфологического варианта, развернутой стадии с указанием зон поражения и их числа (для II стадии), а также с обозначением номера рецидива и времени его наступления (ранний/поздний). Например: Лимфома Ходжкина, вариант смешанно-клеточный, стадия III 2 В S с поражением медиастинальных, забрюшинных, подвздошных лимфатических узлов, селезенки, R 2-й поздний, стадия рецидива II 2 А с поражением надключичных, подмышечных лимфатических узлов слева. Подразделение рецидивов на ранние (развившиеся в первые 12 мес после окончания лечения) и поздние (развившиеся более чем через 12 мес после окончания лечения) имеет большое клиническое значение. Сроки развития рецидива определяют метод лечения и его интенсивность. Такое подробное оформление диагноза вызвано усилившейся в последнее время тенденцией к значительной индивидуализации лечения в зависимости от прогностических факторов, времени наступления рецидива, его распространенности и возможности повторного применения программ 1-й линии и лучевой терапии.
Одним из самых больших достижений онкологии второй половины ХХ в. стало излечение лимфомы Ходжкина. Без современной противоопухолевой терапии 5-летняя выживаемость при этом заболевании не превышает 5%, причем в течение первого года погибает половина больных. Современные программы лечения первой линии позволяют получить полные ремиссии у 70–90% первичных больных, и двадцатилетний рубеж переживают 60% из них.
Диагностика
Высокая курабельность лимфомы Ходжкина и индивидуализация лечения невозможны без достоверного диагноза, основанного на тщательном клиническом обследовании больного. Для максимально точного установления стадии, а также выбора адекватного лечения необходимо придерживаться единого плана обследования, который включает:
1) сбор анамнеза с обязательным уточнением наличия или отсутствия симптомов интоксикации (лихорадки, профузных ночных потов, похудания);
2) тщательный осмотр больного, пальпацию всех периферических лимфатических узлов (в т.ч. подключичных, локтевых и подколенных), пальпацию брюшной полости, в т.ч. печени, селезенки и области забрюшинных и подвздошных лимфатических узлов;
3) пункция, а затем обязательная адекватная биопсия пораженного лимфатического узла. При изолированном увеличении медиастинальных лимфатических узлов или лимфатических узлов брюшной полости и забрюшинного пространства необходимо прибегать к парастернальной медиастинотомии или лапаротомии соответственно. В последние годы в ряде клиник с этой целью стали применять методы эндоскопической хирургии. Следует помнить, что никаких клинических критериев для установления диагноза лимфомы Ходжкина не существует. У всех больных с подозрением на лимфому Ходжкина обязательна гистологическая (при необходимости — иммуногистохимическая) верификация диагноза;
4) обязательные лабораторные тесты, к которым относятся полный клинический анализ крови с исследованием числа лейкоцитов и с подсчетом лейкоцитарной формулы, уровня гемоглобина, тромбоцитов и скорости оседания эритроцитов и из биохимических проб — исследование уровня ЩФ, а также показателей, характеризующих функции печени и почек (креатинин, мочевина, общий белок и альбумин, трансаминазы, ЛДГ), при большой опухолевой массе желательно исследование уровня мочевой кислоты);
5) обязательным для всех больных является рентгенография грудной клетки. Для полноценной диагностики поражения лимфатических узлов средостения рентгеновские снимки должны быть выполнены в прямой и боковой проекциях. Это исследование позволяет уточнить состояние лимфатических узлов средостения, легочной ткани и плевры. При отсутствии изменений на рентгенограммах обязательна КТ грудной клетки, которая позволяет выявить невидимые на стандартных рентгеновских снимках медиастинальные лимфатические узлы. КТ грудной клетки также необходима и при массивном поражении лимфатических узлов средостения, т.к. позволяет обнаружить мелкие очаги в легочной ткани и прорастание в мягкие ткани грудной стенки, грудину, плевру и перикард. Флюорография не дает полноценной картины изменений лимфатических узлов средостения и легочной ткани и не может считаться современным адекватным методом диагностики у больных лимфомой Ходжкина;
6) УЗИ печени, селезенки, забрюшинных и внутрибрюшных лимфатических узлов, почек помогает исключить (или подтвердить) поражение этих органов. В сомнительных случаях показана КТ брюшной полости. Целесообразно также ультразвуковое исследование тех зон периферических лимфатических узлов, поражение которых при пальпации представляется сомнительным. Особенно это касается лимфатических узлов подключичных областей, трудных для пальпации, а также области щитовидной железы;
7) методы радиоизотопной диагностики позволяют выявить субклиническое поражение костной системы. Все зоны патологического накопления РФП, особенно если они совпадают с жалобами больного на боли в костях, требуют рентгенографического подтверждения. Сканирование с цитратом галлия (67Ga) — ценный метод для подтверждения поражения лимфатических узлов, однако наибольшее значение этот метод имеет при окончании лечения. У больных с исходно большими размерами средостения накопление индикатора в остаточных медиастинальных лимфатических узлах указывает на высокую степень риска развития раннего рецидива;
8) трепанобиопсия подвздошной кости (желательно билатеральная — с двух сторон) — обязательная процедура, т.к. является единственным методом, подтверждающим или исключающим специфическое поражение костного мозга.
При подозрении на поражение других органов необходимо прибегать к соответствующим методам исследования.
Следует остановиться еще на двух факультативных методах обследования. Фиброскопия верхних дыхательных путей с биопсией измененных структур помогает установить поражение кольца Вальдейера, произвести биопсию миндалины и провести дифференциальный диагноз с другими лимфомами, при которых эта локализация поражения встречается часто. МРТ имеет преимущество перед всеми методами диагностики при установлении поражения ЦНС. В последние годы активно входит в практику новый метод диагностики — позитронно-эмиссионная томография (ПЭТ) с использованием в качестве РФП короткоживущего изотопа 2-(fluorine–18)fluoro–2-deoxy-D-glucose-18F-FDG. Этот метод может использоваться до лечения для уточнения объема поражения и выявления субклинических очагов. Однако наибольшее значение при лимфоме Ходжкина ПЭТ имеет для подтверждения полноты ремиссии и предсказания рецидива, особенно в случае наличия остаточных опухолевых масс. Чувствительность и специфичность ПЭТ оказалась намного выше всех остальных неинвазивных методов.
Необходимо еще раз подчеркнуть, что тщательное выполнение плана обследования больного лимфомой Ходжкина в полном объеме во многом определяет успех программы лечения в целом.
Лечение
Хирургический метод самостоятельного значения при лечении лимфомы Ходжкина не имеет. Диагностическая лапаротомия со спленэктомией и биопсией внутрибрюшных лимфатических узлов и печени в настоящее время почти полностью утеряла свое значение в связи с широким внедрением УЗТ, КТ и преимущественным использованием комбинированных химиолучевых программ. Эта операция применяется только в диагностически сложных ситуациях, когда нет другой возможности получить достаточный для гистологического исследования материал. Удаление даже пораженной селезенки не является лечебным мероприятием, т.к. не улучшает ни непосредственных, ни отдаленных результатов лечения лимфомы Ходжкина, что доказано целым рядом крупных зарубежных и отечественных исследований. Кроме того, после спленэктомии возрастает частота стафилококковых инфекций, нередко имеющих молниеносное течение и приводящих к гибели излеченных от лимфомы Ходжкина больных. Крайне тяжелое течение инфекций после спленэктомии отмечается у детей до 10 лет.
Радикальная лучевая терапия длительное время была основным методом лечения I-III стадий лимфомы Ходжкина. В настоящее время этот метод используется отдельными клиниками лишь в группе больных с начальными стадиями и очень благоприятным прогнозом. Это небольшая группа больных с IA — IIА стадиями лимфомы Ходжкина, преимущественно женщины моложе 40 лет, без факторов риска. Полные ремиссии при использовании радикальной лучевой терапии удается получить у 93–95% этих больных, 5-летнее безрецидивное течение достигает 80–82%, а 15-летняя общая выживаемость — 93–98%. Однако уже у больных с I, IIА и Б стадиями, но с наличием факторов риска, и у больных с III А стадией 5–7-летняя безрецидивная выживаемость при использовании только радикальной лучевой терапии достигает лишь 43–53%, а общая выживаемость сохраняется высокой исключительно за счет эффективной химиотерапии рецидивов. Лучевая терапия в самостоятельном режиме используется в РОД 1,5–2,0 Гр. В зонах клинических проявлений болезни СОД достигает 40–45 Гр, а в зонах профилактического облучения — 30–35 Гр. В России обычно используется методика широкопольного облучения. Рецидивы после лучевой терапии чаще возникают в новых зонах, т.е. вне зон облучения.
Химиотерапия
На протяжении почти полувека схема MOPP и ее модификации, схема ABVD, а также сочетание или чередование этих схем оставались основными программами первой линии для больных лимфомой Ходжкина. Замена Мустаргена на хлорамбуцил или циклофосфамид в схеме МОРР не изменила непосредственных и отдаленных результатов лечения, но снизила непосредственную токсичность — эметогенную и гематологическую. За последнее десятилетие были опубликованы результаты нескольких крупных рандомизированных исследований, в которых убедительно было показано преимущество схемы ABVD перед схемой МОРР и ее аналогами по отдаленным результатам лечения и поздней токсичности (бесплодие, миелоидные лейкозы). На V международном симпозиуме по лимфоме Ходжкина в 2001 г. программа ABVD была признана “золотым стандартом” для первичных больных с благоприятным и промежуточным прогнозом.
Схемы 1-й линии:
I. Наиболее предпочтительная схема: ABVD.
II. Альтернативные схемы (широко применялись в мире до конца прошлого века, однако в настоящее время все большее число клиник отказываются от использования этих программ): МОРР, МVРР, CVPP, CОPP, СhlVPP (LVPP), МОРР/ABV.
По аналогичному принципу построены схемы CVPP/ABV и СОРР/ABV.
При применении только цикловой полихимиотерапии у больных в любой стадии лимфомы Ходжкина лечение следует проводить до достижения полной ремиссии. Затем необходимо провести, как минимум, еще два цикла лечения по той же схеме с целью консолидации (закрепления) полученного эффекта. Полная ремиссия после 3 циклов полихимиотерапии у больных с ранними (I-II) стадиями достигается не более чем в 50% случаев, а при распространенных стадиях заболевания у того же числа пациентов — только после 6 циклов. Поэтому необходимый минимум всей программы лечения составляет не менее 6 циклов, но может быть увеличен и до 12.
При использовании только полихимиотерапии полные ремиссии достигаются у 70–85% больных, а 20-летняя безрецидивная выживаемость составляет 60%. У 40% больных развиваются рецидивы. После полихимиотерапии рецидивы чаще отмечаются в исходных зонах поражения, а после лучевой терапии — преимущественно в новых зонах, вне полей облучения.
Таблица 2
Основные режимы лекарственной терапии лимфомы Ходжкина
| Комбинация | Лекарственное средство, доза и режим лечения |
| ABVD | Доксорубицин — по 25 мг/м2, в/в, в 1 и 14 дни, Блеомицин — по 10 мг/м2, в/в, в 1 и 14 дни, Винбластин — по 6 мг/м2, в/в, в 1 и 14 дни, Дакарбазин — по 375 мг/м2, в/в, в 1 и 14 дни. Перерыв между циклами 14 дней |
| MOPP | Мустарген — по 6 мг/м2, в/в, в 1 и 8 дни, Винкристин — по 1,4 мг/м2 (максимум — 2 мг/м2), в/в, в 1 и 8 дни, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 14 день ежедневно, Преднизолон — по 40 мг/м2, внутрь, с 1 по 14 день ежедневно. Перерыв между циклами 2 нед |
| MVPP | Мустарген — по 6 мг/м2, в/в, в 1 и 8 дни, Винбластин — по 6 мг/м2 (максимум 10 мг/м2), в/в, в 1 и 8 дни, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 14 день ежедневно, Преднизолон — по 40 мг/м2, внутрь, с 1 по 14 день ежедневно. Перерыв между циклами 3-4 нед |
| CVPP | Циклофосфамид — по 650 мг/м2, в/в, в 1 и 8 дни, Винбластин — по 6 мг/м2 (максимум 10 мг/м2), в/в, в 1 и 8 дни, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 14 день ежедневно, Преднизолон — по 40 мг/м2, внутрь, с 1 по 14 день ежедневно в 1 и 4 циклах. Перерыв между циклами 2 нед |
| COPP | Циклофосфамид — по 650 мг/м2, в/в, в 1 и 8 дни, Винкристин — по 1,4 мг/м2 (максимум 2 мг/м2), в/в, в 1 и 8 дни, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 14 день ежедневно, Преднизолон — по 40 мг/м2, внутрь, с 1 по 14 день ежедневно. Перерыв между циклами 2 нед |
| ChIVPP (LVPP) | Хлорамбуцил — по 6 мг/м2 (максимум 10 мг/м2), внутрь, с 1 по 14 день ежедневно, Винбластин — по 6 мг/м2 (максимум 10 мг/м2), в/в, в 1 и 8 дни, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 14 день ежедневно, Преднизолон — по 40 мг/м2, внутрь, с 1 по 14 день ежедневно. Перерыв между циклами 3-4 нед |
| MOPP/ABV | Мустарген — 6 мг/ м2 в/в в 1 день, Винкристин — 1,4 мг/м2 (максимум 2 мг/м2), в/в, в 1 день, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 7 день ежедневно, Преднизолон — по 40 мг/м2, внутрь, с 1 по 14 день ежедневно, Доксорубицин — 35 мг/м2, в/в, в 8 день, Блеомицин — 10 мг/м2, в/в, в 8 день, Винбластин — 6 мг/м2, в/в, в 8 день. Перерыв между циклами 2 нед |
Эти наблюдения послужили основанием для совмещения в одной программе полихимиотерапии и лучевого воздействия на опухоль. Такой подход не только улучшил общую выживаемость больных лимфомой Ходжкина, но и позволил в 3–4 раза сократить число рецидивов (с 40% до 10–12%).
В последние два десятилетия комбинированное химиолучевое лечение стало методом выбора для абсолютного большинства первичных больных лимфомой Ходжкина. Основным принципом лечения стал тезис: “Объем лечения соответствует объему поражения”.
При определении тактики и объема лечения больных лимфомой Ходжкина, кроме стадии и симптомов интоксикации, учитывается целый ряд прогностических признаков, так называемых факторов риска. Последние в большей или меньшей степени определяют прогноз заболевания. Большинство клиник используют факторы риска, выделенные Германской группой по изучению лимфомы Ходжкина (GHLG — German Hodgkin’s Lymphoma Group). К ним относятся:
- массивное поражение лимфатических узлов средостения (МТИ ≥0,33);
- поражение 3 или более областей лимфатических узлов;
- СОЭ ≥30 мм/ч при наличии симптомов интоксикации — Б и СОЭ ≥50 мм/ч при отсутствии симптомов интоксикации — А;
- экстранодальное поражение в пределах, обозначаемых символом Е.
В связи с тем, что понятие “поражение 3-х и более областей лимфатических коллекторов” трактовалось разными исследователями по-разному, на V международном симпозиуме по лимфоме Ходжкина в 2001 г. было обращено особое внимание на различие терминов “area” — область и “region” — зона. Было уточнено, что термин “зона” (region) используется для обозначения анатомических зон, по которым устанавливается стадия заболевания в соответствии с классификацией, принятой в Ann-Arbor. Термин “область” (area) — более широкое понятие. Область может включать в себя одну или более зон:
А. Правые шейные + правые над— и подключичные лимфатические узлы.
Б. Левые шейные + левые над— и подключичные лимфатические узлы.
В. Лимфатические узлы правого/левого корней легких + медиастинальные.
Г. Правые аксилярные лимфатические узлы.
Д. Левые аксилярные лимфатические узлы.
Е. Верхние абдоминальные лимфатические узлы: чревные + ворот печени + ворот селезенки + селезенка.
Ж. Нижние абдоминальные лимфатические узлы: парааортальные + мезентериальные.
З. Правые подвздошные лимфатические узлы.
И. Левые подвздошные лимфатические узлы.
К. Правые паховые + правые бедренные лимфатические узлы.
Л. Левые паховые + левые бедренные лимфатические узлы (рис. 5).

Рисунок 5. Зоны (слева) для определения объема поражения при установлении стадии лимфомы Ходжкина и области (справа) для определения прогностической группы
В зависимости от исходных факторов риска, стадии и наличия или отсутствия симптомов интоксикации выделяются три большие прогностические группы: больные с благоприятным, промежуточным и неблагоприятным прогнозом. Необходимо особо подчеркнуть, что стадия и симптомы интоксикации по-прежнему остаются важными признаками для прогноза заболевания и выбора программы лечения. Однако они перестали быть единственно определяющими лечебную тактику.
Прогностические группы:
1) благоприятная:
— больные с IA и IIA стадиями лимфомы Ходжкина без факторов риска;
2) промежуточная:
а) больные с IА и IБ стадиями и факторами риска:
— экстранодальное поражение в пределах стадии Е,
— СОЭ ≥30 мм/ч при наличии симптомов интоксикации — Б,
— СОЭ ≥50 мм/ч при отсутствии симптомов интоксикации — А;
б) больные со IIА стадией и факторами риска:
— экстранодальное поражение в пределах стадии Е,
— СОЭ ≥50 мм/ч при отсутствии симптомов интоксикации — А,
— поражение трех и более областей лимфатических коллекторов;
в) больные со IIБ стадией и факторами риска:
— СОЭ ≥30 мм/ч при наличии симптомов интоксикации — Б,
— поражение трех и более зон лимфатических коллекторов;
3) неблагоприятная:
а) больные с IА, IБ и IIА стадиями с массивным поражением лимфатических узлов средостения — МТИ ≥0,33,
б) больные со IIБ стадией и факторами риска:
— массивное поражение лимфатических узлов средостения — МТИ ≥0,33,
— экстранодальное поражение в пределах стадии Е;
в) все больные с III и IV стадиями.
Для включения больного в любую прогностическую группу достаточно наличия хотя бы одного из перечисленных факторов риска.
В экономически развитых странах и наиболее благополучных по медицинскому обслуживанию регионах России почти две трети больных обращаются за медицинской помощью в начальных стадиях заболевания. Именно этот контингент больных формирует благоприятную и промежуточную прогностические группы.
Лечение больных благоприятной прогностической группы
В этой группе предпочтительна сокращенная программа лечения, которая включает 4 цикла полихимиотерапии по схеме ABVD, а затем — облучение только зон исходного поражения в СОД, не превышающей 36 Гр. Лучевая терапия должна быть начата на 14 день после последнего (восьмого) введения химиопрепаратов, но не позже 21 дня. Проводится облучение зон исходного поражения в режиме: ежедневное облучение 5 дней в неделю, РОД 1,8 — 2,0 Гр до СОД не более 36 Гр. На зоны исходно больших конгломератов периферических лимфатических узлов (диаметром более 6 см) СОД может быть доведена до 40 Гр. Длительность программы лечения при 4 циклах ABVD + лучевая терапия достигает 20 нед.
В отдельных случаях могут использоваться другие схемы 1-й линии. При небольших исходных размерах лимфатических узлов и достижении полной ремиссии до начала лучевой терапии суммарная очаговая доза может быть снижена до 30–32 Гр. Рекомендованная выше программа лечения позволяет получить 98% полных ремиссий, 6-летнее безрецидивное течение составляет 94% и 6-летняя общая выживаемость достигает 98% — 100%.
Манчестерская исследовательская группа предложила для больных благоприятной прогностической группы новую программу лечения — VAPEC-B. Эта программа по эффективности аналогична стандартным. Однако программа Манчестерской группы интересна тем, что она очень короткая, полностью выполняется всего за 10 нед, состоит из 4 нед полихимиотерапии по схеме VAPEC-B с последующей лучевой терапией на зоны исходного поражения. Вся программа вдвое короче программы 4 цикла ABVD + облучение зон исходного поражения. В программу VAPEC-B включено 6 наиболее активных базисных препаратов первой линии. Лечение проводится в непрерывном режиме. Общая токсичность программы в целом снижается за счет низкой кумулятивной дозы каждого препарата в отдельности.
VAPEC-B: винкристин — по 1,4 мг/м2, в/в, в 8 и 22 дни; доксорубицин — 35 мг/м2, в/в, в 1 и 15 дни; преднизолон — 50 мг внутрь, 1–28 дни ежедневно (снижение дозы преднизолона до полной отмены в течение 10 дней, начиная с 5 нед); этопозид — 100 мг/м2, в/в, в 15–19 дни ежедневно; циклофосфамид — 350 мг/м2, в/в, в 1 день; блеомицин — 10 мг/м2, в/в, в 8 и 22 дни.
Лучевая терапия на зоны исходного поражения начинается на 42 день, но не позднее 49 и проводится в том же режиме и объеме, что и в программе ABVD (см. выше).
Необходимо особо подчеркнуть, что даже у больных благоприятной прогностической группы комбинированное химиолучевое лечение имеет значительные преимущества перед радикальной лучевой терапией.
Лечение больных промежуточной прогностической группы
Для лечения этих больных необходим больший объем терапии. Самой распространенной программой является комбинация из 6 циклов полихимиотерапии ABVD (или, все реже и реже, по одной из других схем 1-й линии) и последующего облучения зон исходного поражения в СОД 30–36 Гр (но не более 40 Гр). Следует особо подчеркнуть, что, как и в предыдущих программах, интервал от последнего дня химиотерапии до первого дня лучевого воздействия должен составлять 14 дней, но не более 21. В последнее десятилетие и в этой группе больных на зоны исходного поражения используются суммарные дозы лучевой терапии, не превышающие 30–36 Гр. Только зоны исходно больших конгломератов лимфатических узлов облучаются в дозе 40 Гр. Такая программа лечения позволяет получить 93–98% полных ремиссий при 79–90% 6-летней безрецидивной выживаемости и 85–91% 6-летней общей выживаемости. По данным крупных международных рандомизированных исследований, а также данным ГУ РОНЦ им. Н.Н. Блохина РАМН непосредственные и отдаленные результаты лечения по этим программам не отличаются от результатов программ с облучением всех лимфатических коллекторов выше диафрагмы. Использование программ с меньшим объемом облучения требует обязательного полного обследования в клинике, оснащенной современной диагностической аппаратурой, включая компьютерный томограф. Выполнение полного объема обследования необходимо для уточнения зон планируемой лучевой терапии. Недостаточный объем обследования при использовании современных программ лечения приводит к снижению результатов терапии.
Лечение больных неблагоприятной прогностической группы
С середины 60-х гг. XX в., когда впервые была предложена полихимиотерапия по схеме МОРР, и до начала 90-х существенных успехов в лечении этой группы больных достигнуто не было. При применении стандартных схем полихимиотерапии первой линии типа МОРР или ABVD частота ремиссий составляла 60–80%, а 5–7-летняя выживаемость не превышала 70%.
Предпринятые в 80-е гг. XX в. попытки интенсификации терапии путем соединения или чередования двух наиболее эффективных схем терапии первой линии МОРР и ABVD не повысили непосредственной эффективности и не улучшили отдаленных результатов лечения.
В середине 90-х гг. был предложен новый принцип интенсификации лечения больных лимфомой Ходжкина с неблагоприятным прогнозом за счет сокращения интервалов между курсами полихимиотерапии, включения этопозида в схемы 1-й линии и последующего облучения зон массивного поражения и/или остаточных опухолевых масс в сниженных до 30–36 Гр СОД. Внедрение в клиническую практику лекарственных препаратов на основе колониестимулирующих факторов (G-CSF — филграстим, ленограстим) создало благоприятные возможности для такой интенсификации. Было предложено несколько программ, среди которых наибольшее распространение получила программа BEACOPP в сочетании с лучевой терапией.
BEACOPP-базовый: циклофосфамид — 650 мг/м2, в/в, в 1 день; доксорубицин — 25 мг/м2, в/в, в 1 день; этопозид — 100 мг/м2, в/в, в 1–3 дни ежедневно; прокарбазин — 100 мг/м2, внутрь, в 1–7 дни; преднизолон — 40 мг/м2, внутрь, в 1–14 дни ежедневно; винкристин — 1,4 мг/м2, в/в, в 8 день; блеомицин — 10 мг/м2, в/в, в 8 день. Цикл повторяется на 22 день, считая от первого дня цикла.
После 8 циклов BEACOPP в случае уменьшения опухолевой массы более чем на 50–70% проводится лучевая терапия в дозе 30–36 Гр на остаточные лимфатические узлы и/или зоны исходно больших опухолевых масс.
При отсутствии прокарбазина в схеме BEACOPP возможно использование дакарбазина в дозе 375 мг/м2, в/в, капельно в 1 день лечения. Такая замена вполне допустима, т.к. после метилирования и ряда неферментативных преобразований оба препарата превращаются в метилдиазоний, который и является действующим агентом.
Частота полных ремиссий на программах типа BEACOPP превышает 90%, а 5-летняя безрецидивная выживаемость достигает 80–85% при общей 5-летней выживаемости до 85% — 96%.
Международное, многоцентровое рандомизированное исследование выявило статистически значимое преимущество эффективности лечения в группе больных лимфомой Ходжкина, получавших терапию по программе BEACOPP ± лучевую терапию по сравнению с больными, получавшими лечение по схеме CОPP/ABVD с аналогичным объемом облучения. Свободная от неудач лечения (FFTF) 2-летняя выживаемость составила 72 и 81% соответственно (p<0,05); 2-летняя общая выживаемость (OS) — 89% и 94%.
Аналогичные данные были получены и в ГУ РОНЦ им. Н.Н. Блохина РАМН при сравнении программы BEACOPP с программой CVPP (исторический контроль): 2-летняя выживаемость, свободная от неудач лечения, составила 75 и 54% соответственно (p<0,05), а частота рецидивов 11 и 23% (p<0,05). Необходимо отметить хорошую переносимость терапии по схеме BEACOPP, что позволило проводить лечение в амбулаторных условиях у 80% больных.
Использование современных интенсивных программ терапии у больных лимфомой Ходжкина исключило необходимость применения поддерживающего лечения в любом виде, т.к. оно не предотвращает развития рецидивов. Кроме того, длительная поддерживающая терапия увеличивает риск вторичных миелоидных лейкозов.
Монохимиотерапия в настоящее время практически не используется. Крайне редко возможно ее применение исключительно в качестве паллиативной меры у ослабленных больных пожилого возраста или у больных с гипоплазией костного мозга после многочисленных курсов химиотерапии. В монорежиме может быть использован любой противоопухолевый агент. Эффективность монохимиотерапии при лимфоме Ходжкина невысока — 15–30% полных ремиссий у первичных больных, однако она нередко обеспечивает довольно длительное, удовлетворительное самочувствие и сдерживание прогрессирования лимфомы Ходжкина у тех больных, которым проведение современной терапии по разным причинам невозможно.
Лечение рецидивов
При использовании современных программ лечения рецидивы развиваются у 10–15% больных. Из общего числа рецидивов половина возникает в 1 год после окончания лечения, еще 20–25% — в течение второго года, остальные рецидивы возникают позже без каких-либо закономерностей.
Легче всего поддаются повторному лечению рецидивы лимфомы Ходжкина, возникшие после радикальной лучевой терапии и поздние рецидивы, развившиеся после многолетних ремиссий. Частота повторных, полных ремиссий при рецидивах после радикальной лучевой терапии составляет 90% при использовании любого режима полихимиотерапии 1-й линии. В результате длительная, 5 и более лет, безрецидивная выживаемость у этих больных достигает 60–70%.
Больных с рецидивами после полихимиотерапии или комбинированного химиолучевого лечения можно разделить на две группы:
1) больные, у которых первая полная ремиссия сохранялась более года (поздний рецидив);
2) больные, у которых первая полная ремиссия сохранялась менее 1 года (ранний рецидив).
Медиана выживаемости после рецидива составляет в этих группах 4,3 и 2,6 года соответственно. При использовании химиотерапии 1-й линии повторные полные ремиссии у больных с 1 поздним рецидивом достигаются в 75–85% случаев, а у больных с 1 ранним рецидивом — лишь в 10–15%. Пережить 20-летний рубеж после повторного лечения в группе больных с 1 полной ремиссией продолжительностью более 1 года могут 24% больных. Достоверно меньше (лишь 11%) в группе с 1 полной ремиссией, длившейся менее 1 года.
К больным с ранними рецидивами примыкает группа с первично-резистентным течением лимфомы Ходжкина (больные, не достигшие полной ремиссии после 1 программы лечения). Медиана выживаемости после окончания лечения в этой группе больных самая короткая и составляет лишь 1,3 года. Лечение этих больных наименее эффективно.
При лечении поздних рецидивов, развившихся после нескольких лет полной ремиссии, используются те же принципы диагностики и терапии, что и у первичных больных, включая повторную биопсию. Выбор программы лечения зависит от стадии рецидива и прогностических признаков, определяемых теми же диагностическими методами, что и при первичном обследовании. Однако необходимо учитывать выраженность токсических осложнений предыдущей программы лечения. Частота повторных полных ремиссий в группе больных с поздними рецидивами достигает 75%, а 10-летнее безрецидивное течение в группе с повторной полной ремиссией — 45%. Однако общая выживаемость почти вдвое ниже из-за поздних осложнений терапии — вторичных миелоидных лейкозов, других опухолей и иных осложнений, связанных с лечением.
Применение схем 2-й линии (B-CAV, CEP, CEVD, ABDIC, Dexa-BEAM и др.) позволяет увеличить частоту полных ремиссий у больных с ранними рецидивами лимфомы Ходжкина с 11% до 25–50%, однако 3-летнее безрецидивное течение не превышает 10–30%.
За последние тридцать лет предложено большое количество схем второй линии. Однако ни одна из них существенно не улучшила безрецидивную выживаемость больных с ранними рецидивами.
<
Схемы 2-й линии:
— В-CAV (блеомицин + ломустин + доксорубицин + винбластин).
— CEP (ломустин + этопозид + преднимустин).
Преднимустин — гормоноцитостатик. По химическому строению — эфир хлорамбуцила и преднизолона. Препарат сохраняет алкилирующую активность хлорамбуцила и лимфоцитолитическую активность преднизолона.
— ABDIC (доксорубицин + блеомицин + дакарбазин + преднизолон + ломустин).
Так как у большинства больных с множественными рецидивами с течением времени становится затрудненным доступ к периферическим венам, приводится несколько схем второй линии, когда все препараты, включенные в схему, принимаются внутрь.
Схемы с пероральным применением химиопрепаратов:
— СЕР (пероральная модификация) (ломустин + этопозид + хлорамбуцил + преднизолон).
— CEM (ломустин + этопозид + метотрексат).
— CAVP (ломустин + мелфалан + этопозид + преднизолон).
Таблица 3
Основные режимы 2-й линии лекарственной терапии лимфомы Ходжкина
| Комбинация | Лекарственное средство, доза и режим лечения |
| B-CAV | Блеомицин — по 5 мг/м2, в/в, в 1, 28, 35 дни; Ломустин — 100 мг/м2, внутрь натощак, в 1 день; Доксорубицин — 60 мг/м2, в/в, в 1 день; Винбластин — 6 мг/м2, в/в, в 1 день. Цикл возобновляется на 42 день |
| CEP | Ломустин — 80 мг/м2, внутрь натощак, в 1 день; Этопозид — по 100 мг/м2, в/в, капельно с 1 по 5 день ежедневно; Преднимустин — по 60 мг/м2, внутрь, с 1 по 5 день ежедневно; Цикл возобновляется на 28 день |
| ABDIC | Доксорубицин — 45 мг/м2, в/в, в 1 день; Блеомицин — по 5 мг/м2, в/в, с 1 по 5 день ежедневно; Дакарбазин — по 200 мг/м2, в/в, с 1 по 5 день ежедневно; Преднизолон — по 40 мг/м2, внутрь, с 1 по 5 день ежедневно; Ломустин — по 50 мг/м2, внутрь натощак, в 1 день. Цикл возобновляется на 28 день |
| CEP (пероральная модификация) | Ломустин — 100 мг/м2, внутрь натощак, в 1 день; Этопозид — по 200 мг/м2, внутрь, с 1 по 3 день ежедневно; Хлорамбуцил — по 20 мг/м2, внутрь, с 1 по 4 день ежедневно; Преднизолон — по 40 мг/м2, внутрь, с 1 по 7 день ежедневно. Цикл возобновляется на 28-35 день |
| CEM | Ломустин — 100 мг/м2, внутрь натощак, в 1 день; Этопозид — по 100 мг/м2, внутрь, с 1 по 3 день ежедневно и с 21 по 23 дни ежедневно; Метотрексат — по 30 мг/м2, внутрь, в 1, 8, 21, 28 дни. Цикл возобновляется на 42 день |
| CAVP | Ломустин — 90 мг/м2, внутрь натощак, в 1 день; Мелфалан — по 7,5 мг/м2, внутрь, с 1 по 5 дни ежедневно; Этопозид — по 100 мг/м2, внутрь, с 6 по 10 день ежедневно; Преднизолон — по 40 мг/м2, внутрь, с 1 по 10 день ежедневно. Цикл возобновляется на 42 день |
Высокодозная химиотерапия (ВДХ)
Результаты лечения первично-резистентных больных лимфомой Ходжкина, а также больных с 1 ранним и повторными рецидивами при использовании стандартных схем 1-й и 2-й линии сегодня признаются неудовлетворительными. Новый подход к лечению рецидивов этого заболевания и преодолению первичной резистентности стал возможен в связи с развитием методики высокодозной химиотерапии с последующей пересадкой аутологичных клеток предшественников кроветворения. Эта методика в последние 2 десятилетия все шире используется для лечения больных лимфомой Ходжкина. Основными показаниями для высокодозной химиотерапии являются первый ранний и второй рецидивы.
В последнее время подвергается сомнению целесообразность применения метода ВДХ у первично-резистентных больных и больных в 3 и последующих рецидивах. Это связано с неудовлетворительными результатами ВДХ в этих группах больных.
Методика ВДХ предполагает лечение в 2 этапа. На первом — проводится индукционная цикловая полихимиотерапия по одной из схем 2-й линии. Наиболее часто используется схема Dexa-BEAM. В последние годы для этой же цели предложены схемы DHAP, ASHAP и др.:
— Dexa-BEAM (дексаметазон + кармустин + мелфалан + этопозид + цитарабин + колониестимулирующие факторы);
— DHAP (дексаметазон + цитарабин + цисплатин);
— ASHAP (доксорубицин + цисплатин + цитарабин + метилпреднизолон).
После 1–2 индукционных циклов, при достижении частичной или полной регрессии опухоли проводится мобилизация клеток-предшественников кроветворения колониестимулирующими факторами. Затем осуществляется сбор клеток-предшественников кроветворения из периферической крови и/или эксфузия костного мозга. После этого проводится второй — высокодозный этап лечения.
Наиболее распространенными режимами собственно высокодозного лечения являются схемы BEAM и CBV:
— BEAM (кармустин + этопозид + цитарабин + мелфалан),
— CBV (циклофосфамид + этопозид + кармустин).
Таблица 4
Основные режимы высокодозной химиотерапии лимфомы Ходжкина
| Комбинация | Лекарственное средство, доза и режим лечения |
| Dexa-BEAM | Дексаметазон — по 8 мг внутрь с 1 по 10 день ежедневно 3 раза в сутки, Кармустин — 60 мг/м2, в/в капельно, во 2 день, Мелфалан — 20 мг/м2, в/в капельно, в 3 день, Этопозид — по 200 мг/м2, в/в капельно, с 4 по 7 день ежедневно, Цитарабин — по 100 мг/м2, в/в капельно, с 4 по 7 день ежедневно каждые 12 ч, Колониестимулирующие факторы — с 8 по 18 день ежедневно. Цикл возобновляется на 28 день. После 2 циклов проводится высокодозный этап |
| DHAP | Дексаметазон — по 40 мг/м2 , в/в капельно, с 1 по 5 день ежедневно, Цитарабин — 2000 мг/м2, в/в капельно, во 2 день 2 раза в сутки 3-часовая инфузия, Цисплатин — 100 мг/м2, в/в, 24-часовой непрерывной инфузией в 1 день. Цикл возобновляется на 21-28 день. После 2 циклов проводится высокодозный этап |
| ASHAP | Доксорубицин — по 10 мг/м2, в/в, 24-часовой непрерывной инфузией с 1 по 4 день ежедневно, Цисплатин — по 25 мг/м2, в/в, 24-часовой непрерывной инфузией с 1 по 4 день ежедневно, Цитарабин — по 1500 мг/м2, в/в, 2-часовой непрерывной инфузией в 5 день, Метилпреднизолон — по 500 мг/м2, в/в, 15-минутной инфузией с 1 по 5 день ежедневно. Цикл возобновляется на 21-28 день. После 2 циклов проводится высокодозный этап |
| BEAM | Кармустин — 300 мг/м2 , в/в, в 1 день, Этопозид — по 100-200 мг/м2, в/в, со 2 по 5 день ежедневно, Цитарабин — по 200-400 мг/м2, в/в, со 2 по 5 день ежедневно, Мелфалан — 140 мг/м2, в/в, в 6 день. Возвращение клеток предшественников кроветворения периферической крови и/или аутомиелотрансплантация производятся на 7 день |
| CBV | Циклофосфамид — по 2 г/м2, в/в, со 2 по 4 день ежедневно, Этопозид — по 500 мг/м2, в/в, со 2 по 4 день ежедневно, Кармустин — по 300 мг/м2, в/в, в 1 день. Возвращение клеток предшественников кроветворения периферической крови и/или аутомиелотрансплантация производятся на 5 день |
Высокодозное лечение может проводиться только в специализированных клиниках, где организованы палаты с ламинарным током стерильного воздуха и имеется специально обученный персонал.
Высокодозная химиотерапия с транплантацией аутологичных гемопоэтических стволовых клеток позволила увеличить число полных ремиссий с 40% до 60–80%, а 3-летнюю безрецидивную выживаемость с 10% до 40–60%. Аналогичные результаты высокодозного лечения в этой группе больных получены и в ГУ РОНЦ им Н.Н. Блохина РАМН. Различий в 5-летней общей выживаемости выявить не удалось. Во многом это связано с тем, что после неудачного лечения по одной из схем второй линии большинство больных впоследствии дополнительно получили ВДХ.
При лечении повторных рецидивов, в зависимости от времени их возникновения, используются схемы как первой, так и второй линии. Однако каждый последующий рецидив снижает шансы больного на долговременную выживаемость: 10-летний рубеж переживают менее 10% больных с четвертым рецидивом лимфомы Ходжкина.
Лимфома Ходжкина у пожилых больных
Течение лимфомы Ходжкина у больных старших возрастных групп имеет свои особенности. Это связано с поздним обращением и, как правило, недостаточным обследованием вследствие отказа больных и врачей от необходимого объема исследований. Кроме того, на объем обследования и выбор адекватной терапии нередко влияет наличие сопутствующих и конкурирующих тяжелых заболеваний. Эффективность монохимиотерапии, а также полихимиотерапии в сниженных дозах невысока. С другой стороны, при адекватном обследовании и применении современных программ лечения и у больных старше 60 лет можно получить до 70–80% полных ремиссий. В таких случаях у больных с начальными стадиями 5-летняя выживаемость достигает 90%. Однако у 20% больных наличие сопутствующих заболеваний не позволяет провести полный объем терапии. Лечение этого контингента больных требует значительно большего объема сопроводительной терапии и внимания врача. При проведении цитостатической терапии у пожилых больных необходимо шире использовать симптоматическую терапию, а также проводить лечение сопутствующих заболеваний и осложнений.
Таблица 5
Основные режимы лекарственной терапии лимфомы Ходжкина для пожилых больных
| Комбинация | Лекарственное средство, доза и режим лечения |
| PCOM | Хлорамбуцил — по 10 мг, внутрь, с 1 по 15 дни ежедневно, Митоксантрон — 10 мг/м2, в/в, в 1 день, Винкристин — 2 мг, в/в, в 15 день, Этопозид — по 100 мг/м2, в/в, в 15 день, внутрь — 16 и 17 дни, Преднизолон — по 40 мг, внутрь, с 1 по 15 день. Цикл возобновляется через 2-3 нед после восстановления количества лейкоцитов и тромбоцитов |
| CVP/CEB | Хлорамбуцил — по 6 мг/м2, внутрь, с 1 по 7 день ежедневно, Винбластин — 6 мг/м2, в/в, в 1 день, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 7 день ежедневно, Преднизолон — по 30 мг, внутрь, с 1 по 7 день ежедневно, Циклофосфамид — 500 мг/м2, в/в, в 15 день, Этопозид — 70 мг/м2, в/в, в 15 день, Блеомицин — 10 мг/м2, в/в, в 15 день. Цикл возобновляется через 2-3 нед после восстановления количества лейкоцитов и тромбоцитов |
| VEPEMB | Винбластин — 6 мг/м2, в/в, в 1 день, Циклофосфамид — по 500 мг/м2, в/в, в 1 день, Прокарбазин — по 100 мг/м2, внутрь, с 1 по 5 день ежедневно, Преднизолон — по 30 мг, внутрь, с 1 по 5 день ежедневно, Этопозид — по 60 мг/м2, внутрь, с 15 по 19 день ежедневно, Митоксантрон — 6 мг/м2, в/в, в 15 день, Блеомицин — 10 мг/м2, в/в, в 15 день. Цикл возобновляется через 2-3 нед после восстановления количества лейкоцитов и тромбоцитов |
| VBM | Винбластин — по 6 мг/м2, в/в, в 1 и 8 день, Блеомицин — по 10 мг/м2, в/в, в 1 и 8 день, Метотрексат — по 30 мг/м2, в/в, в 1 и 8 день. Цикл возобновляется через 2-3 нед после восстановления количества лейкоцитов и тромбоцитов |
В последние годы разработаны и входят в практику противоопухолевого лечения ряд схем для больных старших возрастных групп.
<
Схемы полихимиотерапии для больных старших возрастных групп:
— РСОМ (хлорамбуцил + митоксантрон + винкристин + этопозид + преднизолон);
— CVP/CEB (хлорамбуцил + винбластин + прокарбазин + преднизолон + циклофосфамид + этопозид + блеомицин);
— VEPEMB (винбластин + циклофосфамид + прокарбазин + преднизолон + этопозид + митоксантрон + блеомицин);
— VBM (винбластин + блеомицин + метотрексат).
Качество жизни больных лимфомой Ходжкина
Реальная возможность выздоровления большого контингента молодых больных поставила перед врачами совершенно новую проблему — возможность беременности и родов у излечившихся от лимфомы Ходжкина женщин. В связи с этим возникла проблема защиты яичников от повреждающего воздействия химиопрепаратов, и в первую очередь от алкилирующих агентов. Способность комбинированных пероральных контрацептивов задерживать ооцит в фазе G0 клеточного цикла была использована для профилактики преждевременной недостаточности яичников у женщин, получающих химиолучевое лечение по поводу лимфомы Ходжкина. С целью защиты яичников при проведении химиотерапии назначаются гормональные препараты, подавляющие овуляцию (низкодозированные пероральные контрацептивы) — Регулон, Новинет и др. Подбор препаратов должен осуществлять гинеколог. Препараты назначаются обязательно до начала химиотерапии, и прием их осуществляется непрерывно весь период лечения. После окончания противоопухолевого лечения продолжается обычный цикловой прием комбинированных пероральных контрацептивов до восстановления нормального менструального цикла — не менее 4–6 мес. Отмена препарата согласовывается с гинекологом.
Как показал опыт ряда отечественных и зарубежных клиник, беременность и роды в период стойкой ремиссии не ухудшают прогноза болезни. Частота рецидивов лимфомы Ходжкина у женщин, рожавших в полной ремиссии, составляет только 14%, что не превышает частоты рецидивов в популяции больных с лимфомой Ходжкина в целом. Число рецидивов достоверно ниже (лишь 9%) в группе рожавших женщин, находившихся в полной ремиссии до беременности более 3 лет. Однако этот показатель достигает 44% в группе женщин, рожавших в первые 3 года ремиссии. Таким образом, следует предупреждать женщин о нежелательности беременности в первые 3–5 лет после окончания лечения.
Наиболее сложным остается вопрос о тактике ведения больной, если лимфома Ходжкина была диагностирована во время беременности. В I триместре, когда идет закладка органов плода и риск мутагенного воздействия как химиопрепаратов, так и облучения наиболее высок, общепризнанной тактикой является прерывание беременности. Во II и III триместрах возможно сохранение беременности. Вопрос о возможности сохранения беременности и лечебной тактике необходимо решать в специализированном учреждении, где есть опыт ведения таких больных.
Другой стороной проблемы качества жизни больных лимфомой Ходжкина являются осложнения лечения. Смертность от поздних осложнений лечения после программ терапии 60–80-х гг. XX в. приводит к снижению 20-летней общей выживаемости больных лимфомой Ходжкина на 20%. Среди осложнений лечения наиболее часто встречаются дисфункция щитовидной железы, сердечно-сосудистая патология, пульмониты, дисфункция половых желез, вторые злокачественные опухоли, включая лейкозы, а также инфекции.
Для своевременного выявления не только рецидивов заболевания, но и возникших осложнений лечения очень важно соблюдать алгоритм длительного контроля за больными лимфомой Ходжкина в полной ремиссии. В первые 5 лет основной целью наблюдения является выявление ранних осложнений лечения и рецидивов. Так как в течение первого года реализуется 50% рецидивов, то в этот период контрольное обследование должно проводиться каждые 3–4 мес; на втором году наблюдения обследование проводится каждые 6 мес и затем ежегодно в течение 5 лет. Рецидивы лимфомы Ходжкина после 5 лет редки, поэтому дальнейший контроль достаточно проводить 1 раз в 1–2 года. После 10–15 лет наблюдения возрастает риск поздних осложнений лечения и поэтому необходимо продолжить наблюдение за больным с ежегодным обследованием. Совершенствование программ первичного лечения лимфомы Ходжкина, кроме задачи избавления от заболевания, имеет своей целью уменьшение осложнений противоопухолевой терапии и возможность более полноценной физиологической, психологической и социальной реабилитации больных.
Современные критерии оценки эффективности терапии больных лимфомой Ходжкина
Повышение курабельности лимфомы Ходжкина продиктовало новые требования к оценке эффективности лечения.
Единственным непосредственным эффективным результатом проведенной терапии при лимфоме Ходжкина стала считаться только полная ремиссия (полное исчезновение опухолевых проявлений заболевания) длительностью не менее 4 мес. Частичная ремиссия или стабилизация процесса по окончании всей программы терапии признаются такими же неудачами лечения, как и прогрессирование. При оценке отдаленных (20–30-летних) результатов лечения, было установлено, что в течение первых 5–8 лет после окончания лечения больные лимфомой Ходжкина умирают преимущественно от прогрессирования заболевания. Однако после 15–20 лет наблюдения основной причиной смерти больных являются поздние осложнения — вторичные опухоли и лейкозы (10–30%), инфаркты миокарда (7–16%), инфекции (4–10%) и тяжелые повреждения легочной ткани после облучения средостения, особенно при сочетании с блеомицином (6–7%). Именно поздние осложнения лечения на 20% снижают общую выживаемость больных лимфомой Ходжкина и ухудшают качество их жизни. Поэтому наряду с критериями “безрецидивная выживаемость” и “общая выживаемость” во второй половине 90-х гг. XX в. EORTC (European Organization for Research and Treatment of Cancer — Европейская организация по изучению и лечению рака) для оценки эффективности лечения были введены новые критерии: “выживаемость, свободная от неудач лечения” и “бессобытийная выживаемость”.
Критерии выживаемости:
1. Безрецидивная выживаемость (DFS — disease free survival) рассчитывается от даты констатации полной ремиссии до даты рецидива или последней явки больного. Безрецидивная выживаемость характеризует только группу больных, достигших полной ремиссии. Безрецидивная выживаемость показывает, какая часть больных, достигших полной ремиссии, имеет возможность прожить указанный срок без признаков возврата заболевания.
2. Выживаемость, свободная от неудач лечения (FFTF — freedom from treatment failure) рассчитывается от начала лечения до любой “неудачи” лечения или до даты последней явки больного. Под “неудачей” лечения подразумеваются: прогрессирование в процессе лечения, отсутствие полной ремиссии после окончания всей программы лечения, рецидив, осложнения лечения, вызвавшие его прекращение, смерть от любой причины. Выживаемость, свободная от неудач лечения, характеризует всю группу больных, начавших лечение, и показывает, какая часть из всей группы больных имеет возможность прожить указанный срок без признаков заболевания.
3. Выживаемость, зависящая от заболевания (DSS — disease specific survival) рассчитывается от даты начала лечения до даты смерти от данной болезни или до даты последней явки больного. Выживаемость, зависящая от заболевания, характеризует всю группу больных, начавших лечение. Она показывает, какая часть больных могла бы прожить указанный срок, если бы больные не умирали от осложнений лечения в полной ремиссии заболевания, то есть теоретические возможности данного вида лечения.
4. Общая выживаемость (OS — overal survival) рассчитывается от даты начала лечения до смерти от любой причины или до даты последней явки больного. Общая выживаемость характеризует всю группу больных, начавших лечение, и показывает фактическую выживаемость на указанный срок наблюдения.
5. Бессобытийная выживаемость (EFS — event free survival) рассчитывается от даты начала лечения до любого “отрицательного” события или до даты последней явки больного. Под “отрицательным” событием понимается: прогрессирование, отсутствие полной ремиссии после окончания всей программы лечения, осложнения лечения, вызвавшие его прекращение, рецидив, смерть от любой причины, а также вторая опухоль или любое другое позднее осложнение лечения, угрожающее жизни больного. Бессобытийная выживаемость характеризует всю группу больных, начавших лечение, и отражает длительность и качество жизни всех больных данной группы.
Литература
Клиническая онкогематология. Руководство для врачей/Под ред. проф. М.А. Волковой.— М.: Медицина, 2001.
Справочник по онкологии/Под ред. Н.Н. Трапезникова и др.— М.: Каппа, 1996.
Bailliere’s clinical haematology. International practice and Rresearch. Hodgkin’s disease. Guest editor V. Diehl. 1996.
Cancer: Principles and Practice of Oncology. 4th ed./Ed. by V.T. DeVita et al.— Philadelphia, 1993.— V. 2.— P. 1819–1858.
Cancer: Principles and Practice of Oncology. 6th ed./Ed. by V.T. DeVita et al.— Philadelphia, 2001.— Ch. 45.
The Lymphomas/Ed. by G.P. Canellos. et al.— Philadelphia, 1998.
Hodgkin’s disease/Ed. by P.V. Mauch et al.— Philadelphia, 1999.
World health organization classification of tumors. Pathology and genetics of tumors of haematopoietic and limphoid tissues/Ed. by E.S. Jaffe et al.— Lyon, 2001.
Описание проверено экспертом
Оцените статью:
- Лимфогранулематоз
- Болезнь Ходжкина
- Лимфома Ходжкина
- Лимфопролиферативные заболевания
- Ходжкинская злокачественная лимфома
- Ходжкинская лимфома
- Генерализованная форма болезни Ходжкина
- Пальтауфа-Штернберга болезнь
- Ретикулез фибромиелоидный
- Пеля-Эбштейна лихорадка
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
лимфома
у пациентов с МКЛ с высокой опухолевой массой, лимфома, У пациентов с лимфомой из клеток мантийной зоны (ЛМК) с высокой опухолевой массой,



