- Этиология и патогенез трофобластической болезни
- Эпидемиология
- Факторы риска
- Патоморфология трофобластической болезни
- Диагностика
- 1. Классификация Hammond (NCI) для больных с отдаленными метастазами трофобластической болезни
- Лечение
- Для больных с I-II стадией заболевания
- Для больных с III-IV стадией заболевания
D39.2 Плаценты, МКБ-10
Отредактировано: 19.09.2023
д.м.н., проф. Толокнов Б.О., к.м.н. Махова Е.Е.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Этиология и патогенез трофобластической болезни. Эпидемиология. Факторы риска. Патоморфология трофобластической болезни. Диагностика. Классификация трофобластических опухолей. Лечение. Хориокарцинома матки, диагностика и лечение
Согласно существующей сегодня концепции, трофобластическая болезнь является следствием цепи последовательных морфологических изменений от простого пузырного заноса до хориокарциномы, сопровождаемых соответствующими биологическими и клиническими признаками.
Этиология и патогенез трофобластической болезни
В понятие трофобластической болезни по Международной гистологической классификации опухолей входят:
— доброкачественные заболевания — полный пузырный занос, частичный пузырный занос;
— переходная форма — инвазивный пузырный занос;
— сугубо злокачественная опухоль — хориокарцинома матки.
Кроме того, в эти патологические состояния включаются трофобластическая опухоль плацентарного ложа и, недавно описанная, эпителиоидная трофобластическая опухоль.
С точки зрения гистологического определения термин “пузырный занос” подразумевает 2 формы — полный пузырный занос и частичный пузырный занос, при этом обоим присущи общие признаки в виде отека ворсин и гиперплазии трофобласта. В том и другом случаях это состояние является патологическим продуктом зачатия, только при полном — без эмбриона, а при частичном — с эмбрионом.
Инвазивный занос рассматривается в настоящее время как опухолевый или опухолевоподобный процесс, инвазирующий миометрий и характеризующийся гиперплазией трофобласта с сохранением структуры плацентарных ворсин. Инвазивный занос иногда метастазирует, но не прогрессирует, как истинный рак, при этом он может спонтанно регрессировать. В качестве синонимов иногда используются следующие термины: злокачественный занос, деструирующий занос, деструирующая хорионаденома, однако, по мнению научной группы ВОЗ, в настоящее время эти термины применять не следует.
Хориокарцинома развивается из эпителия трофобласта и содержит элементы цитотрофобласта и синцитиотрофобласта. Эта злокачественная опухоль может возникать при беременности, завершившейся как родами, так и абортом на любой стадии, а также при внематочной беременности и пузырном заносе.
Если хориокарцинома имеет бифазные признаки опухоли — наличие клеток как цито-, так и синцитиотрофобласта, растущих внутрь сосуда, то при опухолях плацентарной площадки преобладают клетки цитотрофобласта, которые имеют меньшую васкуляризованность и более локальную лимфатическую инфильтрацию.
По определению Экспертной комиссии ВОЗ, трофобластические болезни — это опухоли, либо состояния, предрасполагающие к их развитию. Эти опухоли уникальны тем, что представляют собой аллотрансплантаты, возникающие из продукта зачатия и в случае злокачественной трансформации прорастающие в ткани материнского организма (матку), при этом склонные к метастазированию в отдаленные органы. Поскольку эти опухоли связаны с беременностью, то они встречаются в основном у женщин детородного возраста в тот период, когда их социальные нагрузки в семье и обществе наиболее велики.
В последнее время, по мнению ведущих специалистов, занимающихся проблемой лечения этих заболеваний, следует считать, что пациентки, нуждающиеся в специфическом лечении (химиотерапия или операция), имеют уже не трофобластическую болезнь, а “трофобластическую опухоль”.
Эпидемиология
Заболеваемость трофобластической болезнью широко варьирует в различных популяциях и регионах, при этом, если в США заболевание встречается от 0,6–1,1 на 1000 беременностей, то в некоторых областях Азии и Южной Америки — 1 на 120 беременностей. Следует отметить, что риск развития трофобластической болезни пятикратно увеличивается у женщин старше 40 лет, а также повышается у женщин моложе 20 лет.
Кроме предшествующих беременностей, закончившихся пузырным заносом, абортом или родами, факторами риска развития трофобластической болезни являются недостаточное содержание витамина А в питании и низкий социально-экономический статус. При этом женщины, имеющие вторую (А) группу крови, которые замужем за мужчинами, имеющими первую (0) группу крови, также находятся в группе более высокого риска. Риск развития хориокарциномы после эвакуации полного пузырного заноса составляет 15–25%, в то время как для частичного пузырного заноса этот показатель равен 2,9%. Хориокарцинома развивается у 4% больных после эвакуации пузырного заноса и очень редко после доношенной беременности (1 на 40 тыс.).
Эксперты ВОЗ подчеркивают, что эпидемиология трофобластических болезней изучена плохо, чему способствуют 3 обстоятельства:
1) терминологическое несовершенство и отсутствие ясного и четкого определения болезни или болезней;
2) ошибки, связанные с диагностикой, а точнее — с занижением или завышением процентов осложненных беременностей;
3) трудная интерпретация приводимых в литературе данных о частоте трофобластических болезней из-за неясностей определения групп риска.
Таким образом, учитывая отсутствие контролируемых эпидемиологических исследований, с большой долей достоверности можно полагать, что ежегодная суммарная заболеваемость трофобластической болезнью в мире, по всей вероятности, может достигать 150 тыс. случаев. Поэтому будет справедливым утверждение, что трофобластическая болезнь не является таким уж редким заболеванием, как это традиционно принято думать.
А если учесть, что заболевают в подавляющем большинстве случаев женщины в детородном возрасте, то этот вопрос переходит в ранг серьезной медико-социальной проблемы и требует участия государственных структур в решении вопросов охраны материнства, внутрисемейных отношений, медицинской реабилитации и возврата больных к трудовой деятельности.
Факторы риска
Возрастной аспект больных трофобластической болезнью разрабатывался многими авторами. Сложилось единое мнение, что возраст пациенток с трофобластической болезнью определяется началом половой жизни, ее продолжительностью и существующей вероятностью зачатия. Так, с угасанием репродуктивной функции у женщин, имевших в прошлом беременности, риск развития хориокарциномы, хотя и резко снижается, полностью не исчезает даже во время менопаузы.
Несмотря на то что заболевание встречается на протяжении всей активной жизни женщины, от 15 до 75 лет, мнение большинства авторов едино: трофобластическая болезнь — удел молодого возраста.
Процент случаев хориокарциномы, которым предшествовал пузырный занос, варьируется в широких пределах — от 29 до 83%. Столь высокий процент возникновения хориокарциномы после пузырного заноса является доказательством того, что пузырный занос — мощный фактор риска возникновения опухоли. Matalon указывает, что риск развития хориокарциномы у женщин с пузырным заносом варьирует от 2 до 19%, тогда как в целом риск развития хориокарциномы после пузырного заноса примерно в 1000 раз выше, чем после нормальных срочных родов.
В последние годы в литературе все чаще появляются данные, свидетельствующие о значительной роли в развитии хориокарциномы генетических факторов.
Семейное предрасположение к возникновению трофобластической болезни является достаточно редким наблюдением. Недавно была описана ливийская семья, в которой две родные сестры имели пузырный занос, а также немецкая семья, в которой трое сестер страдали трофобластической болезнью, при этом большинство заболевших женщин имели несколько последовательных пузырных заносов и очень небольшое число нормальных беременностей.
Helwani et al. (1999) опубликовали данные о том, что семейные пузырные заносы, морфологически полные, имели присутствие генетического материала от обоих родителей и являлись диплоидными, также как рецидивные, полные пузырные заносы в семье, описанной Jense et al. Картина наследования в этих семьях позволяет предположить аутосомно-рецессивное состояние, предрасполагающее заболевших женщин к пузырным заносам. Так как пузырный занос с присутствием генетического материала от обоих родителей морфологически не отличим от пузырного заноса, имеющего другое генетическое происхождение, в которых подлежащим дефектом является патологический геномный импринтинг, то у этих женщин, вероятно, произошла мутация гена, вовлеченного в регуляцию импринтинга в яйцеклетке или зиготе.
Геномное сканирование двух семей дало возможность Helwani определить этот ген семейного пузырного заноса в карте генома человека до 15,2 сМ-интервала 19q13.3-q13.4, что было последовательно подтверждено A. Sensi. Специфический ген, способствующий семейному пузырному заносу, еще должен быть идентифицирован. Кроме того, недавно было продемонстрировано, что рецидивные, полные пузырные заносы также могут иметь происхождение от обоих родителей. Эти женщины, возможно, также могут иметь семейные пузырные заносы.
В тех случаях, когда хориокарцинома развивается после нормальных срочных родов, многие считают, что продукт зачатия, из которого развивается злокачественная опухоль, является диплоидным и гетерозиготным генетическим вкладом от каждого из родителей. Беременности, после которых возникла хориокарцинома, заканчиваются рождением равного числа плодов женского и мужского пола. Следовательно, хориокарцинома может развиваться при полном пузырном заносе из-за андрогенного диплоидного продукта зачатия или из нормального диплоидного продукта зачатия любого пола.
Даже краткий анализ источников литературы по эпидемиологии хориокарциномы доказывает, что эта опухоль встречается не так уж редко. Это должно настораживать клинициста, в смысле возможности выявления хориокарциномы у женщин, которые имеют определенные факторы риска:
1. Наличие в анамнезе беременности, отягощенной пузырным заносом или указание на семейную предрасположенность к пузырному заносу.
2. Проживание на эндемичной по трофобластической болезни территории.
3. Беременности в позднем возрасте.
Патоморфология трофобластической болезни
Патоморфология трофобластической болезни изучена достаточно полно.
Гистологическая картина полного пузырного заноса характеризуется наличием диффузных, отечных ворсинок, заметной трофобластической пролиферацией и атипией, вовлекающей цитотрофобласт, промежуточный трофобласт и синтициотрофобласт. При этом имеются митотическая активность, выраженная нуклеомегалия и заметная гиперхромазия. Недавно предположили, что отрицательность ядер стромы ворсинок в отношении генного продукта р57, запечатляющего геном отца, может быть диагностически полезной для подтверждения диагноза полного заноса.
Частичные пузырные заносы гистологически характеризует совпадение четырех особенностей:
1) смесь двух популяций ворсинок (маленькие фиброзные ворсинки и большие неправильные отечные ворсинки);
2) мультифокальная гиперплазия трофобласта слабой и умеренной степени выраженности;
3) расширенные кавернозные ворсинки;
4) расширенные ворсинки с беспорядочными трофобластическими инвагинациями и включениями.
Большинство исследователей сообщают, что 85–99% частичных пузырных заносов являются триплоидными, в то время как большинство полных заносов — диплоидными (60%) или тетраплоидными (40%).
Инвазивный пузырный занос проявляется присутствием ворсинок пузырного заноса внутри миометрия или в его васкулярных пространствах. Так как большинство инвазивных заносов возникают после полного пузырного заноса, типичная гистологическая картина включает в себя отечные кавернозные ворсинки в сочетании с атипическим гиперпластическим и дегенерирующим трофобластом, локализующимся внутри миометрия или маточных венах. Диагноз “инвазивный пузырный занос” практически невозможно поставить по материалу, полученному при выскабливании матки, т.к. для этого необходимо знать состояние миометрия, следовательно, этот диагноз можно поставить только после гистерэктомии.
Трофобластическая опухоль плацентарной площадки проявляется монофазной пролиферацией промежуточного трофобласта или цитотрофобласта без значительных количеств синтициотрофобласта. Промежуточные трофобластические клетки являются одноядерными или многоядерными, среднего или большого размера, со значительной атипией ядер, заметными ядрышками эозинофильной или светлой цитоплазмы, отдельными митозами и изредка внутриядерными включениями. Для этого состояния характерно проникновение опухолевых клеток через весь миометрий с выраженной вазоцентрической пролиферацией и интраваскулярным распространением. Высокая митотическая активность при этом заболевании может указывать на плохой прогноз. Проточная цитометрия выявляет, что большинство опухолей диплоидны.
Эпителиоидная трофобластическая опухоль включает в себя пролиферацию мономорфных клеток промежуточного трофобласта, которая отличается от опухоли плацентарной площадки по некоторым аспектам:
1) эти клетки имеют меньший размер и меньший плеоморфизм;
2) опухоль растет в виде узла, иногда замещая эпителий эндоцевикса, близко напоминая карциному.
Хориокарцинома состоит из смеси синтициотрофобласта, цитотрофобласта и промежуточного трофобласта в виде клеток с выраженным кровотоком, некрозом и сосудистой инвазией. Злокачественный трофобласт обнаруживает заметную цитологическую атипию и бифазную дифференцировку, при этом имеются группы клеток цитотрофобласта, окаймленных многоядерным синтициотрофобластом. Большинство опухолей имеют вариабельную промежуточную трофобластическую дифференцировку, не обладают опухолевой стромой или новообразованием сосудов. В связи с тем, что жизнеспособная опухоль может быть обнаружена только по периферии геморрагического узла, то необходимо исследовать большое количество проб для подтверждения гистологического диагноза. Гистологически хориокарцинома не подразделяется на степени злокачественности, т.к. это не дает никакой дополнительной информации для клиники. При исследовании опухолей методом проточной цитометрии было обнаружено, что они являются диплоидными.
Чаще хориокарцинома локализуется в теле матки, реже — в области патологической имплантации плодного яйца в маточной трубе, яичнике или в брюшной полости (эктопическая хориокарцинома). Макроскопически опухоль представлена узлами синевато-багрового цвета мягкой консистенции. При экзофитном росте опухоль выступает в полость матки, при эндофитном — внедряется в толщу миометрия вплоть до серозной оболочки матки. В редких случаях опухоль расположена в толще стенки матки (интрамурально) или имеет вид множественных очагов в теле и одновременно в шейке матки.
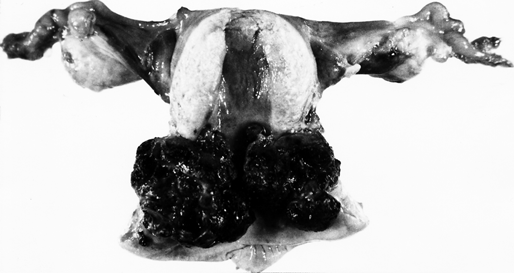
Рисунок 1. Опухолевый узел хориокарциномы в матке
По общему мнению специалистов, самым ранним и ведущим симптомом трофобластической болезни, независимо от гистологического типа, являются кровотечения различной интенсивности и степени выраженности. Эта наиболее частая манифестация заболевания — 50–98% случаев. Патологическое кровотечение следует рассматривать как “ключ” к ранней постановке диагноза.
Пути улучшения результатов лечения больных трофобластической опухолью организационно заключаются в максимальном сокращении сроков установления диагноза, адекватной и достаточно ранней лекарственной противоопухолевой терапии.
Японские авторы, исследуя клинические особенности течения хориокарциномы, обнаружили статистически достоверное различие периода малигнизации трофобласта в связи с предшествующей беременностью. Морфологическая прогрессия простого пузырного заноса в инвазивный завершается через 11 нед, а хориокарциномы после аборта — через 9 нед.
Другое частое клиническое проявление трофобластической болезни — несоответствие размеров матки сроку беременности: в большинстве случаев размер матки на 4 нед превышает размер, соответствующий сроку беременности. Следует, однако, помнить, что в 30–40% случаев размер матки соответствует сроку беременности, в 15–20% он меньше.
Частый симптом развития опухоли — рвота. В 12–27% случаев наблюдается поздний токсикоз. Несоответствие между сроками предполагаемой беременности и величиной матки, наличие лютеиновых кист и кровянистых выделений, а также одышка и кашель должны натолкнуть врача на мысль о возможности развития трофобластической болезни и заподозрить наличие метастазов.
Общеизвестна способность трофобластических опухолей к метастазированию даже при отсутствии морфологических признаков злокачественности. Так, наблюдая за 97 больными пузырным заносом, Chan обнаружил у 10 из них метастазы в легких. Как известно, трофобластическая опухоль метастазирует гематогенным путем, преимущественно в легкие и влагалище, реже в другие отдаленные органы — печень, почки и головной мозг. По данным литературы, метастазы хориокарциномы обнаруживаются в легких в 57–80% случаев, во влагалище — 30%, головном мозге — 17% и печени — 10%. Тем не менее метастазы опухоли теоретически могут быть в любом органе, в т.ч. в средостении, кишечнике, коже и т.д.

Рисунок 2. Метастазы трофобластической опухоли в легкие
Диагностика
Диагноз трофобластической болезни основывается на клинических данных, УЗТ, выявлении продуцируемого клетками опухоли хорионического гонадотропина или трофобластического бета-глобулина в сыворотке крови, а также данных гистологического исследования соскоба матки и результатах рентгенологического исследования грудной клетки.
При развивающейся трофобластической опухоли чаще всего пациентки отмечают появление из половых путей кровянистых выделений (вначале умеренных, затем усиливающихся) после бывшей беременности и тем более это часто встречается после перенесенного пузырного заноса. Эти кровянистые выделения обусловлены разрушением опухолью кровеносных сосудов матки или сосудов влагалища при локализации в нем метастазов. При расположении опухоли в толще стенки матки или фаллопиевой трубе с разрушением серозного покрова может наблюдаться обильное внутрибрюшное кровотечение. Оно может возникнуть также из метастатических узлов, расположенных на брюшине, в печени или в кишечнике.
При локализации опухоли в маточной трубе у больных отмечаются сильные схваткообразные боли в нижней части живота, что напоминает клиническую картину внематочной беременности.
В результате этих кровотечений и интоксикации у пациенток развивается быстропрогрессирующая анемия, нарушения свертывающей системы крови, а в связи с возможным некрозом и инфицированием узлов опухоли может наблюдаться лихорадочное состояние.
Клиническая картина заболевания при развитии отдаленных метастазов проявляется симптомами, обусловленными их локализацией. Так, при метастатическом поражении легких появляются кашель с мокротой и боли в грудной клетке, гемоторакс, легочная гипертензия; при метастазах в мозг — головная боль, рвота, гемиплегия и другие неврологические симптомы; при поражении органов ЖКТ — тошнота, рвота, боли в животе, желудочно-кишечные кровотечения, при метастазах в почки — гематурия и т.д.
При обращении больной трофобластической болезнью к гинекологу во время осмотра шейки матки с помощью зеркал можно обнаружить цианоз слизистой оболочки влагалища и шейки матки, а также метастазы опухоли во влагалище в виде темно-красных возвышений и узелков с характерным сероватым оттенком из-за выраженных некротических изменений. При бимануальном исследовании тело матки обычно увеличено и имеет мягковатую консистенцию, часто можно отметить увеличение придатков и пальпировать лютеиновые кисты.
В арсенале диагностических мероприятий при выявлении трофобластической болезни ранее использовался целый ряд методик: тазовая АГ, гистерография и гистероскопия, КТ, радиоизотопное исследование матки, лапароскопия и т.д.
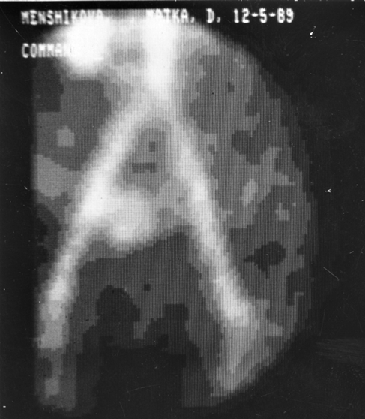
Рисунок 3. Ангиостинциграфическая визуализация трофобластической опухоли
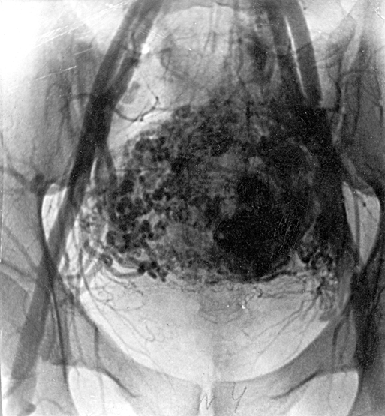
Рисунок 4. Тазовая ангиография у больной трофобластической опухолью
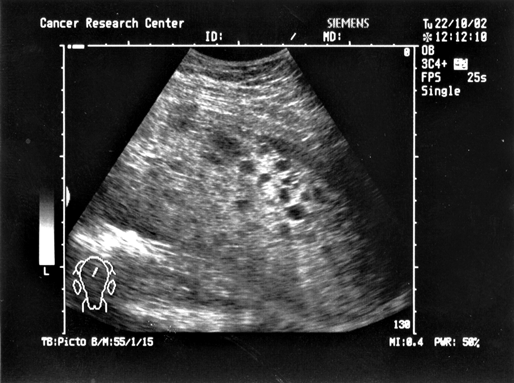
Рисунок 5. Ультразвуковая томограмма больной с пузырным заносом
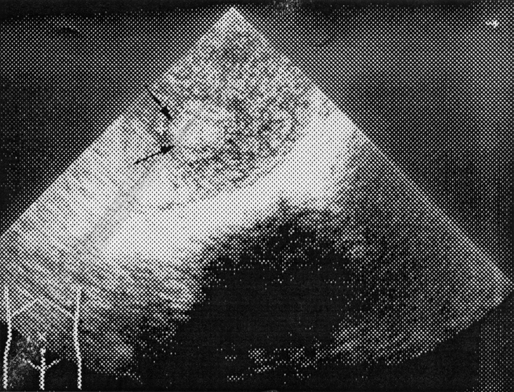
Рисунок 6. Ультразвуковая томограмма больной с хориокарциномой матки
Однако в последнее время диагностическая роль этих исследований сведена к минимуму. Это обстоятельство связано с появлением УЗТ, которая в значительной мере превосходит информативность и чувствительность других методов, что обусловило ее приоритетное значение и широкое повсеместное использование при этом заболевании. УЗТ не только дает возможность с высокой степенью достоверности определить наличие опухоли и ее локализацию в матке, но, благодаря неинвазивности метода, позволяет применять его неоднократно в динамике заболевания, как контроль за эффективностью химиотерапии, а также как один из критериев излеченности.
Диагноз трофобластической болезни, основанный на гистологическом исследовании соскоба, не всегда достоверен, поскольку сходные картины могут наблюдаться и после прерывания беременности. Поэтому предположительный диагноз, полученный при гистологическом исследовании, должен быть подтвержден результатами определения хорионического гонадотропина в сыворотке крови. Отрицательные или сомнительные результаты гистологического исследования соскоба не дают основания для полного исключения наличия заболевания.
Цитологическое исследование не нашло широкого применения в диагностике трофобластической болезни, т.к. обнаружение элементов опухоли в мазках затруднено ввиду частого некроза ее поверхности и кровянистых выделений из матки.
Дифференциальный диагноз заболевания проводят с синцитиальным эндометритом, плацентарным полипом, беременностью, а хориокарциному маточной трубы дифференцируют с внематочной (трубной беременностью). В дифференциальной диагностике метастатического поражения легких при хориокарциноме и туберкулезе легких важную роль играют данные анамнеза и определение ХГ в сыворотке крови.
Хотя в последнее время в качестве маркеров хориокарциномы привлекаются различные белки крови, свойственные ворсинчатым трофобластам, — СА125, SP1, PP12, гликопротеин “ранний фактор беременности”, — основным и ведущим, по общему признанию, является определение уровня ХГ и его субъединиц.
При определении уровня ХГ возникает ряд трудностей. Это связано с тем, что молекула ХГ состоит из двух единиц и присоединенных к ним компонентов сахаров. Субъединица ХГ почти идентична по своей структуре субъединице лютеотропного, фолликулостимулирующего, тиреотропного гормонов. В связи с этим при использовании реакции с антителами против обеих субъединиц ХГ может возникнуть перекрестная реакция с антигенами других гормонов, что значительно снижает ценность этого метода. Перед проведением иммунизации предложено разделять молекулу ХГ на две субъединицы и использовать для получения антител только бета-субъединицу, т.к. она дает перекрестную реакцию лишь с антигенами лютеотропного гормона. Некоторые исследователи предлагают использовать для иммунизации один из компонентов молекулы ХГ — терминальный карбоксил; при этом не отмечается никакой перекрестной реакции, однако структура молекулы ХГ так изменяется, что становится менее чувствительной. Вопреки имеющемуся у врачей представлению о том, что ХГ секретируется только плацентой, установлено, что небольшое количество гормона может продуцировать и большинство нормальных регенерирующих тканей.
При наличии трофобластической опухоли тестирование гормонов в сыворотке крови является обязательным дополнением к гистологическому анализу, а еще чаще — единственным методом, способным активно выявить заболевание или его рецидив, а также своевременно сигнализировать о малигнизации пузырного заноса.
Надежность метода заключается в том, что между активностью трофобластической ткани и титром ХГ существует четкая корреляция. Количественная оценка ХГ дает возможность быстро ориентироваться в конкретной клинической ситуации и судить о прогнозе заболевания.
Значительным достижением в улучшении своевременной диагностики трофобластической болезни явились исследования Ю.С. Татаринова с соавт. (1975) и К.И. Жорданиа с соавт. (1981). Так, определение в сыворотке трофобластического бета-глобулина (ТБГ) позволило установить его корреляционную связь с хорионическим гонадотропином у большинства больных трофобластическими опухолями. Основная информативность ТБГ заключается в том, что с его помощью реализуются возможности раннего выявления потенциально прогрессирующих форм заболевания трофобласта при нормальных показателях хорионического гонадотропина.
Современная тактика лечения больных трофобластической опухолью требует сугубо индивидуального подхода, однако с учетом имеющихся общих для всех пациенток прогностических факторов, которые могут быть сведены в единую прогностическую систему. В рамках этой системы получила признание концепция существования неблагоприятных факторов — факторов риска.
Идентификация различных прогностических факторов в начале эры химиотерапии позволила разделить больных с трофобластическими опухолями на группы с низкой, средней и высокой степенью риска неблагоприятного течения заболевания с целью проведения адекватного лечения в зависимости от количества этих факторов.
Обобщив опыт различных медицинских учреждений, занимающихся лечением трофобластических болезней, K.D. Bagshawe еще в 1974 г. впервые опубликовал схемы подсчета баллов по прогностическим факторам, в которых на основании 13 факторов, в зависимости от веса каждого из них, и суммирования баллов была разработана система деления больных на группы низкого, среднего и высокого риска. На основании этой системы были рекомендованы режимы химиотерапии, различающиеся по степени их агрессивности в зависимости от групп риска. Эта классификация нашла широкое применение у специалистов, однако, как считают эксперты ВОЗ, она может быть упрощена (табл. 1).
Таблица 1
Прогностические факторы по классификации ВОЗ
| Прогностические факторы | Баллы с) | |||
| 0 | 1 | 2 | 3 | |
| Возраст (годы) | ≤39 | >39 | ||
| Предшествующая беременность | ПЗ | Аборт | Срочные роды | |
| Интервал а) | 4 | 4-6 | 7-12 | более 12 |
| ХГ (МЕ/л) b) | 103 | 103-104 | 105 | 105 |
| Группа крови | O или A | B или AB | ||
| Размер самой крупной опухоли, включая опухоль матки, см | Менее 3 | 3-5 | 5 | |
| Локализация метастазов | Селезенка, почки | ЖКТ, печень | Головной мозг | |
| Число найденных метастазов | 1-3 | 4-8 | 8 | |
| Предшествующая химиотерапия | 1 препарат | 2 и более препарата | ||
a) Интервал: время (месяцы) между окончанием предшествующей беременности и началом химиотерапии.
b) Низкий уровень ХГ может быть при опухолях плацентарного ложа.
c) Общую сумму баллов для данной больной получают путем сложения баллов по каждому прогностическому фактору.
При общей сумме: ≤4 — низкий риск;
5–7 — средний риск;
8 — высокий риск
Классификация трофобластических опухолей
Несмотря на то что классификация трофобластических опухолей ВОЗ в настоящее время является общепринятой, у некоторых врачей сложилось предубеждение по отношению к ней из-за внесения индивидуальных изменений в эту классификацию, приводящих к невозможности сравнения результатов лечения внутри одного центра или между центрами.
В настоящее время используются несколько классификаций трофобластических опухолей в зависимости от пристрастий докторов, имеющих дело с больными этой патологией. Такая ситуация вызывает большие трудности не только для выработки соответствующей химиотерапии с учетом индивидуального прогноза, но и не решает в должной мере проблему стадирования заболевания и сопоставимости полученных результатов. Вопрос о приоритетности той или иной классификации вызывает у онкологов большие дискуссии.
Предлагаем рассмотреть наиболее часто используемые классификации.
1. Классификация Hammond (NCI) для больных с отдаленными метастазами трофобластической болезни
A. Заболевание с хорошим прогнозом:
1) короткая длительность заболевания;
2) низкий уровень ХГ перед началом лечения (меньше 100000 МЕ/мл в моче или меньше 40000 МЕ/мл в сыворотке крови);
3) отсутствие метастазов в головном мозге и печени;
4) отсутствие предшествующей беременности;
5) отсутствие предшествующей химиотерапии.
B. Заболевание с плохим прогнозом (при наличии даже одного из следующих факторов):
1) длительность заболевания более 4 мес;
2) высокий уровень ХГ перед началом лечения (более 100000 МЕ/мл в моче или более 40000 МЕ/мл в сыворотке крови);
3) наличие метастазов в головном мозге и печени;
4) наличие предшествующей беременности;
5) наличие предшествующей химиотерапии.
2. Классификация FIGO (Сингапур, 1992)
Стадия I — опухоль в пределах матки:
Iа — отсутствие факторов риска;
Ib — наличие одного фактора риска;
Iс — наличие двух факторов риска.
Стадия II — опухоль распространяется за пределы матки, но ограничена половыми органами:
IIa — отсутствие факторов риска;
IIb — наличие одного фактора риска;
IIc — наличие двух факторов риска.
Стадия III — заболевание распространяется на легкие:
IIIa — отсутствие факторов риска;
IIIb — наличие одного фактора риска;
IIIс — наличие двух факторов риска.
Стадия IV — наличие прочих отдаленных (кроме легких) метастазов:
IVа — отсутствие факторов риска;
IVb — наличие одного фактора риска;
IVс — наличие двух факторов риска.
Факторы риска:
1. ХГ более 100 МЕ/мл;
2. длительность заболевания более 6 мес с момента предшествующей беременности.
Эта классификация основана на системе подразделения факторов риска, разработанной Bagshawe, модифицированной Goldshein и адаптированной в модифицированной форме Комитетом по трофобластической болезни ВОЗ в 1983 г.
Классификация ВОЗ широко распространена, т.к. она подразделяет факторы риска, ассоциированные с данной опухолью, более детально и позволяет определять прогностическую вероятность, которая используется затем при назначении химиотерапии. Значительная проблема этой классификации заключается в стремлении отдельных центров ввести собственные изменения и дополнения в раздел “факторы риска”, что приводит к численным изменениям величины прогностической вероятности, распределяемой на каждую категорию риска. В результате неизбежны различия оценки прогностической вероятности факторов риска, приводящие к отнесению пациенток с одинаковой формой и выраженностью болезни к различным прогностическим группам. Это делает более трудным и даже невозможным сравнение результатов лечения между различными центрами. Подобная непоследовательная практика к тому же вызывает настороженное отношение к данным по оценке результатов лечения различных химиотерапевтических режимов у различных исследователей.
K.D. Bagshowe в своей оригинальной классификации использовал градации в 0, 10, 20 или 40. D.P. Goldstein модифицировал их как 1, 2, 3 и 4. T.C. Wong, адаптируя классификацию ВОЗ, использовал только 3 градации для высшей категории риска. В связи с этим пациентки из Гонконгского университета и из Центра трофобластической болезни в Бостоне будут иметь относительно более низкую градацию категории наибольшего риска. K.D. Bagshawe в последующем увеличил наивысшую категорию с 4 до 6 в исследовательской группе госпиталя Черинг Кросс. G. Bolis также последовал этому опыту и поэтому данные, полученные из больницы Черинг Кросс и из Миланской группы, будут иметь относительно более высокую категорию группы с наивысшим риском, чем таковые, определенные в соответствии с принятой классификацией ВОЗ.
Вначале классификация K.D. Bagshawe и классификация NCI как значительные факторы риска использовали уровень ХГ и время наступления предшествующей беременности. Уровень ХГ отражает выраженность объема опухоли, а время от начала предшествующей беременности — длительность существования опухоли. K.D. Bagshawe внес в качестве фактора риска возраст женщин, что было также включено в классификацию ВОЗ. Все исследователи принимают эти факторы риска. Лишь G. Bolis не согласен и включает в перечень факторов риска не время, прошедшее от начала предшествующей беременности, а период больше или меньше 6 мес от предшествующей беременности. Указанные в классификации ВОЗ такие факторы, как размеры наибольшей опухоли, локализация метастазов и их количество были приняты всеми исследователями. K.D. Bagshawe не присваивал отдельных очков для опухоли меньше 3 см, а давал одно очко опухолям 3–5 см и 2 очка — более 5 см, что также использовано классификацией ВОЗ. Однако Wong присваивал два очка опухолям 2–5 см и 3 очка — узлам более 5 см. G. Bolis пошел еще дальше, присваивая 6 очков опухоли более 10 см в диаметре. Все эти мнения достаточно дискуссионны, т.к. не существует установленных правил исследования размеров опухоли клинически или с использованием УЗИ или рентгенологического исследования.
Классификация ВОЗ присваивает 2 очка в случае предшествующей химиотерапии одним препаратом и 4 очка в случае предшествующей химиотерапии двумя и более препаратами. Wong дает 1 очко в случае предшествующей профилактической химиотерапии и 2 очка в случае неэффективности любой предшествующей химиотерапии, а K.D. Bagshawe добавляет 1 очко, если предшествовавшая химиотерапия была неэффективной.
Таблица 2
Количество очков (баллов), определяющих риск у пациенток трофобластической болезнью
| Количество очков (баллов) | 10 | 20 | 40 | |
| Возраст (годы) | Менее 39 | Более 39 | ||
| Роды в анамнезе | 1, 2 более 4 | 3 или 4 | ||
| Предшествующая заболеванию беременность | Аборт | Срочные роды | ||
| Гистологический диагноз | Инвазивный пузырный занос | Неизвестный | Хориокарцинома | |
| Интервал (предшествующая беременность до начала химиотерапии), месяцы | Менее 4 | 4-7 | 7-12 | Более 12 |
| ХГ (плазма милиМЕ/мл или моча МЕ/сут) | 103-104 | Менее 103 | 104-105 | Более 105 |
| Группа крови (пациентка-муж) | A х A O или A х B O или A х AB |
O х O A х O O х A B х B AB х B |
B х O или A AB х O или A |
|
| Количество метастазов | Нет | 1-4 | 4-8 | Более 8 |
| Область метастазирования | Нет Легкие Влагалище |
Селезенка Почки |
ЖКТ Печень |
Головной мозг |
| Наибольший размер опухоли, см | 3 | 3-5 | 5 | |
| Лимфоцитарная инфильтрация опухоли | Выраженная | Средняя/неизвестная | Слабая | |
| Иммунный статус | Реактивный | Неизвестный | Ареактивный | |
| Рецидивы после предшествующей химиотерапии | Да |
Общая сумма для каждой пациентки определяется добавлением соответствующего количества очков (баллов) каждого из 13 перечисленных факторов (Bagshawe).
Значительной проблемой классификации ВОЗ было установление количества очков за группу крови пациентки и мужа. Клиницисты из госпиталя Черинг Кросс присваивали 1 очко (10 очков в оригинальной классификации) в случае, если даже группа крови мужа неизвестна. Большинство исследователей встречаются с трудностями при выяснении группы крови мужа и обычно убирают этот пункт из классификации. Проблема использования групп крови в системе АВО в классификации заключается в том, что риск АВО-несовместимости как фактор риска признается далеко не всеми исследователями. K.D.Bagshawe, описывая развитие хориокарциномы, указывает, что более вероятно в равной степени она возникает как после аборта, так и после срочной беременности в случае различия групп крови пациентки и мужа. Это подтверждает результаты предшествующих исследований, показавших высокий относительный риск в случае сочетания групп крови пациентки и мужа типов А x О и О x А. Кроме того, хориокарцинома у пациенток с четвертой (АВ) группой крови имеет худший прогноз. Авторы также отметили худший прогноз хориокарциномы в случае третьей и четвертой (В и АВ) групп крови пациенток. Вследствие отсутствия в настоящее время признанных данных о связи трофобластических опухолей с определенными типами групп крови необходимы дальнейшие исследования в этой области. В настоящее время в центрах, использующих группу крови в качестве фактора риска, окончательная сумма очков, определяющая суммарный риск, может быть выше, чем в центрах, не использующих этот фактор.
Различные исследователи добавили свои собственные пункты факторов риска. G. Bolis добавляет 6 очков, если пациентка имела хирургическое вмешательство по поводу внетазовой локализации опухоли. Surwit также учитывал хирургическое вмешательство по поводу опухоли как фактор риска.
Системы классификаций FIGO и ВОЗ применимы при всех трофобластических опухолях, тогда как классификация NCI применима лишь при наличии метастазов. Однако практично и логично использовать классификацию ВОЗ в случае метастатической формы болезни, т.к. грамотно леченные больные с неметастатическим заболеванием в большинстве случаев могут выздороветь, а трудности возникают при выборе терапии у пациенток с метастатическим заболеванием. Кроме того, пациентки с неметастатической хориокарциномой могут иметь низкий суммарный риск с недостаточным набором очков для проведения показанной в таких случаях химиотерапии.
Система ВОЗ распределяет всех пациенток с трофобластической неоплазией на группы:
— низкого риска (0–4 балла);
— среднего риска (5–7 балла);
— высокого риска (более 7 баллов).
Мнения различных исследователей в оценке определения групп риска не совпадают.
В настоящее время имеется несколько исследований по оценке суммы факторов прогноза при опухолях высокого риска. Lurain показал, что среди 168 пациенток, имевших сумму менее 8 по классификации ВОЗ, пролеченных в Центре трофобласта Джона Бревера, 93% были излечены, в то время как сумма более 8 баллов приводила к значительному снижению эффективности лечения (52%). Soper сообщает, что сумма в 5–7 баллов сопровождалась выживаемостью у 94,4% больных, сумма в 8–12 — 72,2% и сумма более 12 — у 65% пациенток.
Проблема топического определения метастазов и методика их включения в финальный подсчет требуют отдельного обсуждения и поиска взаимоустраивающего варианта. Возникает вопрос, необходимо ли всем больным с трофобластическими опухолями проводить сканирование легких (КТ) или можно обойтись рентгенограммой при определении легочных метастазов? Hanter считает, что КТ грудной клетки должно быть рутинным исследованием при обследовании пациенток с трофобластическими опухолями даже с учетом возможности полного излечения женщин с микролегочными метастазами и использованием монохимиотерапии. Несмотря на то что легочные метастазы — это “болезнь низкого риска”, общая оценка будет изменяться, т.к. при рентгеновском исследовании легких часть метастазов не будет определяться. Эту проблему необходимо разрешить, т.к. увеличение числа метастазов, полученное при КТ легких, может изменить пункт классификации ВОЗ, относящийся к числу легочных метастазов.
Остается нерешенным и вопрос об использовании толщины срезов при КТ головного мозга. Является ли необходимым использовать толщину срезов в 1 см и не является ли стандартным подход при использовании толщины в 2 см слишком грубым и пропускающим мелкие метастазы? Возможно пациентки, у которых “развиваются” церебральные метастазы в процессе терапии, просто уже имели их при первоначальном обследовании. Вероятно желательным является исследование церебральных метастазов с использованием такого эффективного метода, как МРТ головного мозга, однако в настоящее время это мало выполнимо. Скорее всего микрометастазы в головном мозге существуют гораздо чаще, чем определяются при обследовании, и они успешно лечатся использующимися сегодня курсами химиотерапии для групп высокого риска. Метод обнаружения метастазов в головной мозг требует своего определения для того, чтобы стадирование болезни в различных центрах было сопоставимым.
Для того чтобы добиться успеха и иметь надежные критерии в оценке результатов лечения трофобластических опухолей, необходимо иметь консенсус, общее мнение, которого бы придерживались врачи, занимающиеся терапией этого заболевания. В случае назначения первичного лечения опытным врачом, пациентки даже с высоким риском с суммой баллов по классификации ВОЗ 8–12 имеют весьма высокий шанс на полное излечение. В настоящее время накапливается достаточное количество данных в пользу того, что необходимо выделить группу с очень высоким риском метастатической формой болезни, которая по классификации ВОЗ имела бы сумму баллов 13 и более, и лечить женщин такой группы более интенсивно. Например, начальная терапия в этой группе должна представлять собой такой интенсивный курс, как ЕМА-РЕ. Однако для того чтобы улучшить результаты лечения, особенно в группе больных с очень высоким риском, необходимо уделять внимание детальной проработке стратегии терапии. Консенсус по выработке и использованию адекватной системы подсчета факторов риска может значительно помочь в назначении соответствующей терапии.
Опубликованные обсуждения классификаций стадий и систем подсчета величины риска свидетельствуют: каждая из классификаций трофобластических опухолей дает полезную информацию, позволяющую правильно прогнозировать развитие болезни.
Классификация NCI является самой простой и легко применимой во всех ситуациях. Данная классификация сохраняет свою широкую популярность в США и является, конечно, полезной при начальной оценке групп риска пациенток. В опубликованном совсем недавно исследовании юго-восточного трофобластического Центра университета Дюка (США) выбор типа лечения по-прежнему основывался на этой классификации.
Классификация FIGO основана в большей степени на анатомической корреляции: пациентки с высоким риском попадают в стадии III и IV. Модификация этой классификации от 1992 г. делает ее более точной с учетом прогностических факторов, что позволяет более адекватно планировать лечение.
Помимо классификаций FIGO и ВОЗ разработаны некоторые другие. В частности, в Memorial Sloan Kettering Center используется классификация Lewis. Группы высокого и низкого риска определяются аналогично классификации NCI, однако выделена группа с промежуточным риском при уровне ХГ более 100000 МЕ/мл и длительностью заболевания более 4 мес.
Голландская рабочая группа по трофобластной болезни использует систему, которая в некоторых моментах отличается от других классификаций.
Изменения, вносимые в подсчет величины риска при оценке трофобластических опухолей различными исследователями, приводят к индивидуальным вариациям классификации неприемлемого уровня. Различия при подсчете величины риска в Гонконге и Черинг Кросс, сделанные в соответствии с классификацией ВОЗ, относят пациенток к группе высокого или даже сверхвысокого риска, в то время как количество очков при одинаковой клинической ситуации в этих лечебных учреждениях не совпадает. Такое несоответствие делает невозможным не только сравнение результатов лечения, но и препятствует проведению межцентровых исследований по полихимиотерапии. FIGO и Обществу исследователей трофобластических опухолей необходимо достичь консенсуса, чтобы лечение больных проходило по общим правилам. В связи с этим, может быть, наиболее благоразумным было бы оставить классификацию FIGO в той форме, в которой она сейчас находится, и предложить различным центрам принять участие в перспективном исследовании с использованием определенных методов лечения и специальных химиотерапевтических протоколов, а затем провести мультивариантный ретроспективный анализ полученных результатов.
Завершением всех этих дискуссий явилось создание наиболее совершенной, как нам кажется, унифицированной в международном масштабе классификации трофобластических опухолей, которая была опубликована в “TNM Atlas” в 1997 г. Эта классификация основана на принятой в 1992 г. классификации FIGO (г. Сингапур) и классифицировании ТNМ, при этом символ N (регионарные лимфатические узлы) для этих опухолей не применяется (табл. 3).
Таблица 3
TM клиническая классификация трофобластической болезни
T — первичная опухоль
| TNM критерии | FIGO стадии | Характеристики |
| Tx | Недостаточно данных для оценки первичной опухоли | |
| T0 | Первичная опухоль не определяется | |
| T1 | I | Опухоль ограничена маткой |
| T2 | II | Опухоль распространяется на другие структуры: влагалище, яичники, широкую связку матки, маточную трубу |
| M1a | III | Метастазы в легкие |
| M1b | IV | Другие метастазы с поражением или без поражения легкого |
Стадии FIGO подразделены на A-C соответственно факторам риска:
A — без факторов риска;
B — с одним фактором риска;
C — с двумя факторами риска.
Факторы риска: существуют два главных риска, которые могут повлиять на исход (кроме T и M).
1. Уровень ХГ в сыворотке крови выше 40000 мМЕ/мл
2. Признаки заболевания спустя более 6 мес от момента прерывания предшествующей беременности
Лечение
Успехи лечения трофобластических опухолей матки напрямую связаны с развитием лекарственной терапии опухолей, т.к. эти опухоли оказались высокочувствительными к химиотерапии.
С введением в практику лечения трофобластических опухолей метотрексата, дактиномицина и хлорамбуцила эффективность терапии неметастатических форм трофобластической болезни приблизилась к 100% и позволила сохранить репродуктивную функцию многих женщин.
Использование метотрексата в сочетании с кальция фолинатом у пациенток с I стадией болезни или с низким риском позволило добиться излечения у 90% и 69% женщин соответственно. Полная ремиссия достигнута у 81,5% больных. Токсические проявления химиотерапии незначительны.
Блеомицин несколько менее эффективен, чем метотрексат или дактиномицин, и не может их заменить полностью. Однако его применение целесообразно при наличии резистентности опухоли к другим препаратам. Это показали Yim и соавт. (1979), применив препарат у 5 женщин в возрасте до 40 лет со злокачественной трофобластической болезнью. Длительность заболевания от начала появления симптомов до начала лечения составила менее 4 мес. В начале лечения ответ на блеомицин был хорошим у всех больных. У 3 больных через 3–5 нед началась ремиссия. У одной женщины с хорошим ответом через 4 нед наблюдалось профузное кровотечение из половых путей — произведена гистерэктомия. Опухолевая ткань находилась в состоянии некроза, жизнеспособных клеток не определялось. Токсичность препарата, по-видимому, мала. Ни у одной больной не было выраженной лейкопении. Побочных действий на печень и почки не отмечено. Во время лечения у всех больных отмечалась пигментация кожи, а у 4 началась алопеция.
Используя многоцелевую полихимиотерапию, оказывается возможным добиться выживаемости у больных с благоприятным прогнозом в 100%, а с неблагоприятным — в 67,3–90% наблюдений.
Некоторые авторы считают, что лечение больных с плохим прогнозом следует начинать с самых агрессивных схем полихимиотерапии. Этого мнения придерживаются и отечественные исследователи проблемы. Ряд хорошо контролируемых и аргументированных исследований из крупнейших и специализированных центров мира подтверждают правомерность и эффективность такого агрессивного подхода.
Однако, несмотря на достигнутые успехи в полихимиотерапии различных форм трофобластических опухолей, проблема их лечения полностью не решена.
В ряде работ обобщается большой опыт лечения трофобластической болезни в некоторых госпитальных центрах. Так, Lurain et al. (1982), по материалам Центра трофобластической болезни Brewer (359 наблюдений) отмечают, что полный эффект комбинации метотрексата, дактиномицина и циклофосфамида при пузырном заносе достигался у 92%, а при хориокарциноме — у 81%. В группе пациентов с высоким титром ХГ (100000 МЕ/л) и длительностью болезни более 4 мес эффект зарегистрирован в 62% случаев, а при отсутствии этих параметров — в 93%. Важное прогностическое значение имеет характер метастазирования. При легочных и влагалищных метастазах удавалось вылечить 92% больных, а при иной локализации метастазов — 34%. Все больные с метастазами в брюшную полость умерли. Хориокарцинома после родов имеет худший прогноз по сравнению с хориокарциномой, возникшей после аборта и внематочной беременности (ремиссия в 56% и 77% случаев соответственно). Для терапии метастазов в мозг в этом центре прибегали к одновременному назначению лучевой терапии, метотрексата, дактиномицина и циклофосфамида.
В Центр трофобластических болезней Новой Англии (г. Бостон) за 16 лет было госпитализировано 366 женщин с трофобластической болезнью. У 15 (4,1%) из них в возрасте 18–34 лет хориокарцинома развивалась после доношенной беременности. Больные без метастазов получали метотрексат или дактиномицин; при наличии метастазов проводили комбинированную химиотерапию метотрексатом, дактиномицином и циклофосфамидом. Отдельным больным были применены лучевая терапия и хирургическое лечение. Полная ремиссия достигнута у 2 больных без метастазов и 8 больных с наличием метастазов. У 10 больных с уровнем ХГ в моче до начала химиотерапии менее 100000 МЕ/сут ремиссия была зафиксирована у 8 (80%) больных. У 5 больных с уровнем ХГ в моче до начала химиотерапии более 100000 МЕ/сут ремиссия достигнута в 40%. При интервале времени между предшествовавшими родами и диагнозом хориокарциномы менее 4 мес полная ремиссия зарегистрирована в 87%, при интервале более 4 мес — в 43%. Среди больных с метастазами в печень или головной мозг, выжили только 28% женщин.
В рамках программы лечения хориокарциномы в известном Лондонском центре Черинг Кросс большинство больных с низкой степенью риска получали режим с минимальной токсичностью — метотрексат с фолиевой кислотой.
До 1979 г. больные со средней степенью риска получали последовательно гидроксикарбамид, метотрексат, меркаптопурин, дактиномицин, винкристин и циклофосфамид. С 1979 г. винкристин и циклофосфамид заменены этопозидом. Все 76 больных, леченных в 1979–1983 гг., к моменту оценки были живы и находились в состоянии полной ремиссии после 15–66 мес наблюдений. У 3 из них после окончания курса лечения был рецидив, но после дополнительно проведенной химиотерапии также наступила стойкая ремиссия.
Лечебный режим у 56 больных с высокой степенью риска (у большинства из них была опасность развития лекарственной устойчивости) включал этопозид с метотрексатом и дактиномицином (ЭМД) и винкристин с циклофосфамидом (ВЦ). Эти схемы применяли попеременно в течение недели, общая выживаемость составила 84%. Выживаемость и частота рецидивов у больных, получавших предварительную химиотерапию, составили соответственно 74 и 19%, у больных, не получавших предварительной химиотерапии, соответственно 93 и 3%. Токсичность лечебного режима, включающего ЭМД и ВЦ, была значительно ниже, чем режима, ранее применявшегося у больных с высокой степенью риска. Авторы делают вывод, что этопозид является основным препаратом в химиотерапии больных с трофобластическими опухолями средней и высокой степени риска.
В исследованиях Du Beshter et al. — Центр трофобластических болезней Новой Англии — акцент делается на значение прогностических групп риска. Лечение проведено 93 больным с метастатической трофобластической болезнью. Больные разделены на группы высокого и низкого риска. Критериями высокого риска были:
1) наличие метастазов в головной мозг, селезенку, печень, почки или кишечник;
2) отсутствие эффекта от ранее проводимого лечения;
3) развитие хориокарциномы после доношенной беременности;
4) продолжительность времени от предшествующей беременности до начала лечения более 4 мес;
5) уровень ХГ в сыворотке крови до начала лечения более 40000 мМЕ/мл или уровень ХГ в моче выше 100000 ЕД/сут.
Полная ремиссия достигнута у всех 42 больных группы низкого риска и у 34 из 51 — из группы высокого риска (66%). Монохимиотерапия вызвала полную ремиссию у 32 больных группы низкого риска. Полная ремиссия достигнута у 13 из 24 больных группы высокого риска в 1965–1975 гг. и у 21 из 27 в 1976–1985 гг. Монохимиотерапию получали в 1965–1975 гг. 13 из 24 больных высокого риска, в то время как в последние 10 лет — только 7%. Сделан вывод, что система прогностической шкалы более эффективна, чем традиционные критерии высокого риска, при выявлении группы больных, которым для достижения ремиссии требуется интенсивная комбинированная химиотерапия. В дальнейшем эта тактика не претерпела изменений.
Jones (1994) из Центра онкологических заболеваний Слоун Кеттеринг (г. Нью-Йорк) приводит описание лечения 240 больных с различными метастазами, которые были разделены на две группы — с низким и высоким риском. У 121 больной (50%) имелись метастазы к началу первичного лечения, из них 62 (51%) расценены как группа низкого риска и 59 (49%) — высокого. Из группы больных высокого риска у 22 (37%) имелись метастазы в головной мозг и печень, еще у 6 больных — только в печень. Первичная химиотерапия у больных низкого риска состояла в назначении метотрексата и дактиномицина. Большинство больных высокого риска получали метотрексат, дактиномицин и хлорамбуцил. Всех больных с метастазами в головной мозг подвергли лучевой терапии. Полная ремиссия зарегистрирована всего в 91% случаев; для больных группы низкого риска частота полных ремиссий составила 98,4%; для больных группы высокого риска — 66%. Начиная с 1989 г., наметилась тенденция лечить часть больных этопозидом, метотрексатом, дактиномицином, циклофосфамидом и винкристином.
Опыт онкологического центра в г. Дели по определению целесообразности лечения больных группы высокого риска показал, что трофобластическая болезнь обладает высоким курабельным потенциалом. Это было продемонстрировано на примере химиотерапии 54 больных трофобластической болезнью (19 с хориокарциномой). Почти у всех выявлены метастазы в различные органы. Лечение прослежено под контролем серийного определения бета-ХГТ. Лечение у 39 человек состояло только из монотерапии метотрексатом или полихимиотерапии. В целом у 51 из 54 больных достигнута полная ремиссия.
Китайские онкологи пишут об успешности полихимиотерапии с использованием фторурацила, винкристина у 33 больных со злокачественными опухолями трофобласта (6 хориокарцином). У большинства больных засвидетельствовано выздоровление, 4 женщины родили нормальных детей. У 3 больных были неудовлетворительные результаты, это были пожилые люди с метастазами в легкие и влагалище.
Особое место в клинике хориокарциномы занимают метастазы в головной мозг, которые, по данным литературы, возникают у 6–20% больных и носят, как правило, множественный характер. Клиническое течение интракраниальных метастазов хориокарциномы имеет особенности, связанные с биологическими свойствами этой опухоли, с наличием кровоизлияний в опухолевом узле и вокруг него. Почти в 40% случаев острое появление метастазов в головной мозг, с быстрым нарастанием симптомов, напоминает картину геморрагического инсульта, и 2/3 больных погибают в короткие сроки.
В связи с развитием резистентности опухоли к проводимому лечению у 15–20% больных необходимо создание новых перспективных схем полихимиотерапии с расширением круга применяемых химиопрепаратов, таких как доксорубицин, препараты платины, этопозид.
Для борьбы с медикаментозной резистентностью у больных группы высокого риска китайские специалисты рекомендуют использовать метод катетеризации артерий вблизи опухоли или непосредственно питающих ее.
Корейские онкологи сообщают об опыте полихимиотерапии у 15% больных, резистентных ко всем видам лечения. Авторы использовали свою прогностическую систему в сочетании с некоторыми элементами стадирования по FIGO и балльной системы экспертов ВОЗ. Они считают, что точный выбор химиотерапевтических агентов играет решающую роль в судьбе больных. В лечении использовали также по показаниям хирургическое лечение, включая гистерэктомию, торакотомию и краниотомию после химиотерапии. Из общего числа 737 больных, получивших такое комбинированное лечение, полную ремиссию удалось получить у 96,4% больных в группе низкого риска, у 93,5% — среднего риска и только у 70,4% больных высокого риска; в среднем по всей серии — у 86,4% больных. Для получения стойкой ремиссии, как считают авторы, исключительное значение приобретает продолжительность лечения как профилактики рецидива болезни. Согласно балльной оценке, все больные низкого, среднего и высокого риска должны получить не менее 3 курсов (6 нед), четыре курса (10 нед) и пять курсов (12 нед) соответственно.
Огромным достоинством современной противоопухолевой лекарственной терапии хориокарциномы матки является не только излечение значительной части больных, но и сохранение у многих из них нормальной детородной функции.
Вызывает значительный интерес способность к зачатию у женщин с хориокарциномой после лечения химиотерапевтическими агентами. Так, Tscherne сообщает, что за 12 лет у 13 женщин было 18 беременностей, наступивших через 1 год и более после окончания лечения цитостатическими средствами трофобластической болезни. 12 женщинам проведено 1–3 курса лечения метотрексатом, 1 — сочетанием его с дактиномицином. У 3 женщин, имевших за период наблюдения 4 беременности, одна закончилась выкидышем, 3 — искусственным абортом. 1 женщина продолжала на момент публикации находиться под наблюдением по поводу нормально развивающейся беременности при сроке 33 нед. У остальных 10 женщин было 13 беременностей. У 7 из них имелась небольшая (1 группа), у 3 — высокая степень риска рецидива опухолевого процесса (2 группа), в 1 группе спонтанные роды были у 6 пациенток, кесарево сечение произведено у 1 женщины, во 2 группе — соответственно у 2 и 1 женщин. Роды были в срок у 6 женщин 1 группы и преждевременными — у 1 женщины с двойней. У женщин 2 группы все роды были своевременными. Все женщины 1 и 2 групп родили живых и здоровых детей за исключением 1 женщины 1 группы, у ребенка которой в последующем диагностировали целиакию.
Таким образом, проблемы ранней диагностики заболевания далеко еще не решены не только на уровне специализированных учреждений, но и, что особенно важно, на уровне врачей широкой поликлинической сети. Это объясняется тем, что мало внимания уделяется разработке и использованию надежных, неинвазивных диагностических методов, таких как УЗТ или радиоизотопные методы исследования. Представляется целесообразным углубить исследования по использованию диагностических возможностей этих неинвазивных методов на современном уровне, что позволит во многом решить вопросы, связанные с ранней диагностикой заболевания, существенно влияющей на результаты лечения.
Предложенные исследователями многообразные дифференцированные схемы комбинированной химиотерапии, которые были использованы для лечения хориокарциномы матки, оказались высокоэффективными и позволили улучшить результаты лечения, в т.ч. и по отношению к таким тяжелым больным, которые имели метастазы в легкие и головной мозг. Более высокая эффективность полихимиотерапии по сравнению с монохимиотерапией отразилась также и на сокращении числа оперативных вмешательств по поводу опухолей трофобласта.
Несмотря на то что в литературе имеется значительная информация по применению различных противоопухолевых лекарственных препаратов, каждый из которых обладает избирательным действием на опухоль, клиницисты еще недостаточно уделяют внимания разработке и внедрению агрессивных комбинаций полихимиотерапии, способных преодолеть резистентность опухоли. Мало внимания уделяется вопросам разработки 2-й линии химиотерапии в случае резистентности опухоли к стандартным химиопрепаратам. В то же время, как показывают литературные источники, создание более агрессивных схем химиотерапии позволяет преодолеть резистентность опухоли и тем самым улучшить результаты лечения.
Приоритетные исследования, доказавшие ведущую роль химиотерапии в лечении трофобластической болезни в СССР, принадлежат члену-корреспонденту РАМН, профессору Л.А. Новиковой и ее школе. Благодаря проведенным в ГУ РОНЦ им. Н.Н. Блохина РАМН работам, удалось сохранить репродуктивную функцию у сотен молодых пациенток, а рожденные ими здоровые дети являются бесспорными и счастливыми аргументами правильности избранного направления.
Клиническая картина трофобластической болезни чрезвычайно разнообразна и неординарна. Однако основным патогомоничным симптомом этого заболевания все-таки являются беспорядочные кровянистые выделения различной степени интенсивности, которые иногда могут быть и гнойного характера, что обусловлено распадом опухолевых узлов в матке. Особенно это должно настораживать клинициста, если они возникли после предшествующей беременности, которая, при тщательном изучении анамнеза больной, могла закончиться пузырным заносом, медицинским, самопроизвольным абортом или родами. Боли внизу живота возникают у этого контингента больных в более запущенных состояниях, когда имеет место прорастание опухолью всех стенок матки и возникает угроза разрыва опухолевого узла — опасность внутрибрюшного кровотечения! В некоторых случаях боли внизу живота могут быть связаны с возможным перекрутом ножки лютеиновой кисты яичника.
Существенную роль в постановке диагноза трофобластической болезни имеют данные бимануального гинекологического исследования, при котором выявляются характерные признаки заболевания, проявляющие в виде цианоза слизистой влагалища и шейки матки, определенная размягченность матки, некоторое увеличение ее размеров, болезненность при пальпации, в некоторых случаях определяются текалютеиновые кисты яичников.
Возникают ситуации, когда к врачу впервые обращается больная, чаще всего молодого возраста, с бледными кожными покровами, одышкой, а иногда и кровохарканьем. В этих случаях, после тщательно собранного анамнеза, выяснив характер предшествующей заболеванию беременности и нарушение менструальной функции, показано рентгенологическое исследование грудной клетки, которое выявит специфическую картину метастатического поражения легких, характерную для опухолей трофобласта.
Диагностика доброкачественной формы трофобластической болезни — пузырного заноса в настоящее время не представляет больших сложностей, т.к. кроме несоответствия размеров матки сроку задержки менструации (размеры матки больше срока задержки) определяется типичная для этого заболевания картина при УЗИ малого таза.
Ранняя диагностика трофобластической болезни на современном этапе построена на использовании трех основных методов:
1) клиническая картина заболевания,
2) исследование бета-субъединицы ХГ в сыворотке крови,
3) данные УЗИ малого таза.
Комплексное сочетание этих методов является тем необходимым и минимальным диагностическим набором в клинике, который позволяет почти со стопроцентной уверенностью поставить диагноз опухоли трофобласта и вовремя начать специфическое лечение, от чего во многом зависят результаты терапии. В случае выявления этого заболевания всем больным показано рентгенологическое исследование грудной клетки на предмет выявления метастазов опухоли в легких, а при их наличии целесообразно произвести КТ головного мозга (есть ли поражение метастатической опухолью?).
Благодаря достижениям современной лекарственной терапии удается не только полностью излечить большинство больных даже при наличии метастазов в отдаленные органы, но и сохранить у многих женщин детородную функцию.
Если при этом учесть, что хориокарциномой страдают в основном молодые женщины в период их наибольшей социальной активности, актуальность проблемы лечения этого заболевания очевидна.
Хориокарцинома матки, диагностика и лечение
В ГУ РОНЦ им. Н.Н. Блохина РАМН с 1975 г. наблюдалось более 1500 больных различными формами трофобластической болезни, в т.ч. и 442 больных с гистологически верифицированным диагнозом — хориокарцинома матки.
Возраст больных колебался от 16 до 62 лет (средний — 26,2 года). Наибольшее количество больных хориокарциномой было в возрасте от 16 до 40 лет — 96% (рис. 7).
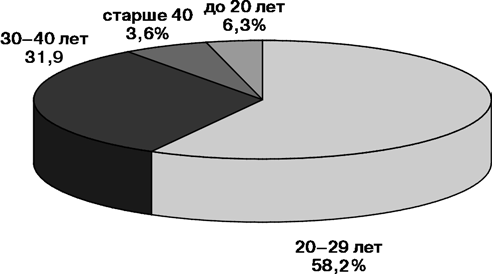
Рисунок 7. Распределение больных хориокарциномой матки по возрасту
Проанализировав анамнез больных и исходы предшествующих развитию заболевания беременностей, удалось выявить, что в большинстве случаев хориокарцинома матки возникла после искусственного прерывания беременности — в 30% случаев, а также после самопроизвольного выкидыша — в 22% случаев и пузырного заноса — в 22% случаев.
В соответствии с современной классификацией (TNM, 1997; FIGO, 2000, табл. 4), мы наблюдали с I стадией заболевания 33% больных, со II стадией — 9% больных, с III стадией — 45% больных и с IV — 13% больных. Таким образом, большинство больных имели метастазы опухоли в легкие и другие отдаленные органы (стадии III-IV).
Таблица 4
Распределение больных по стадиям заболевания
(FIGO, 2000 г.)
| Стадия | Число больных | % |
| I (a, b, c) | 144 | 32,6 |
| II (a, b, c) | 39 | 8,8 |
| III (a, b, c) | 202 | 45,7 |
| IV (a, b, c) | 57 | 12,9 |
Как известно, хориокарцинома матки метастазирует гематогенным путем, поэтому отдаленные метастазы опухоли могут выявляться в самых неожиданных местах. Наиболее часто метастазами поражаются легкие, вульва и головной мозг. Печень, почки, кишечник и селезенка поражаются значительно реже легких, а другие органы и ткани лишь у отдельных больных. При развитии метастазов появляются симптомы, обусловленные их локализацией. Так, при метастатическом поражении легких появляется кашель с мокротой и боли в грудной клетке, при метастазах в мозг — головные боли, рвота, гемиплегия и другие неврологические симптомы. При поражении органов ЖКТ — тошнота, рвота, боли в животе и желудочно-кишечные кровотечения.
В своих наблюдениях мы отмечали следующую локализацию метастазов (табл. 5).
Таблица 5
Локализация метастазов хориокарциномы матки
| Локализация метастазов | Число больных | % |
| Легкие | 116 | 26 |
| Легкие + малый таз (влагалище, параметрии) | 83 | 18 |
| Легкие + отдаленные органы | 60 | 14 |
| + мозг | 33 | 7,5 |
| + печень | 16 | 3,7 |
| + почки | 12 | 2,7 |
| + надпочечник | 4 | 0,9 |
| + селезенка | 8 | 1,8 |
| + поджелудочная железа | 4 | 0,9 |
| + под кожу (область головы, пупка, молочной железы) | 5 | 1,1 |
| + бедренная кость | 1 | |
| + фаланга пальца + верхняя челюсть |
1 1 |
|
| + лимфоузлы средостения | 1 | |
| + щитовидная железа + слюнная железа |
1 1 |
|
| + желудок + слепая кишка |
1 1 |
|
| + большой сальник | 2 | |
| + яичники | 8 | 1,8 |
Одним из наиболее современных и надежных диагностических методов при хориокарциоме матки являются: определение показателей бета-субъединицы ХГ и УЗТ, которая по своим диагностическим возможностям не уступает КТ и МРТ. Использование этих методов позволяет убедительно, четко и своевременно информировать клиницистов о динамике заболевания в процессе лечения.
Применение современной методики определения бета-субъединицы ХГ позволило существенно уменьшить число ложноотрицательных реакций и значительно повысить диагностическую ценность этого серологического маркера (98%). Кроме того, данный метод дает возможность качественно проводить мониторинг за динамикой заболевания в процессе лечения.
Применение УЗТ позволяет уточнить клинический диагноз, определить локализацию опухоли в матке и по отношению к оболочкам матки установить размеры и структуру опухолевого узла, выявить особенности сосудистого русла матки, состояние придатков и сосудов малого таза. Проведение подобной уточняющей диагностики позволяет клиницистам получить полноценное представление о местном распространении трофобластической опухоли, а в ряде случаев — и об отдаленных метастазах. Эти данные в совокупности с клиническими и лабораторными исследованиями способствуют своевременному и адекватному планированию тактики ведения больной с учетом прогностических факторов.
Информативность УЗТ в диагностике злокачественных трофобластических опухолей матки составляет, по данным М.А. Чекаловой:
— чувствительность — 90,7%;
— специфичность — 73,2%;
— точность — 85,1%.
Широкое использование УЗИ обусловлено успехами консервативного лечения трофобластической болезни и находит применение в качестве метода объективной оценки результатов химиотерапии. Возможность его неоднократного использования в динамике и при дальнейшем наблюдении имеет большое значение для своевременной коррекции тактики лечения трофобластической болезни и профилактики рецидивов. Динамическая ультразвуковая картина, выявляемая на различных этапах лечения, позволяет судить о терапевтической результативности. Иными словами — применение УЗИ у больных трофобластической болезнью позволяет индивидуализировать план лечения, выбирать его оптимальный вариант, контролировать динамику течения заболевания (рис. 8).
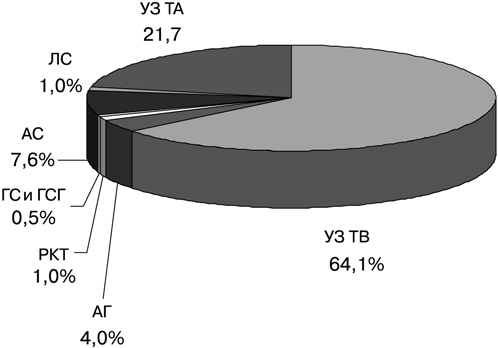
Рисунок 8. Значимость УЗТ в комплексной диагностике трофобластической болезни:
АГ — ангиография; ГСГ — гистеросальпингография; ГС — гистероскопия; РКТ — рентгеновская компьютерная томография; ЛС — лапароскопия; ТА — трансабдоминальное УЗИ; ТБ — трансвагинальное УЗИ; АС — ангиосцинтиграфия
Основным критерием полного терапевтического эффекта при трофобластической болезни следует считать нормализацию ультразвукового изображения матки, а также отсутствие динамики остаточных изменений в области определяемой ранее трофобластической опухоли (рубец, варикозное расширение вен) в течение 2–3 мес.
Внимательно ознакомившись с выписками из историй болезни, присланными из других лечебных учреждений, тщательно анализируя при этом анамнез заболевания, мы с сожалением должны констатировать, что слишком часто врачи при первом обращении к ним больных хориокарциномой матки совершали диагностические ошибки.
Вследствие этих ошибок, пациентки поздно обращались в специализированные клиники, как правило, уже с распространенным заболеванием и наличием отдаленных метастазов в другие органы или же имели длительный временной фактор (момент от начала первых признаков заболевания до начала специфического лечения), что в значительной степени ухудшает прогноз заболевания и значительно снижает шансы на выздоровление.
Так, из 442 больных только у 203 (46%) пациенток правильный диагноз трофобластической болезни был поставлен в первые 3 мес с момента первых клинических признаков возникновения заболевания, если брать за основу отсчета время, прошедшее от последней нормальной менструации. В сроки от 3 до 6 мес, когда уже можно говорить о запущенности заболевания, правильный диагноз болезни был поставлен 181 (41%) больной, у 58 (13%) больных диагноз опухоли трофобласта был выявлен более чем через 6 мес.
Большинство диагностических ошибок было сделано гинекологами на уровне женских консультаций. При этом основной контингент женщин, уже имеющих трофобластическую болезнь, лечили или по поводу дисфункции яичников или воспаления придатков, или по поводу развивающейся или неразвивающейся беременности, шеечной беременности, плацентарного полипа и т.д.
Интересно отметить, что в этой группе у 58 (31%) пациенток в связи с ошибочными диагнозами (дисфункция яичников, плацентарный полип и т.д.) было произведено от 3 и 6 выскабливаний матки в течение 3–6 мес, что, в свою очередь, не только отсрочило правильную постановку диагноза, и, как следствие этого, отодвинуло своевременную лечебную специфическую помощь, но и в значительной степени способствовало прогрессированию заболевания, что связано с травматизацией уже имеющей место опухоли и выбросе при этом опухолевых клеток в кровеносное русло. Подтверждением этого является тот фактор, что у 32 из этих больных во время дальнейшего обследования в клинике были выявлены метастазы в отдаленные органы (легкие, печень, почки, мозг и др.). Вследствие запущенности заболевания 21 больная погибла, несмотря на проводимое интенсивное лечение. Кроме того, большинству этих женщин не было произведено гистологического исследования соскоба эндометрия — у 39 (67%) пациенток.
Таблица 6
Ошибочные диагнозы, поставленные больным хориокарциномой матки при первичном обращении в другие лечебные учреждения
| Ошибочный диагноз | Число больных | % |
| Дисфункция яичников, воспаление придатков матки | 62 | 33 |
| Беременность, патологическая беременность | 36 | 19,3 |
| Внематочная беременность | 24 | 13 |
| Другие заболевания матки (плацентарный полип, эндометрит, миома и др.) |
21 | 11 |
| Пневмония | 15 | 8 |
| Туберкулез легких | 14 | 7,5 |
| Плеврит | 7 | 3,7 |
| Пневмоторакс | 2 | 1 |
| Опухоль легкого | 1 | 0,5 |
| Опухоль почки | 2 | 1 |
| Опухоль слепой кишки | 1 | 0,5 |
| Опухоль головного мозга | 2 | 1 |
| ВСЕГО: | 187 | 100 |
Как показали наши наблюдения, диагностические ошибки свойственны не только акушерам-гинекологам, но и врачам других категорий: терапевтам и физиотерапевтам, которые, неправильно интерпретировав патологию в легких (метастазы), лечили больных по поводу опухоли легкого, почки или слепой кишки, при этом, как оказалось после гистологического исследования, это были метастазы хориокарциномы матки; а также нейрохирургами, удалявшими опухоль — метастаз хориокарциномы в головном мозгу — при наличии у этой же больной метастазов в легкие.
Представленная нами плачевная статистика еще раз заставляет напомнить врачам, в основном поликлинической сети, о необходимости повышении онкологической настороженности по отношению к обращающимся к ним пациенткам и о необходимости постоянного совершенствования профессиональной квалификации, при этом не забывая о преемственности между ними и представителями специализированной онкологической службы.
По мере развития химиотерапии злокачественных опухолей приблизительно в середине 70-х гг. ХХ в. произошло коренное изменение позиции клиницистов: в комплексном лечении хориокарциномы матки ведущую роль стали отводить лекарственной противоопухолевой терапии. С этого времени в клинике начали широко разрабатываться различные схемы комбинированной терапии опухолей трофобласта. При составлении схем и режимов комбинированной химиотерапии учитывали уже известную противоопухолевую активность каждого препарата при опухолях трофобласта и возможное усиление их действия в комбинации, а также побочные явления, которые они вызывают, чтобы не получать перекрестной токсичности.
Со второй половины 70-х гг. ХХ в. мы применяли две схожие по эффективности схемы комбинированной терапии для лечения больных с III-IV стадиями хориокарциномы матки:
— схема 1 — метотрексат + дактиномицин + винбластин;
— схема 2 — метотрексат + даунорубицин + винкристин.
Эти схемы лечения использовались нами с 1975 по 1980 г. у 121 больной хориокарциномой матки (стадии III-IV). Удалось значительно повысить выживаемость в этой тяжелой группе больных: из 113 оцененных больных живы 64 (57%). До использования этих схем лечения — в предыдущие десятилетия, когда применялась монохимиотерапия, — из 153 больных удалось излечить только 61 (40%). Сроки наблюдения — более 3 лет.
Убедившись в достаточно высокой эффективности использованных режимов и их незначительной токсичности, мы продолжили исследования и в следующем пятилетии (1980–1985 гг.), постоянно совершенствуя методику лечения. При этом нам удалось добиться излечения 34 (68%) из 50 наблюдаемых больных с III-IV стадиями заболевания.
Кроме того, проведя анализ количества операций (гистерэктомия) в эти годы по сравнению с предыдущей пятилеткой, мы установили, что в первое пятилетие они были сделаны у 100 (60%) из 167 больных, а в последующее — только у 27 (28%) из 98 больных. Снижение этого показателя, позволяющего судить о нашем стремлении к сохранению репродуктивной способности у молодых женщин, достигнуто в результате использования разработанных нами новых схем комбинированной химиотерапии (рис. 9).
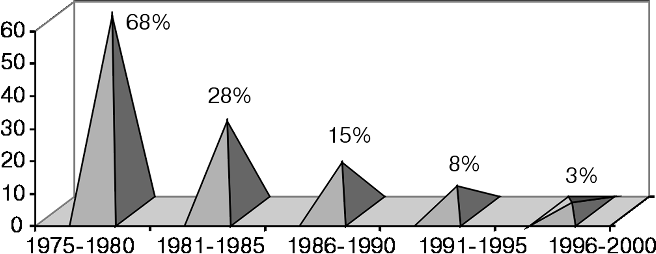
Рисунок 9. Место гистерэктомии в комбинированном лечении больных хориокарциномой матки
Первый успешный опыт использования комбинированной химиотерапии в лечении хориокарциномы матки и особенно в терапии ее диссеминированных форм побудил нас продолжить поиски в этом направлении. С целью предотвращения развития возможной резистентности опухоли и достижения большего терапевтического эффекта было предложено включить в комбинацию 4 химиопрепарата: метотрексат, дактиномицин, даунорубицин и винкристин.
Этот достаточно современный режим лечения больных хориокарциномой матки III и IV стадий использовался нами в клинике в последние годы у 39 больных, при этом 3 года пережила 31 (79,5%) больная. Более того, нам удалось впервые излечить одну больную с метастазами во влагалище, легкие и головной мозг, не прибегая к облучению головного мозга.
Следует отметить, что тенденция к снижению количества операций сохранялась. Так, начиная с 1985 г. в нашей клинике было произведено только 13 оперативных вмешательств в объеме удаления матки, что составило 15% от числа всех больных хориокарциномой матки, лечившихся в этот период.
С появлением в арсенале противоопухолевых средств таких эффективных химиопрепаратов, как цисплатин и этопозид, нами были предложены в последние годы две новые схемы лечения. В качестве 1-й линии химиотерапии для больных с распространенным заболеванием (стадии III-IV) и 2-й линии — для больных с резистентной формой заболевания (стадии III-IV) использовали комбинацию ЦМДВ (цисплатин + метотрексат + дактиномицин + винкристин). Кроме того, в качестве 2-й линии химиотерапии для больных с резистентной местнораспространенной формой заболевания (стадия I-II) применена комбинация ЦЭ (цисплатин + этопозид).
При применении 1-й линии лечения у 26 больных с III-IV стадией заболевания был получен наиболее высокий показатель для этой группы больных — полный лечебный эффект достигнут у 21 (81%) больной, все они живы до настоящего времени.
Применяя схему ЦМДВ в качестве 2-й линии химиотерапии у наиболее тяжелого и малоперспективного контингента больных с резистентной формой заболевания, имеющих метастазы в отдаленные органы, выявили выраженную эффективность предложенной комбинации: у 6 (37,5%) из 16 больных нам удалось добиться стойкого лечебного эффекта, в т.ч. и у больных с метастазами опухоли в головной мозг, сроки наблюдения — более 3 лет (табл. 7).
Таблица 7
Результаты лечения больных хориокарциномой матки с метастазами в отдаленные органы и резистентной формой заболевания
| Стадия заболевания | Режим лечения |
Число больных |
Живы | Умерли | Выживаемость, % |
| III-IV | 1-я линия ЦМДВ |
26 | 21 | 5 | 81,0±10,3 |
| I-II | 2-я линия ЦЭ |
7 | 7 | 100 | |
| III-IV | ЦМДВ | 16 | 6 | 10 | 37,5±15,6 |
| Всего: | 49 | 34 | 15 | 69,5±11,4 |
Полученные нами результаты лечения больных хориокарциномой матки свидетельствуют: наиболее перспективным режимом полихимиотерапии в лечении трофобластических болезней с запущенными метастатическими формами заболевания являются комбинация ЦМДВ, что дает нам основание рекомендовать эту современную схему химиотерапии как наиболее эффективную при лечении тяжелого контингента больных с III и IV стадиями заболевания для применения в практической работе онкологов.
Кроме того, эта схема в качестве 2-й линии полихимиотерапии является неплохим резервом и в случае возникновения резистентности опухоли к уже проведенной стандартной химиотерапии. А в тех случаях, когда у больных с I и II стадиями отмечалась резистентность опухоли к лечению стандартными препаратами, великолепно зарекомендовала себя в качестве 2-й линии химиотерапии комбинация ЦЭ.
Используя комбинацию ЦЭ у 7 больных с резистентной местнораспространенной формой заболевания, нам удалось их полностью излечить, не прибегая к оперативному вмешательству (см. табл. 7).
Следует отметить, что большим преимуществом разработанных нами высокоэффективных схем комбинированной химиотерапии является их экономическая доступность, а относительная простота применения позволяет рекомендовать проведение этой химиотерапии в амбулаторных условиях широкой онкологической сети.
Облучая метастазы опухоли в головной мозг при комбинированном лечении 17 больных хориокарциномой матки с метастазами в легкие и головной мозг одновременно, мы впервые в отечественной клинической практике излечили 6 больных.
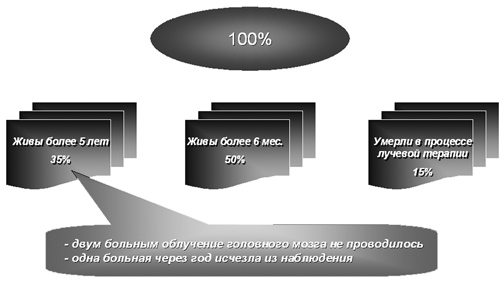
Рисунок 10. Результаты лечения больных хориокарциномой матки с метастазами в головной мозг

Рисунок 11. Метастаз хориокарциномы в головной мозг:
В настоящее время после решительного пересмотра клиницистами назначения хирургического метода в лечении больных трофобластической болезнью, что во многом обусловлено успехами химиотерапии, показания к оперативному вмешательству при хориокарциноме матки резко сузились и могут иметь место в основном только в экстренных ситуациях, при угрозе жизни больной, что может быть связано с маточным кровотечением или возможностью возникновения внутрибрюшного кровотечения из распадающегося опухолевого узла в матке.
В заключение, основываясь на анализе большого клинического опыта по лечению больных хориокарциномой матки, мы рекомендуем клиницистам использовать следующие наиболее эффективные схемы химиотерапии, хорошо зарекомендовавшие себя в терапии опухолей трофобласта.
Лечение доброкачественной формы трофобластической болезни — пузырного заноса — в основном сводится к его удалению с помощью вакуум-аспирации, после чего проводится динамическое наблюдение не менее 8 нед, которое сводится к исследованию ХГ (1 раз в неделю) и УЗИ малого таза (1 раз в 2 нед). При отсутствии признаков болезни (ХГ и УЗИ) и восстановления нормального менструального цикла химиотерапия не показана. Дальнейшее исследование ХГ в сыворотке крови проводят 1 раз в 2 нед в течение 3 мес, а далее 1 раз в месяц в течение полугода.
В случае если через 8 нед после эвакуации пузырного заноса не наблюдается нормализации показателей ХГ, менструальный цикл не восстановился, а при УЗИ малого таза определяются патологические очаги в матке, показана химиотерапия (см. схему лечения при I-II стадиях). Кроме того, этому контингенту больных необходимо рентгенологическое исследование грудной клетки с целью исключения метастатического поражения легких.
Без сомнения, абсолютным показанием к проведению химиотерапии является гистологическая верификация заболевания — хориокарцинома матки — которая может быть получена в результате гистологического исследования соскоба матки, в более редких случаях — легких, почки, кишечника и т.д., в зависимости от произведенного оперативного вмешательства, связанного с локализацией опухоли.
Для больных с I-II стадией заболевания
1. В качестве 1-й линии химиотерапии:
1 схема: метотрексат — 50 мг, в/м, 1, 3, 5 и 7 день; кальция фолинат — 6 мг, в/м, через 30 ч после введения метотрексата во 2, 4, 6 и 8 дни. Повторение курсов химиотерапии — с 14 дня (от 1 дня химиотерапии).
2 схема: метотрексат (по 20 мг/м2, в/в, 1 раз в 3 дня до суммарной дозы 150–180 мг) + дактиномицин (по 500 мкг, в/в, через день до суммарной дозы 3,5–4 мг). Курсы лечения повторяются каждые 2 нед.
2. В качестве 2-й линии химиотерапии в случае возникновения резистентности опухоли к предыдущему лечению: цисплатин (по 100 мг/м2, в/в капельно, с водной нагрузкой и на фоне противорвотной терапии в 1 день), этопозид (по 150 мг, в/в капельно, во 2, 3, 4, 5 и 6 дни). Курсы лечения повторяются каждые 2 нед.
Для больных с III-IV стадией заболевания
Схема ЦМДВ: цисплатин (по 100 мг/м2, в/в капельно, с водной нагрузкой и на фоне противорвотной терапии), метотрексат (по 20 мг/м2, в/в, 1 раз в 3 дня до суммарной дозы 180–200 мг), дактиномицин (по 500 мкг, в/в, через день до суммарной дозы 4 мг), винкристин (по 1,5 мг, в/в, 1 раз в неделю до суммарной дозы 4,5 мг).
Курсы лечения повторяются каждые 2–3 нед при нормальных показателях креатинина и нейтрофилов.
Кроме того, для больных с плохим прогнозом, заслуживают внимания схемы EMA-CO и EHMMAC, широко используемые в клиниках США и Великобритании.
EMA-CO (для больных с плохим прогнозом)
Курс 1
1 день: этопозид — 100 мг/м2 (инфузия за 30 мин) + метотрексат — 100 мг/м2, в/в, с последующей 12-часовой инфузией метотрексата 200 мг/м2 + дактиномицин 0,5 мг, в/в.
2 день: этопозид — 100 мг/м2 (инфузия за 30 мин) + дактиномицин — 0,5 мг, в/в + кальция фолинат — 15 мг перорально или в/м каждые 12 ч 4 дозы, начиная через 24 ч после метотрексата.
Курс 2
8 день: винкристин — 1 мг/м2, в/в + циклофосфамид — 600 мг/м2, в/в (за 30 мин).
Альтернирующие курсы проводятся еженедельно, т.о., лечение проводится в 1, 2, 8, 15, 16, 22 дни.
EHMMAC (альтернативное лечение для больных с плохим прогнозом)
Курс 1
Этопозид — 100 мг/м2, в/в, в 200 мл физиологического раствора ежедневно в 1–5 дни.
Курс 2
Гидроксикарбамид — 0,5 г перорально, с повторением каждые 12 ч (всего 2 дозы), в 1–5 дни + метотрексат — 50 мг (или 1 мг/кг, но не более 70 мг), в/м, каждые 48 ч 4 дозы во 2, 4, 6 и 8 дни + кальция фолинат — 6 мг, в/м, через 30 ч после каждой дозы метотрексата и 75 мг перорально в альтернирующие (неметотрексатные) дни.
Курс 3
Дактиномицин — 0,5 мг, в/в, c 1 по 5 дни.
Курс 4
Винкристин — 1 мг/м2, в/в, + циклофосфамид — 400 мг/м2, в/в, 1 и 3 дни.
Курс проводят с интервалом 10–14 дней в зависимости от токсичности.
При наличии метастазов в головной мозг следует проводить облучение головного мозга по схеме: на весь головной мозг — при разовых дозах 2–3 Гр 5 раз в неделю до суммарной дозы 30 Гр и локальными полями на опухолевый очаг при разовой дозе 2 Гр до СОД 10 Гр. При проведении облучения с целью предотвращения или уменьшения отека головного мозга необходимо проводить дегидратационную терапию.
Следует отметить, что после исчезновения всех проявлений заболевания (достижение полной ремиссии) и при завершении основного индукционного лечения мы считаем целесообразным рекомендовать проведение еще 1–2 курсов однотипной профилактической химиотерапии.
Проведенные исследования позволили нам разработать рекомендации по дальнейшему мониторингу за излеченными больными. Мы установили, что оптимальный срок для наступления желанной беременности не менее 1 год после последнего профилактического курса химиотерапии для пациенток с I-II стадиями заболевания и 1,5 года — с III и IV стадиями заболевания. Кроме того, наши наблюдения показали, что оптимальным вариантом предохранения от нежелательной и несвоевременной беременности для женщин, перенесших трофобластическую болезнь, является гормональная контрацепция (при этом регулируется и функция яичников, которая была нарушена вследствие перенесенного заболевания и проводимой химиотерапии).
Дальнейшие наблюдения за леченными в ГУ РОНЦ им. Н.Н. Блохина РАМН больными подтвердили правильность избранного нами исследовательского пути.
Менструальный цикл восстановился через 1–2 мес после окончания специфического лечения у 280 пациенток (90,3%) из 310 женщин, которые не были оперированы, при этом у 142 (50,7%) больных ранее имелись метастазы опухоли в легкие.

Рисунок 12. Восстановление репродуктивной функции у излеченных больных
В последующем из 280 менструирующих женщин у 221 (71%) наступила беременность в различные сроки после окончания лечения и у 181 (65%) она закончилась благополучными родами, а 52 из них рожали дважды.
Следует отметить, что если со стороны новорожденных процент патологии отмечался такой же, как и в популяции женщин, не страдающих ранее хориокарциномой матки, то патология в родах у наблюдаемых нами пациенток была незначительно выше.
В заключение хочется отметить, что в настоящее время — на современном уровне развития химиотерапии и онкогинекологии — основным принципом в терапии больных хориокарциномой матки является сохранение детородной функции пациенток, при этом, безусловно, не в ущерб жизни больных.
Литература
Жорданиа К.И. и др. ...Акушерство и гинекология.— 1981.— № 7.— C. 55–56.
Козаченко В.П. и др. ...Вопр. онкологии.— 1982.— № 5.— C. 97–103.
Новикова Л.А. и др. Хорионэпителиома матки: Клиника и лечение.— Л., Медицина, 1968.— 160 c.
Татаринов Ю.С. и др. ...Бюлл. эксперим. биол. и мед.— 1975.— Т. 80.— № 9.— С. 86–89.
Трофобластические болезни: Серия технических докладов. Всемирная организация здравоохранения, Женева, 1985.
Чекалова М.А. Ультразвуковая диагностика злокачественных опухолей тела матки: Дис. ... докт. мед. наук.— М, 1998.
Athanassion A. et al. ...Cancer.— 1983.— V. 52 (9).— P. 1728–1735.
Bae S.N. et al. ...VII World congress on gestational trophoblastic disease: Abstracts. 1994, Hong Kong.— P. 35.
Bagshawe K. ...Cancer.— 1976.— V. 38 (3).— P. 1373–1385.
Bagshawe K. et al. ...Cancer epidemiology and prevention.— Philadelphia: Saunders, 1982.— P. 909–924.
Bakri Y.N. et al. ...Gynecol.Oncol.— 1993.— V. 48 (1).— P. 110–113.
Berkowitz R. et al. ...Gynecol. Oncol.— 1986.— V. 23 (1).— P. 111–118.
Bolis G. et al. ...Gynecol. Oncol.— 1988.— V. 31 (3).— P. 439–444.
Bower M. et al. ...G. Clin. Oncol.— 1997.— V. 15.— P. 2636–2643.
Castrillon D.H. et al. ...Am. J. Surg. Pathol.— 2001.— V. 25.— P. 1225–1230.
Chan L. et al. ...Singapore med. J.— 1972.— V. 13 (2).— P. 85–86.
DuBeshter B.et al. ...Obstet. gynecol.— 1987.— V. 69 (3).— P. 390–395.
Feltmate C.M. et al. ...Gynecol. Oncol.— 2001.— V. 82.— P. 415–419.
Fisher R.A. e al. ...Hum. Reprod.— 2000.— V. 15.— P. 594–598.
Fukunaga M. et al. ...Mod. Pathol.— 1993.— V. 6.— P. 353–359.
Gaber L.W. et al. ...Am. J. Clin. Pathol.— 1986.— V. 85.— P. 722–724.
Golo S. et al. ...Gynecol.Oncol.— 1993.— V. 48.— P. 165–170.
Goldstein D. et al. ...Semin. Oncol.— 1982.— V. 9 (2).— P. 191–197.
Goldstein D. et al. ...VIII World congress on gestational trophoblastic gisease. 3–6 november 1996, Seoul, Korea.— P. 33.
Hando T. et al. ...J. Japan soc. cancer therapy.— 1973.— V. 10.— P. 111–112.
Helwani M.N. et al. ...Hum. Genet.— 1999.— V. 105.— P. 112–115.
Jones W. ...VII World congress on gestational trophoblastic disease. 6–9 november 1994, Hong Kong.— P. 33.
Kim J.H. et al. ...ibid.
Kim S.J. ...ibid.— P. 39.
Kircheisen R. et al. ...Hum. Reprod.— 1994.— V. 9.— P. 1783–1784.
Kohorn E.I. ...Int. J. Gynecol. Cancer.— 2001.— V. 11.— P. 73–77.
Kohorn. ...J. Reprod. Medicina for the obstetrician and gynecologist.— 2002.— V. 47 (6).— P. 445–450.
Lewis J. ...Cancer.— 1993.— V. 71 (4 suppl.).— P. 1639–1647.
Lurain J. et al. ...Obstet. Gynec.— 1982.— V. 60 (3).— P. 354–360.
Lurain J.R. ...J. Reprod. Med.— 1987.— V. 32 (9).— P. 675–679.
Matalon M. et al. ...Am. J. Obstet. Gynecol.— 1972.— V. 112 (1).— P. 107–112.
Mosher R. et al. ...J. Reprod. Med.— 1998.— V. 43.— P. 21–27.
Mu R.X. et al. ...VII World congress on gestational trophoblastic disease: Abstracts. 1994, Hong Kong.— P. 41.
Newlands E. et al. ...Br. J. Obstetr. Gynecol.— 1986.— V. 93.— P. 63–69.
Newlands E. et al. ...VIII World congress on gestational trophoblastic disease.— 1996, 3–6 november, Seoul, Korea.— P. 36.
Niehans G.A. et al. ...Cancer.— 1988.— V. 62.— P. 1113–1123.
Redline R.W. et al. ...Hum. Pathol.— 1988.— V. 29.— P. 505–511.
Seckl M.J. et al. ...Lancet.— 2000.— V. 356.— P. 36–39.
Sensi A. et al. ...Eur. J. Hum. Genet.— 2002.— V. 8.— P. 641–644.
Seoud M. et al. ...Obstet. Gynecol.— 1995.— V. 86.— P. 692–695.
Shih I.M. et al. ...Am. J. Surg. Pathol.— 1998.— V. 22.— P. 1393–1403.
Song H.Z. et al. ...VII World Congress on Gestational Trophoblastic Disease: Abstracts. 1994, Hong Kong.— P. 36.
Soper J.K. et al. ...Obstet. Gynecol.— 1988.— V. 71 (3).— P. 338–343.
Soper J.K. et al. ...Obstet. Gynecol.— 1994.— V. 83.— P. 113–117.
Tscherne G. ...Geburtsh. Frauenheilk.— 1987.— V. 47 (4).— P. 267–269.
Willemse P.H. et al. ...Obstet. Gynecol.— 1988.— V. 71 (3).— P. 238–240.
Wong L.C. et al. ...VII World congress on gestational trophoblastic disease: Abstracts. 1994, Hong Kong.— P. 32.
Yang X.Y. et al. ...ibid.— P. 46.
Yim C. et al. ...Gynecol. Oncol.— 1979.— V. 8 (3).— P. 296–300.
Описание проверено экспертом
Оцените статью:
- Хориокарцинома матки
- Хорионкарцинома матки
- Хорионэпителиома матки
- Болезнь злокачественная гестационная трофобластическая
- Неоплазия трофобластическая
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).



