K20 Эзофагит, МКБ-10
Отредактировано: 20.02.2025
Эозинофильный эзофагит
Определение
Эозинофильный эзофагит (ЭоЭ) – это хроническое, медленно прогрессирующее иммунно-опосредованное заболевание пищевода, характеризующееся значительной эозинофильной инфильтрацией слизистой оболочки (более 15 эозинофильных лейкоцитов в поле зрения микроскопа высокого разрешения при увеличении ×400 или более 60 в 1 мм²), а также развитием подслизистого фиброза. Клинически заболевание проявляется дисфункцией пищевода, включая дисфагию, обтурацию просвета пищевода пищевым комком, рвоту и другие нарушения [1].
Классификация
Единая классификация ЭоЭ на сегодняшний день не разработана. Однако существует деление по степени клинико-морфологической активности, определяемое на основе анализа биопсийного материала по шкале активности ЭоЭ (Eosinophilic Esophagitis Severity Index, I-SEE) [2]:
- неактивный ЭоЭ (0 баллов),
- ЭоЭ слабой степени активности (1-6 баллов),
- ЭоЭ средней степени активности (7-14 баллов),
- ЭоЭ с высокой активностью (более 15 баллов).
Выделяют три патогенетических фенотипа ЭоЭ:
- Легкий (ЭoЭ1): нормальная эндоскопическая картина, слабо выраженные эндоскопические и гистологические признаки и хороший ответ на лечение;
- Воспалительный (ЭoЭ2): выраженный воспалительный процесс, подтверждаемый ЭГДС-картиной (отек, экссудат, борозды) и морфологическими изменениями (выраженная эозинофильная инфильтрация), плохой ответ на стандартную терапию;
- Фибростенозирующий (ЭoЭ3): выраженный фиброз стенки пищевода, выявление характерных изменений при ЭГДС (кольца, стриктуры, стеноз), а также соответствующие морфологические изменения (избыток коллагеновых волокон в подслизистом слое).
Этиология
ЭоЭ – многофакторное заболевание, в развитии которого задействованы как генетические факторы, так и факторы окружающей среды. В работах, посвященных поиску генетических предикторов заболевания, выявили ассоциацию с полиморфизмом генов, отвечающих за целостность эпителиального барьера в многослойном плоском эпителии, а также за активность Т2-воспалительного ответа [3, 4].
Низкая распространенность этой патологии у лиц более старшего возраста при максимальной распространенности среди пациентов в возрасте 30-40 лет позволяет предположить значительную роль внешней среды, особенно изменившейся за последние 40-50 лет [2].
Остается популярной гигиеническая гипотеза, обосновывающая рост аллергических заболеваний (в т.ч. ЭоЭ) нарушением естественной антигенной стимуляции иммунной системы из-за общемировой тенденции к повсеместной чистоте и стерильности и избыточного использования дезинфектантов и антибиотиков.
К факторам риска развития ЭоЭ относят [2]:
- загрязнение воздуха, усиление экспозиции аэроаллергенов,
- пищевые аллергены,
- пероральная иммунотерапия (АСИТ), применяемая при сопутствующих аллергических заболеваниях,
- инфекция Helicobacter pylori (обратная ассоциация: микроорганизм может оказывать защитное действие в отношении ЭоЭ, предположительно, за счет активации Т1-иммунного ответа [5]),
- низкая плотность населения,
- особенности родов и младенческого периода (кесарево сечение, преждевременные роды, применение антибиотиков или пребывание в ОРИТ во младенчестве),
- целиакия,
- аутоиммунные заболевания (ЭоЭ может быть ассоциирован с ревматоидным артритом, тиреоидитом Хашимото, рассеянным склерозом и рядом иммунодефицитных состояний).
Патогенез
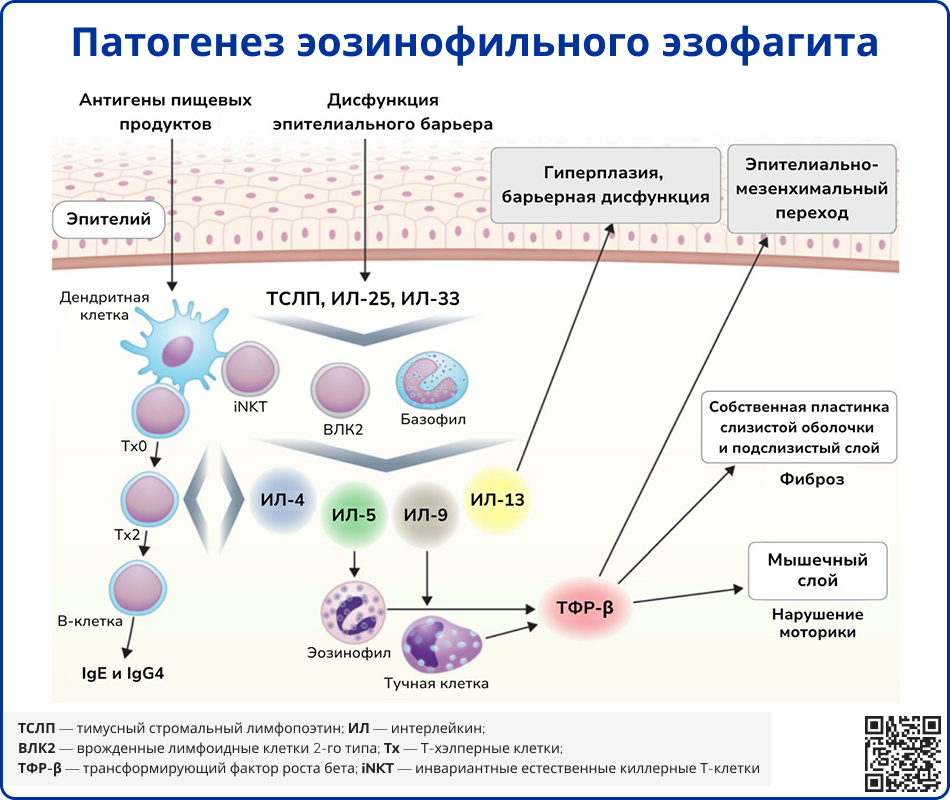
Источник: Davis B. P. Pathophysiology of eosinophilic esophagitis //Clinical reviews in allergy & immunology. – 2018. – Т. 55. – №. 1. – С. 19-42.
ЭоЭ – это воспалительное заболевание пищевода, развивающееся у лиц с генетической предрасположенностью под воздействием факторов окружающей среды. Оно обусловлено сочетанием дисфункции эпителия пищевода и аномального иммунного ответа, опосредованного Т-хелперами 2-го типа (Tх2), на воздействие факторов окружающей среды. Эти процессы приводят к повреждению стенки пищевода, нарушению моторики, ремоделированию тканей и развитию фиброза. Исследования по полногеномному поиску ассоциаций (GWAS) выявили ряд генетических локусов, связанных с ЭоЭ. Большинство из них влияют на барьерную функцию эпителия и Т2-иммунный ответ [4].
Ген тимусного стромального лимфопоэтина (ТСЛП) играет ключевую роль в формировании T2-иммунного ответа [6]. Другие значимые гены связаны с комплексом дифференцировки эпидермиса (1q21), который участвует в регуляции созревания эпителиальных клеток [7].
Подавление синтеза десмоглеина-1, опосредованное действием интерлейкина-13 (ИЛ-13), вызывает нарушение барьерной функции эпителия [8]. В этом процессе также задействован специфический фермент пищевода кальпаин-14, экспрессия которого также увеличивается под действием ИЛ-13 [9]. Также при ЭоЭ наблюдается снижение синтеза филаггрина – одного из ключевых белков эпителиального барьера. Кроме того, выявлено снижение активности ингибиторов SPINK5 и SPINK7, что приводит к неконтролируемой активности сериновых протеаз [3].
Повышенная проницаемость эпителия пищевода и усиленное поступление антигенов провоцируют патологический T2-иммунный ответ, связанный с продукцией цитокинов ИЛ-4, ИЛ-5 и ИЛ-13. ИЛ-4 индуцирует дифференцировку Т-клеток в Tх2-клетки и активирует B-лимфоциты, стимулируя синтез IgE [4]. ИЛ-5 способствует пролиферации, выживанию и миграции эозинофилов [10]. ИЛ-13 индуцирует синтез эотаксина-3 (CCL26), ответственного за хемотаксис эозинофилов, а также повышает экспрессию периостин и трансформирующего фактора роста бета (ТФР-β), усиливая адгезию эозинофилов к фибронектину. ТФР-β способствует развитию фиброза в стенке пищевода, увеличению продукции коллагена и снижению сократимости гладкой мускулатуры [11-13].
ИЛ-13 также стимулирует ремоделирование тканей за счёт усиления синтеза коллагена, ангиогенеза и гиперплазии эпителия. Важное взаимодействие наблюдается между десмоглеином-1 и периостином: снижение уровня первого повышает экспрессию второго, что индуцирует секрецию ТСЛП эпителием пищевода, усиливая T2-ответ и способствуя выживанию эозинофилов, а также активации тучных клеток и базофилов [14, 15].
Клиническая картина
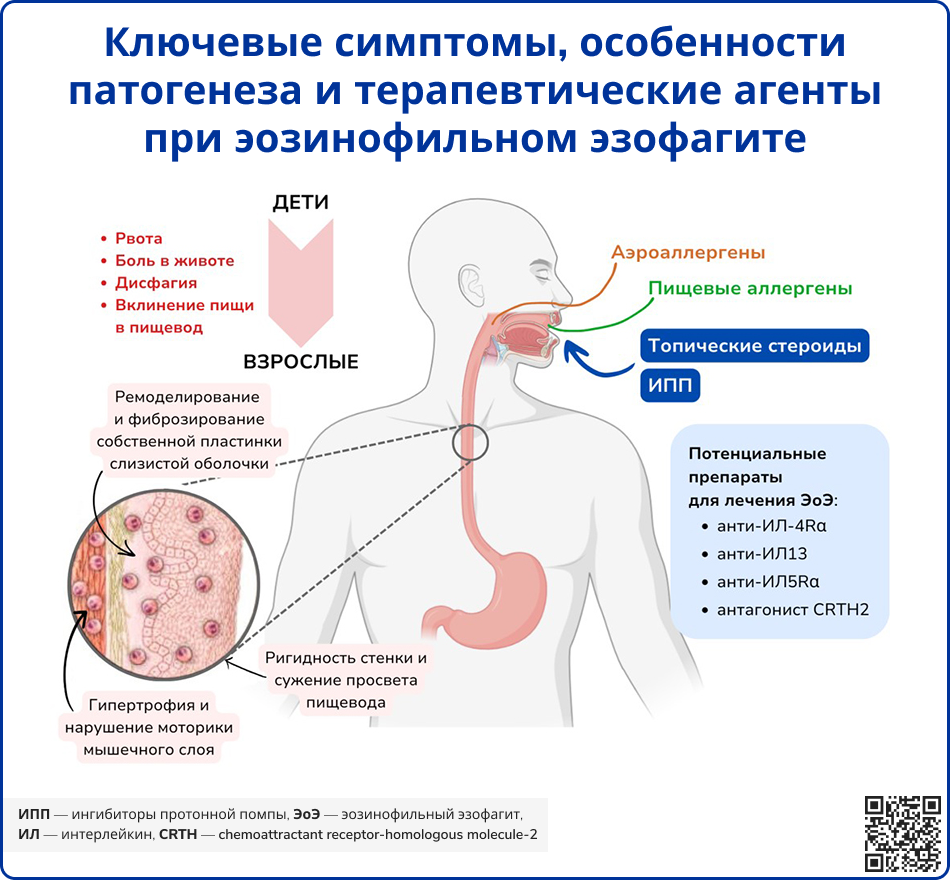
Источник: O’Shea K. M. et al. Pathophysiology of eosinophilic esophagitis //Gastroenterology. – 2018. – Т. 154. – №. 2. – С. 333-345.
Симптоматика ЭоЭ зависит от возраста и длительности заболевания. У детей раннего возраста проявления неспецифичны: срыгивания, тошнота, рвота, трудности при глотании определённой пищи и боли в животе. В подростковом и взрослом возрасте ведущими симптомами становятся дисфагия, необходимость тщательного пережёвывания и запивания пищи водой, эпизоды застревания пищи, изжога и загрудинные боли.
У взрослых пациентов наблюдается прогрессирующее сужение просвета пищевода, проявляющееся дисфагией и загрудинными болями. Возможны эпизоды застревания пищевого комка и, в редких случаях, спонтанный разрыв пищевода (синдром Бурхаве). Дисфагия может носить острый или хронический характер, заставляя пациентов адаптировать пищевые привычки [1, 2].
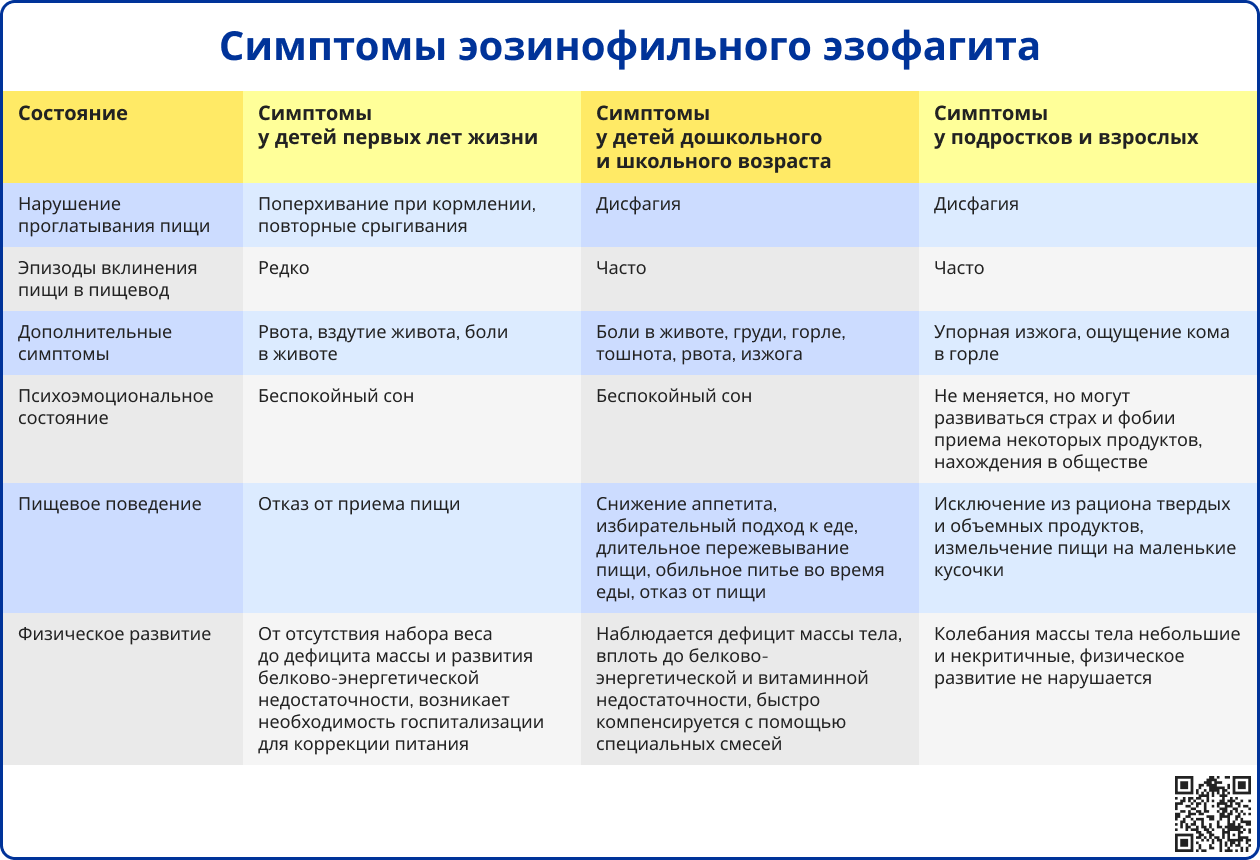
Источник: Кайбышева, В. О. Эозинофильный эзофагит. Переработанное и дополненное издание / В. О. Кайбышева, Л. М. Михалева, Е. Д. Федоров. — Москва: Медиа Сфера, 2024. — 180 c.
_1.png)
Источник: Кайбышева, В. О. Эозинофильный эзофагит. Переработанное и дополненное издание / В. О. Кайбышева, Л. М. Михалева, Е. Д. Федоров. — Москва: Медиа Сфера, 2024. — 180 c.
Диагностика
Алгоритм диагностики
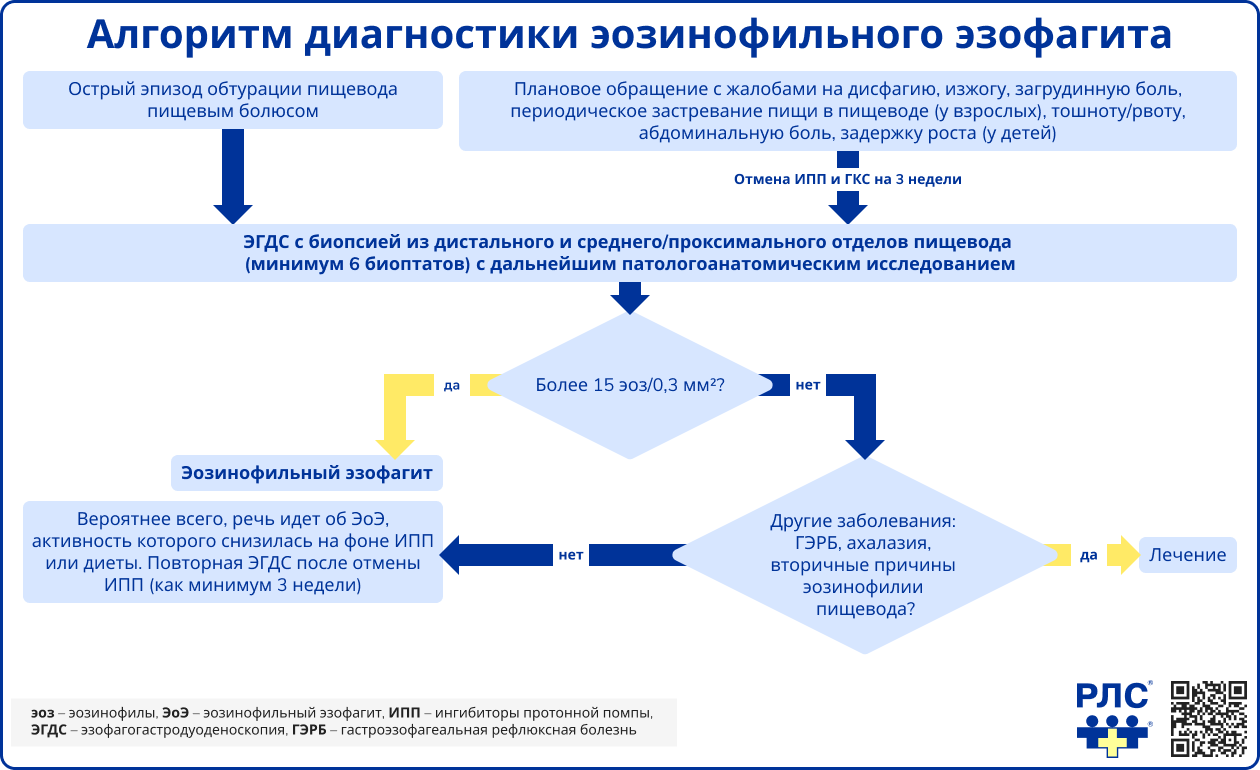
Диагноз «эозинофильный эзофагит» устанавливается при соответствии следующим критериям [1, 2]:
- Клинические симптомы дисфункции пищевода: дисфагия, вклинение пищи у взрослых; рвота, срыгивания, трудности при кормлении и глотании, абдоминальная боль у детей.
- Характерные эндоскопические признаки: отек, множественные концентрические кольца («трахеевидный» пищевод), экссудат, продольные борозды, стриктуры.
- Гистологическое подтверждение эозинофильной инфильтрации пищевода: ≥15 эозинофилов в поле зрения при увеличении ×400 или >60 эозинофилов/мм². При этом необходимо исключить другие возможные причины эозинофилии пищевода.
Анализ жалоб и физикальное обследование
Анализ жалоб и анамнеза помогает выявить типичные признаки ЭоЭ. Физикальное обследование направлено на выявление возможного дефицита питания, задержки физического развития, признаков атопических заболеваний кожи, пищевой аллергии, бронхиальной астмы и других сопутствующих патологий.
Лабораторные исследования
Для исключения других причин эозинофилии пищевода и оценки уровня эозинофилии периферической крови проводится развернутый общий анализ крови.
Оценка сывороточных биомаркеров (IgE, IgG4, провоспалительные цитокины, эотаксин-3, ТСЛП) в настоящее время не используется в клинической практике из-за слабой корреляции с воспалением слизистой пищевода.
Аллергологическое обследование, включая кожные тесты и определение уровня общего IgE или антител к различным аллергенам, не проводится рутинно из-за их низкой информативности. Поскольку эозинофильный эзофагит не связан с реакциями гиперчувствительности немедленного типа, эти тесты не помогают в диагностике и выборе тактики лечения.
Инструментальные исследования
ЭГДС с биопсией – ключевой метод диагностики ЭоЭ, который проводится пациентам с подозрением на это заболевание, особенно при эпизодах вклинения пищи. При отсутствии противопоказаний перед проведением ЭГДС рекомендуется отмена ингибиторов протонной помпы (ИПП) и топических глюкокортикостероидов (тГКС) за 3 недели, чтобы исключить влияние терапии на эндоскопическую картину. Эндоскопическая шкала EREFS* оценивает выраженность основных эндоскопических изменений при ЭоЭ и помогает стандартизировать оценку изменений пищевода, но ее специфичность ограничена [2].
При подозрении на ЭоЭ во время ЭГДС выполняется множественная биопсия. Показания для проведения множественной биопсии включают:
- наличие характерных для ЭоЭ эндоскопических изменений,
- наличие характерных клинических симптомов ЭоЭ (дисфагия, вклинение пищи в пищевод) даже в случае нормальной эндоскопической картины,
- симптомы гастроэзофагеальной рефлюксной болезни (ГЭРБ) у детей (изжога, загрудинная боль, срыгивание), рефрактерные к терапии ИПП, даже в случае нормальной эндоскопической картины.
Для достоверных результатов биопсия берется из 6-8 участков пищевода, предпочтительно из зон с выраженными изменениями слизистой (экссудат, борозды), захватывая весь эпителиальный слой и собственную пластинку для оценки подслизистого фиброза. Диагностическим критерием является эозинофильная инфильтрация с ≥15 эозинофилами в поле зрения микроскопа (х400) или ≥60 эозинофилами на 1 мм². Дополнительно учитывают эозинофильные микроабсцессы, гиперплазию базального слоя эпителия, расширенные межклеточные пространства, поверхностное расположение эозинофилов, мастоцитарную и лимфоцитарную инфильтрацию, удлинение сосочков и фиброз слизистой. Для стандартизации гистологической оценки используется шкала EoEHSS, оценивающая восемь типичных признаков ЭоЭ по шкале 0-3 балла, что помогает детально определить степень поражения слизистой оболочки.
_1.png)
Рентгеноскопия пищевода с контрастированием показана пациентам с ЭоЭ и стойкой дисфагией для выявления и оценки стриктур. Этот метод позволяет точно определить их расположение, протяженность, диаметр сужения и необходимость проведения дилатации или бужирования.
Функциональные исследования (манометрия пищевода высокого разрешения, рН-импедансометрия, импеданспланиметрия) рекомендованы пациентам с дисфагией, сохраняющейся несмотря на проводимое лечение, при отсутствии стриктур по данным эндоскопии. Эти методы помогают оценить сократительную функцию пищевода, состояние нижнего пищеводного сфинктера и исключить ГЭРБ.
Лечение
Алгоритм лечения
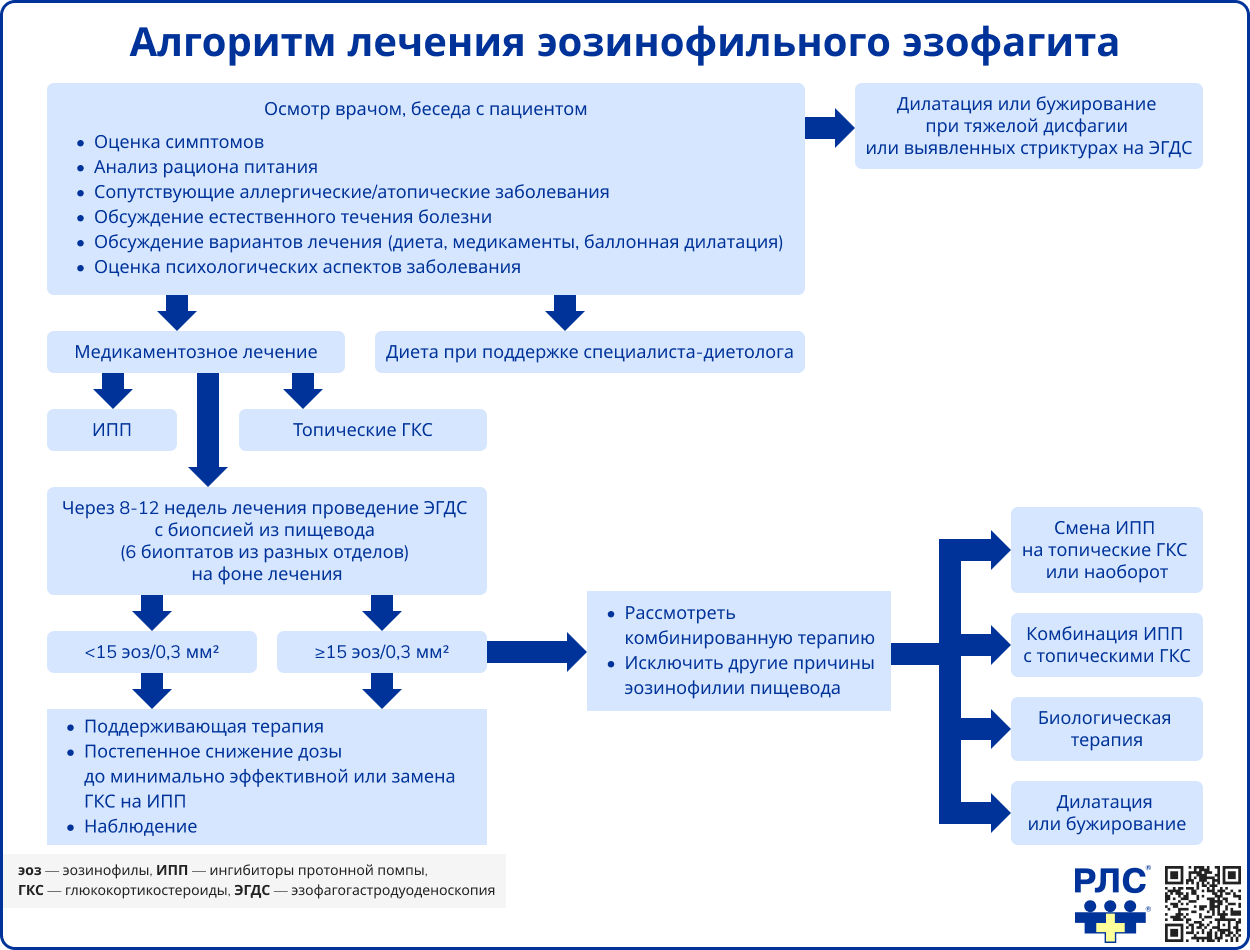
Цель терапии ЭоЭ – достижение клинической и гистологической ремиссии, а также предотвращение осложнений, таких как стриктуры пищевода. После достижения ремиссии лечение необходимо продолжать для поддержания устойчивого результата и профилактики рецидивов. Гистологическая ремиссия определяется как снижение количества эозинофилов в слизистой оболочке пищевода до ≤60 клеток на 1 мм², а полная ремиссия – до <5 эозинофилов в поле зрения при увеличении ×400 [1, 2].
Диетотерапия
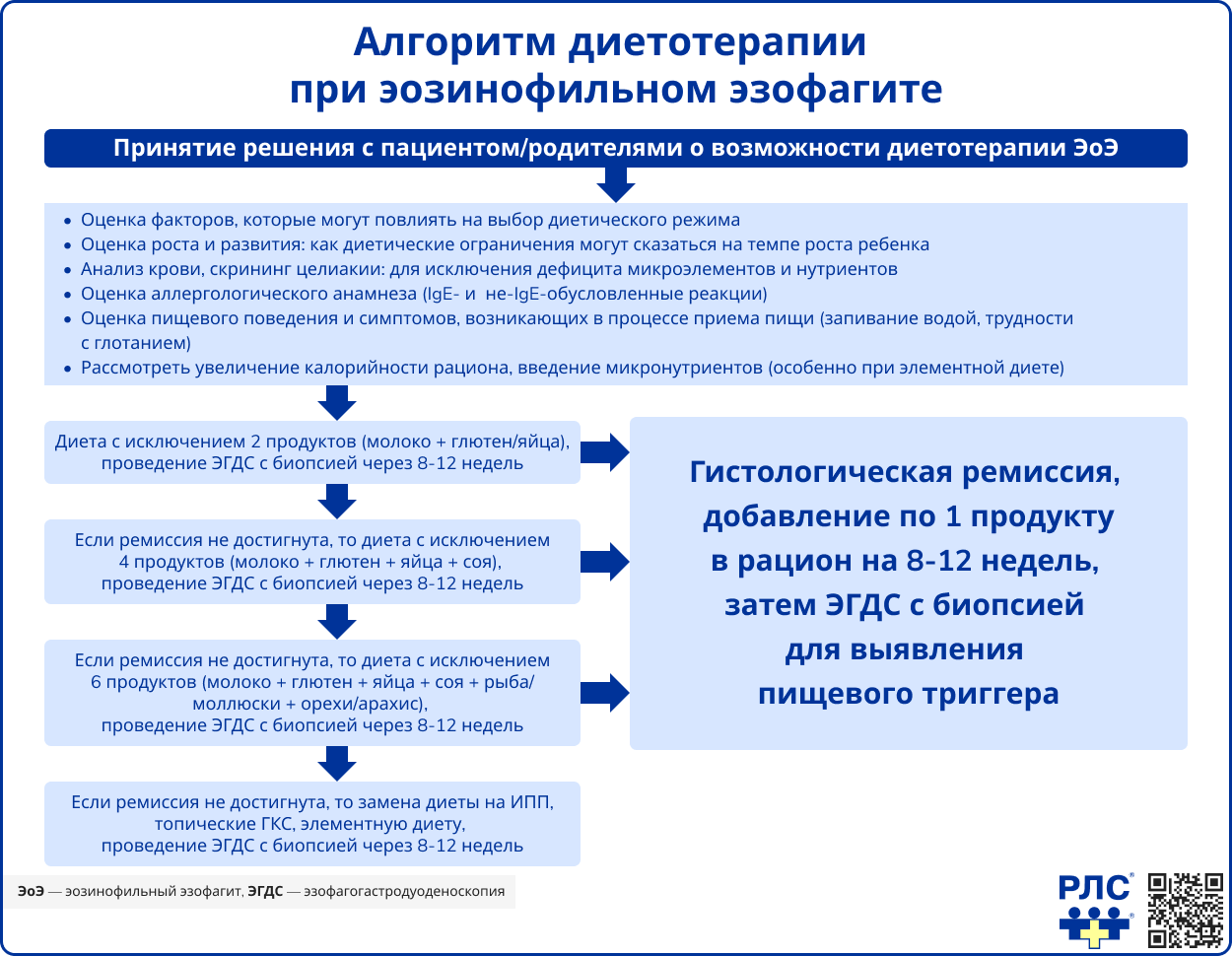
Ингибиторы протонной помпы (ИПП), топические глюкокортикостероиды (тГКС) и диетотерапия составляют основу лечения ЭоЭ. Выбор тактики зависит от предпочтений пациента и может корректироваться. Элиминационная диета рекомендована как метод достижения ремиссии без медикаментозного вмешательства. Доказано, что у пациентов, исключивших из рациона продукты-триггеры, гистологическая ремиссия сохраняется длительно. Применяются следующие подходы к элиминационной диете [1]:
- Полное энтеральное питание (элементная диета) на основе аминокислотной смеси;
- Исключение 6 наиболее частых пищевых аллергенов (молоко, пшеница, яйца, соя, рыба или моллюски, орехи или бобовые);
- Исключение 4 триггеров (молоко, пшеница, яйца, соя);
- Исключение 2 триггеров (молоко + пшеница или яйца).
Комбинация диетотерапии и медикаментозного лечения рассматривается при недостаточной эффективности монотерапии. Диеты, основанные на результатах аллергологических тестов, не рекомендуются из-за низкой эффективности. Коррекцию питания и его назначение должен проводить врач-диетолог, так как исключение продуктов может привести к дефициту витамина D, кальция и железа, потере массы тела или задержке роста у детей. При необходимости применяются специализированные лечебные смеси и витаминно-минеральные комплексы.
Если диетотерапия и медикаментозное лечение неэффективны, может быть рассмотрено назначение элементной диеты на основе аминокислотных смесей. Этот метод демонстрирует высокую эффективность (ремиссия у 90,8% пациентов), но сопровождается сложностями в соблюдении: у детей из-за неприятного вкуса смесей часто требуется назогастральный зонд, а среди взрослых более 30% отказываются от диеты в течение первых 4 недель. Полное исключение обычной пищи также приводит к значительному снижению качества жизни и социальной адаптации. Элементная диета может быть рекомендована детям младше года в качестве основного питания и пациентам более старшего возраста – как часть элиминационного рациона при значительной потере массы тела или ограничении принимаемой за раз порции [1, 2].
Медикаментозное лечение
Пациентам с ЭоЭ рекомендуется назначение ИПП (омепразол, эзомепразол, лансопразол и др.) в стандартной дозировке на 8-12 недель для индукции ремиссии. При достижении эффекта прием ИПП продолжают в минимально эффективной дозе для поддержания результата.
Если на фоне ИПП не достигнута ремиссия, назначают топические тГКС в виде флутиказона аэрозоля (по схеме «впрыск-глоток») или будесонида (в виде густого сиропа). Наибольшую эффективность показали таблетки будесонида, растворяющиеся во рту (в РФ не зарегистрированы). После применения тГКС рекомендуется воздержаться от еды и питья в течение 30-60 минут. В России доступны только флутиказон в ингаляционной форме и будесонид для небулайзерной терапии, из-за чего необходимо проведение врачебного консилиума перед назначением этих препаратов у пациентов с ЭоЭ.
Эффективность лечения (медикаментозного и диетотерапии) оценивается через 8-12 недель с помощью эзофагогастродуоденоскопии с биопсией. У детей старше года, не ответивших на стандартную терапию, возможно применение дупилумаба (моноклональные антитела к альфа-субъединице рецептора ИЛ-4 и ИЛ-13).
Пациентам с ЭоЭ, имеющим стриктуры и стойкую дисфагию, может потребоваться эндоскопическая баллонная дилатация или бужирование. Эти процедуры облегчают симптомы, но не заменяют противовоспалительную терапию и проводятся на фоне приема ИПП или тГКС [1].
Список литературы
- Клинические рекомендации Российского научного медицинского общества терапевтов, Российской ассоциации аллергологов и клинических иммунологов, Ассоциации детских аллергологов и иммунологов России, Российского общества профилактики неинфекционных заболеваний, Российского общества патологоанатомов "Эозинофильный эзофагит", М.: 2022
- Кайбышева, В. О. Эозинофильный эзофагит. Переработанное и дополненное издание / В. О. Кайбышева, Л. М. Михалева, Е. Д. Федоров. — Москва: Медиа Сфера, 2024. — 180 c.
- Kottyan L. C., Rothenberg M. E. Genetics of eosinophilic esophagitis //Mucosal immunology. – 2017. – Т. 10. – №. 3. – С. 580-588.
- O’Shea K. M. et al. Pathophysiology of eosinophilic esophagitis //Gastroenterology. – 2018. – Т. 154. – №. 2. – С. 333-345.
- Von Arnim U. et al. Helicobacter pylori infection is associated with a reduced risk of developing eosinophilic oesophagitis //Alimentary pharmacology & therapeutics. – 2016. – Т. 43. – №. 7. – С. 825-830.
- Dunn J. L. M. et al. Esophageal type 2 cytokine expression heterogeneity in eosinophilic esophagitis in a multisite cohort //Journal of Allergy and Clinical Immunology. – 2020. – Т. 145. – №. 6. – С. 1629-1640. e4.
- Barni S. et al. Pediatric eosinophilic esophagitis: a review for the clinician //Italian Journal of Pediatrics. – 2021. – Т. 47. – №. 1. – С. 1-14.
- Sherrill J. D. et al. Variants of thymic stromal lymphopoietin and its receptor associate with eosinophilic esophagitis //Journal of Allergy and Clinical Immunology. – 2010. – Т. 126. – №. 1. – С. 160-165. e3.
- Litosh V. A. et al. Calpain-14 and its association with eosinophilic esophagitis //Journal of Allergy and Clinical Immunology. – 2017. – Т. 139. – №. 6. – С. 1762-1771. e7.
- Clayton F., Peterson K. Eosinophilic esophagitis: pathophysiology and definition //Gastrointestinal Endoscopy Clinics. – 2018. – Т. 28. – №. 1. – С. 1-14.
- Blanchard C. et al. Periostin facilitates eosinophil tissue infiltration in allergic lung and esophageal responses //Mucosal immunology. – 2008. – Т. 1. – №. 4. – С. 289-296.
- Blanchard C. et al. Eotaxin-3 and a uniquely conserved gene-expression profile in eosinophilic esophagitis //The Journal of clinical investigation. – 2006. – Т. 116. – №. 2. – С. 536-547.
- Beppu L. Y. et al. TGF-β1–induced phospholamban expression alters esophageal smooth muscle cell contraction in patients with eosinophilic esophagitis //Journal of allergy and clinical immunology. – 2014. – Т. 134. – №. 5. – С. 1100-1107. e4.
- Zuo L. et al. IL-13 induces esophageal remodeling and gene expression by an eosinophil-independent, IL-13Rα2–inhibited pathway //The Journal of Immunology. – 2010. – Т. 185. – №. 1. – С. 660-669
- Wong C. K. et al. Thymic stromal lymphopoietin induces chemotactic and prosurvival effects in eosinophils: implications in allergic inflammation //American journal of respiratory cell and molecular biology. – 2010. – Т. 43. – №. 3. – С. 305-315.
Описание проверено экспертом
Статьи по теме Гастроэнтерология
- Вирусный гепатит Е
- Инфекция Helicobacter pylori
- Хронический вирусный гепатит С
- Аскаридоз
- Фасциолез
- Энтеробиоз
- Болезнь Крона
- Язвенный колит
- Метаболически ассоциированная жировая болезнь печени
- Целиакия
- Запор
- Синдром раздраженного кишечника
- Гастроэзофагеальная рефлюксная болезнь
- Редкий дебют системной красной волчанки – острый панкреатит: описание случая
- Связь между ингибиторами протонной помпы и заболеваниями почек
- Постхолецистэктомическая диарея
- Акотиамид и функциональная диспепсия: данные систематического обзора и мета-анализов
- Как H. pylori влияет на человека, и может ли человек повлиять на неё?
- Helicobacter pylori и колоректальный рак: данные научного исследования
- Эрозивный эзофагит: 5 тезисов, которые нужно знать врачу и пациенту
- Практические подходы к диагностике и лечению вздутия живота
Статьи по теме Иммунология
- Аллергический ринит
- Пищевая аллергия
- Гиперчувствительный пневмонит
- Наследственный ангиоотек
- Крапивница
- Бронхиальная астма
- Атопический дерматит
- Анафилаксия
- Мастоцитоз
- Узловатая почесуха
- Системная красная волчанка
Болезни в статье:
- B98.0 Helicobacter pylori [H. рylori] в качестве причины болезней, классифицированных в других рубриках
- K90.0 Целиакия
- M05 Серопозитивный ревматоидный артрит
- E06.3 Аутоиммунный тиреоидит
- G35 Рассеянный склероз
- D80-D89 Отдельные нарушения, вовлекающие иммунный механизм
- L20 Атопический дерматит
- L27.2 Дерматит, вызванный съеденной пищей
- J45 Астма
- K21 Гастроэзофагеальный рефлюкс
Фармгруппы в статье:
Оцените статью:
- Эзофагит эрозивный
- Инфекции пищеварительных путей
- Инфекционное заболевание ЖКТ
- Эрозивный эзофагит
- Острая эрозия пищевода
Эозинофильный эзофагит
Статья рассказывает о хроническом заболевании пищевода - эозинофильном эзофагите. Материал содержит информацию о симптомах, факторах риска, диагностике и лечении.
Опубликовано на сайте: 29.12.23 | Обновлено на сайте: 12.01.24
Эзофагит: о чем может сигнализировать изжога
Статья рассказывает о причинах, симптомах и факторах риска эзофагита.
Опубликовано на сайте: 19.08.24 | Обновлено на сайте: 19.08.24
Эрозивный эзофагит: 5 тезисов, которые нужно знать врачу и пациенту
Описание факторов риска, возможных осложнений, подходов к диагностике и лечению эрозивного эзофагита.
Опубликовано на сайте: 27.04.24 | Обновлено на сайте: 27.04.24
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
эзофагит
воспалительное заболевание желудочно-кишечного тракта
эзофагит, эзофагите, обострением эзофагита, воспалением слизистой оболочки желудочно-кишечного тракта, активными воспалительными заболеваниями желудочно-кишечного тракта, тяжелые воспалительные поражения желудочно-кишечного тракта, с воспалением слизистой оболочки желудочно-кишечного тракта, острые воспалительные заболевания органов желудочно-кишечного тракта, воспалительные заболевания желудочно-кишечного тракта, острые воспалительные заболевания желудочно-кишечного тракта, острая фаза воспалительных заболеваний кишечного тракта, острые воспалительные поражения дистальных отделов желудочно-кишечного тракта, воспалительные заболевания жкт,