Содержание
О Helicobacter pylori заговорили в 1979 году, когда Джон Уоррен, патологоанатом из Западной Австралии, обнаружил, что воспаленная слизистая желудка покрыта бактериями, похожими на Campylobacter [1]. В 1982 году Уоррен и его коллега Барри Маршалл выделили первые образцы этих бактерий, получивших новое название Helicobacter pylori, от 11 пациентов с гастритом [2]. H. pylori – это спиралевидная, микроаэрофильная патогенная бактерия, которая может выживать в желудке и колонизировать его в течение всей жизни человека, передаваясь контактно-бытовым путем [3]. Она может привести к развитию гастрита, язв пищеварительного тракта, лимфомы и рака желудка [4]. Почти 50% населения планеты инфицировано этим возбудителем, причем в развивающихся странах этот уровень выше [5, 6].
В настоящее время стандартом лечения инфекции H. pylori является тройная эрадикационная терапия: кларитромицин, амоксициллин и ингибитор протонной помпы (например, эзомепразол). Хотя тройная терапия, содержащая кларитромицин, изначально обеспечивает эффективную эрадикацию возбудителя на уровне >90% [7], из-за роста устойчивости к макролидам эффективность такой схемы лечения снизилась до неприемлемо низкого уровня (≤80%) в большинстве регионов мира [8].
Вакцинация эффективна для профилактики и лечения многих инфекционных заболеваний и проверена сотнями годами практики. В связи с этим в настоящее время активно рассматривается возможность использования аналогичного подхода и в терапии инфекции H. pylori. На сегодняшний день ни одна вакцина не внедрена в клиническую практику, однако разработки ведутся активно.
Патогенез инфекции H. pylori
.png
)
Источник: Cheok Y. Y. et al. An overview of Helicobacter pylori survival tactics in the hostile human stomach environment //Microorganisms. – 2021. – Т. 9. – №. 12. – С. 2502.
Внешние структуры H. pylori облегчают подвижность бактерий в толстом слизистом слое желудка
За счет спиральной формы, обусловленной особым структурным расположением пептидогликана и поперечными связями, микроорганизм может проходить сквозь слой вязкой слизи, как винт, вкрученный в пробку [9]. Кроме того, возбудитель имеет 4-6 униполярных жгутиков, которые также облегчают прохождение сквозь слой слизи и участвуют в формировании бактериальных биопленок, повышающих устойчивость патогена в макроорганизме [10].
Считается, что в желудке существует две популяции H. pylori. Первично колонизирующий слизистую штамм возбудителя образует «колонию-основатель», которая обнаруживается глубоко в железах желудка и служит резервуаром для второй, временной, популяции возбудителя, которая располагается на поверхности слизистой оболочки желудка и периодически отторгается вследствие перистальтики [11].
Белки наружной мембраны облегчают прикрепление бактерий к эпителиальным клеткам желудка
Белки наружной мембраны (БНМ) обеспечивают возбудителю барьер, повышающий устойчивость в агрессивной среде желудка, а также облегчают прикрепление бактерий к эпителиальным клеткам. Самым крупным представителем БНМ является семейство поринов наружной мембраны – белки Hop (Helicobacter outer membrane porin). К числу хорошо изученных белков Hop относятся:
- HopS и HopT, также называемые антигенсвязывающими белками крови (BabA и BabB – blood antigen-binding proteins), которые облегчают прикрепление бактерий к клеткам-хозяевам посредством связывания с Leb-гистоантигеном группы крови системы Lewis [12];
- HopP, также называемый адгезином, связывающим сиаловую кислоту (SabA – sialic acid-binding adhesin), связывается с CD15 на эпителиальных клетках желудка во время хронического воспаления, что приводит к усилению колонизации [13];
- HopC (AlpA) и HopB (AlpB) связываются с ламинином клеток макроорганизма [14];
- HopH, называемый внешним воспалительным белком A (OipA – outer inflammatory protein A), а также HopC, HopB и HopZ входят в число БНМ, необходимых для прикрепления и колонизации бактерий в желудке [15]. Сообщается, что HopH/OipA может подавлять созревание дендритных клеток (ДК) и секрецию IL-10, ослабляя активацию иммунной системы [16], а также индуцировать апоптоз эпителиоцитов желудка посредством модуляции Bax/Bcl-2 [17];
- HopQ, который снижает продукцию интерферона гамма (IFN-γ) путем взаимодействия с CD4+ Т-клетками, экспрессирующими молекулу 1 CEA Cell Adhesion Molecule (CEACAM1), а также ингибирует цитотоксичность CEACAM1-экспрессирующих CD8+ Т-клеток и естественных киллеров [18].
Уреаза H. pylori нейтрализует кислый pH
Один из главных факторов патогенности H. pylori – уреаза, которая гидролизует мочевину до катиона аммония (NH4+) и углекислого газа и обычно обнаруживается на поверхности бактерий или в цитоплазме. Транспортер мочевины (Ure I – субъединица уреазы I) регулирует формирование водородного канала, за счет которого мочевина проникает внутрь клетки в зависимости от уровня pH. Образующиеся в результате расщепления мочевины катионы аммония необходимы для буферизации периплазмы бактерии – они создают нейтральный слой, благоприятный для её выживания. Произведенный NH4+ не только выполняет функцию буфера, но и оказывает непосредственное токсическое действие на клетки макроорганизма [19, 20]. Примечателен тот факт, что способность продуцировать уреазу также ограничивает экологическую нишу H. pylori желудком. Это объясняется тем, что оптимальная протон-движущая сила, необходимая для стимуляции выработки основного источника энергии в клетке – аденозинтрифосфата, может поддерживаться только при pH от 3,5 до 8,4 [21]. Помимо способности уреазы непосредственно повреждать эпителий желудка, она также является хемоаттрактантом, способным рекрутировать иммунные клетки [22]. Кроме того, была продемонстрирована способность фермента индуцировать ангиогенез, тем самым внося определенный вклад в развитие рака желудка [23].
H. pylori ускользает от иммунного ответа хозяина
Способность H. pylori модулировать иммунный ответ хозяина приобретена в результате длительной совместной эволюции с человеком. К числу таких тактик выживания относятся:
- Синтез бактериальных компонентов низкой иммуногенности – например, липополисахарида и флагеллина [24, 25].
- Индукция синтеза противовоспалительного IL-10 и снижение продукции провоспалительных IL-12 и IL-6 макрофагами и ДК [26]. Также микроорганизм способен ослаблять пролиферацию макрофагов в условиях in vitro [27], ингибировать фагоцитоз и опосредованное активными формами кислорода уничтожение бактерий [28, 29], тем самым обеспечивая персистирование инфекции.
- Снижение провоспалительной активности Т-клеточного звена иммунитета: подавление активации Т-клеток (за счет уменьшения экспрессии HLA-II и продукции IFN-γ макрофагами [30]), перенаправление реакции Т-хелперов в сторону регуляторного фенотипа (за счет рекрутирования ДК, продуцирующих TGF-β и IL-10 [31]), анергия Т-лимфоцитов и нарушение бактериального клиренса [32, 33]. Кроме того, персистирующая инфекция H. pylori снижает активность специфических CD8+ цитотоксических Т-клеток и CD4+ хелперных Т-клеток, что приводит к подавлению местного иммунного ответа [34, 35].
В результате приведенных выше процессов снижается выраженность иммунного ответа, а следовательно, не возникает достаточно сильная воспалительная реакция для быстрой элиминации возбудителя [36, 37].
Также недавно было показано, что H. pylori и IL-22 индуцируют экспрессию металлопротеазы-10 в эпителиальных клетках желудка, что усиливает бактериальную колонизацию и выраженность связанных с ней патологических процессов – в том числе за счет снижения выработки антибактериального белка Reg3a, уменьшения количества белков плотных контактов (Е-кадгерина, ZO-1) и увеличения притока CD8+ Т-клеток [38].
Секреторная система IV типа проникает в эпителиальные клетки желудка
Секреторная система IV типа (T4SS) – это крупный транспортный комплекс, экспрессирующийся на поверхности грамотрицательных бактерий и архей и облегчающий транспортировку белков и ДНК в клетку хозяина контактно-зависимым образом [39]. Он имеет стержневую часть длиной 41 нм, состоящую из различных бактериальных белков, включая CagM, CagT, Cag3, CagX и CagY, которые выступают с бактериальной поверхности в клетку хозяина. CagX и CagY формируют предполагаемый канал T4SS [40]. CagL важен для прикрепления комплекса к α5β1 интегрину – молекуле адгезии на эпителиальной клетке [41]. Он также связывается с фибронектином, который участвует в распространении клеток, образовании локальных межклеточных спаек адгезии и активации клеточных тирозинкиназ, опосредующих патогеннное действие CagA [42]. Кроме того, посредством T4SS внутрь эпителиоцита транспортируется HopS/BabA, что приводит к увеличению продукции провоспалительных и канцерогенных факторов [43]. Также было установлено, что функционирующий T4SS индуцирует выработку IL-18 в эпителиальных клетках желудка через активацию NLRC4 инфламмасомы, вызывая персистенцию бактерий и усиление воспаления у мышиных моделей [44].
CagA нарушает нормальную клеточную деятельность
CagA представляет собой гидрофильный поверхностный белок, который может присутствовать (Cag+ штаммы) или отсутствовать (Cag- штаммы) у H. pylori. Учитывая высокую вариабельность среди разных Cag+ H. pylori, были описаны два разных варианта CagA, основанные на аффинности связывания с SHP2, а именно:
- восточноазиатский CagA с более сильным сродством к связыванию и более высокой патогенностью;
- западный CagA с более низким сродством к связыванию, что делает его менее вирулентным по сравнению с первым вариантом [45].
Взаимодействуя с рядом внутриклеточных компонентов эпителиоцитов, CagA активирует сигнальные пути, которые впоследствии вызывают аберрантные изменения полярности клеток, пролиферацию клеток, актин-цитоскелетные перестройки, удлинение клеток, нарушение плотных и адгезионных соединений, провоспалительные реакции и подавление апоптоза [46, 47]. Было установлено, что в процессе участия в канцерогенезе белок CagA ингибирует PAR1b-опосредованное фосфорилирование BRCA1, усиливает образование двойных разрывов ДНК и стимулирует сигнальный путь Hippo, что приводит к нестабильности генома в процессе развития предрасположенных к раковому перерождению клеток [48]. CagA-индуцированная активация YAP-сигнализации также способствует эпителиально-мезенхимальному переходу в эпителиоцитах желудка, тем самым ускоряя канцерогенез и распространение злокачественного процесса [49].
VacA индуцирует вакуолизацию клеток желудка
VacA – токсин, секретируемый H. pylori, индуцирующий образование крупных цитоплазматических вакуолей в эпителиоцитах желудка. Структурно термолабилен, чувствителен к протеазам, высокоактивен при pH от 1,5 до 6 и обладает высокой устойчивостью к расщеплению пепсином [50]. VacA имеет олигомерную структуру, которая диссоциирует при воздействии кислоты или щелочи, что приводит к активации токсина и усиливает его связывание белковой тирозиновой фосфатазой PTPRB на поверхности клетки-хозяина [51]. Внедряясь в эпителиоциты желудка через их апикальный полюс, токсин оказывает ряд эффектов:
- Снижает трансэпителиальную резистентность и повышает межклеточную проницаемость [52, 53], тем самым увеличивая выход необходимых для роста H. pylori питательных веществ из подлежащих слоев слизистой оболочки [54].
- Снижает функцию митохондрий, тем самым нарушая регуляцию клеточного метаболизма в эпителии желудка, что приводит к клеточной аутофагии, которая потенциально препятствует выработке иммунных эффекторов [55].
- VacA-индуцированная вакуолизация вызывает снижение протеолиза белков возбудителя в антигенпрезентирующих клетках, за счет чего нарушается формирование пептидных эпитопов и, следовательно, презентация пептидов Т-клеткам и их стимуляция [54].
- VacA ингибирует пролиферацию Т-клеток в фазе G1/S за счет отмены транслокации ядерного фактора активированных Т-клеток (NFAT), тем самым подавляя выработку фактора роста Т-клеток IL-2 [56].
- VacA также усиливает выработку TGF-β1, что впоследствии вызывает воспалительную реакцию при гастрите [57].
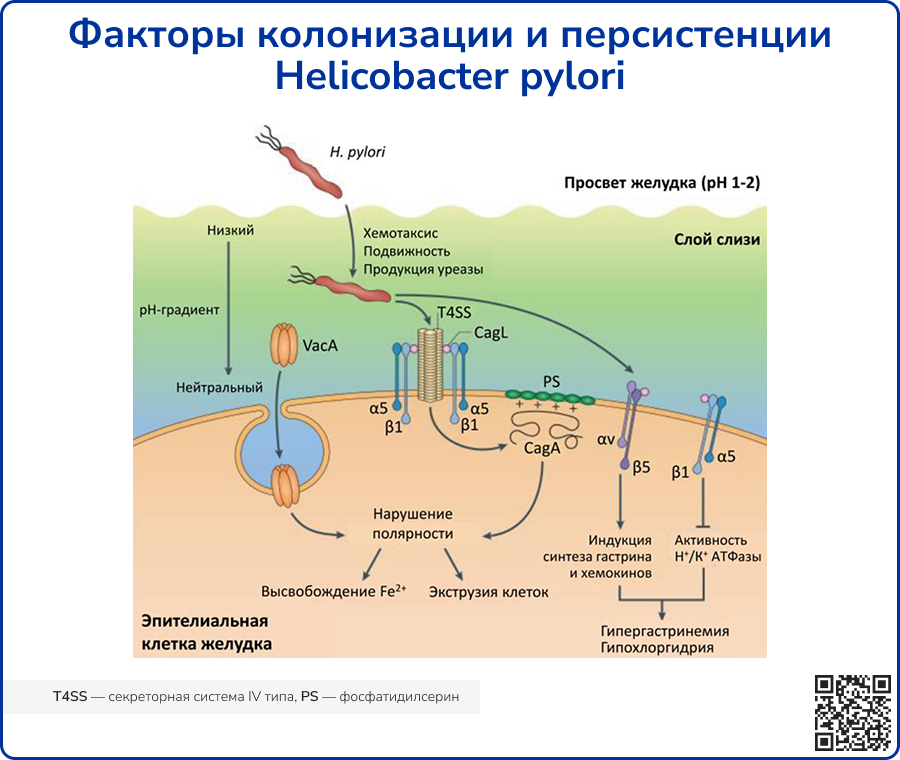
Источник: Salama N. R., Hartung M. L., Müller A. Life in the human stomach: persistence strategies of the bacterial pathogen Helicobacter pylori //Nature Reviews Microbiology. – 2013. – Т. 11. – №. 6. – С. 385-399.
H. pylori и рак желудка
Инфекция H. pylori вызывает типичную серию событий, известных как каскад Коррея [58], которые в конечном итоге приводят к раку желудка. Процесс начинается с воспалительной реакции слизистой оболочки желудка на фоне инфекции H. pylori, развивается острый гастрит с его последующей хронизацией. Обострения хронического гастрита приводят к атрофии слизистой оболочки желудка. Вследствие потери железистых клеток повышается pH желудка. Сочетание ассоциированных с H. pylori изменений желудочного эпителия, генетических факторов и влияния окружающей среды способствует развитию кишечной метаплазии, затем дисплазии и, наконец, рака желудка. В начале развития злокачественного процесса специфические симптомы отсутствуют, из-за чего заболевание диагностируется на поздних стадиях – как правило, когда опухоль уже прорастает мышечную оболочку органа. Это может быть одним из факторов, объясняющих крайне низкую 5-летнюю выживаемость при раке желудка – например, в США она составляет менее 15% [59].
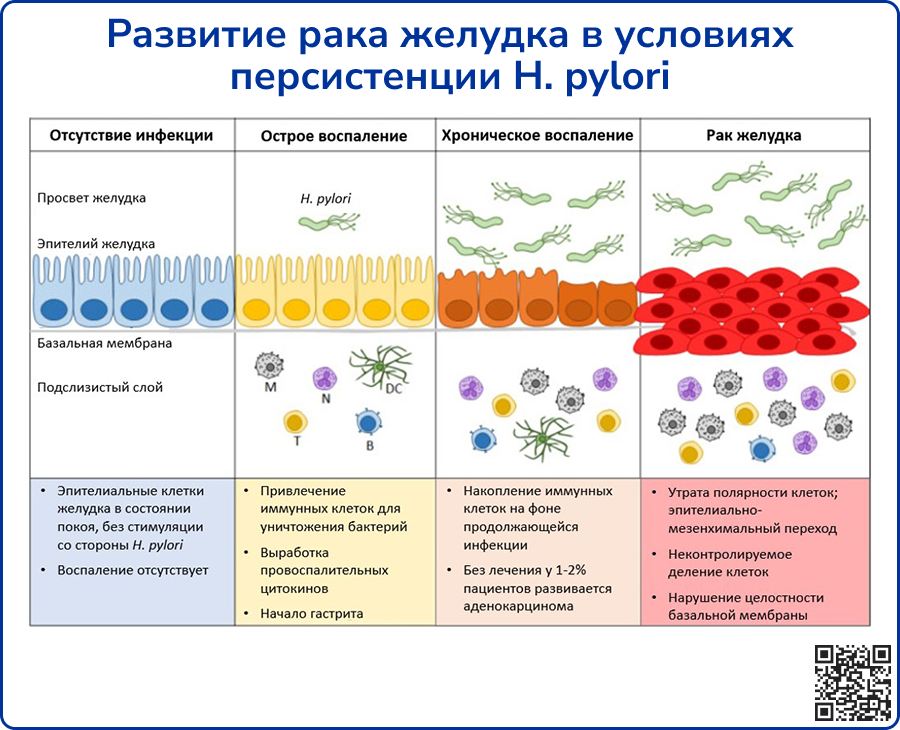
Источник: Cheok Y. Y. et al. An overview of Helicobacter pylori survival tactics in the hostile human stomach environment //Microorganisms. – 2021. – Т. 9. – №. 12. – С. 2502.
H. pylori и аутоиммунные заболевания
Антигенное сходство между H. pylori и организмом-хозяином, феномен молекулярной мимикрии, индукция выработки аутоантител, дисрегуляция механизмов иммунной толерантности, развитие фиброза тканей, сосудистых изменений, дисбаланс Т-регуляторных/ Th17 лимфоцитов, активация поликлональных лимфоцитов и повреждение клеток – наиболее важные факторы риска в патогенезе инфекции H. pylori, позволяющие заподозрить ее возможный вклад в развитие аутоиммунных процессов [60].
Системная красная волчанка
Были проведены многочисленные исследования взаимосвязи между изменением микробиоты кишечника и аутоиммунными заболеваниями, в том числе такими как системная красная волчанка (СКВ) [61, 62]. H. pylori также может играть роль в развитии СКВ за счет воздействия на кишечную микробиоту человека: во-первых, за счет возникновения гипохлоргидрии, гипергастринемии и действия фактора CagA [63], во-вторых, эрадикационная терапия существенным образом влияет на бактериальное разнообразие [64]. Однако, исследования, посвященные конкретно взаимосвязи между H. pylori, дисбиозом и СКВ, ещё не проведены.
В целом, немногочисленные сообщения о взаимосвязи между H. pylori и СКВ дают противоречивые результаты. Однако есть доказательства того, что H. pylori является динамическим фактором с двумя возможными ролями: провоцирующей и защитной – в зависимости от расы, возраста и пораженных органов. Необходимо выяснять и в дальнейшем учитывать роль H. pylori в комплексном подходе к пациентам с СКВ, главным образом потому, что клинические и иммунологические последствия еще не выяснены [65].
Воспалительные заболевания кишечника
Воспалительные заболевания кишечника (ВЗК) представляют собой сложную группу заболеваний, к числу которых относятся болезнь Крона, язвенный колит и неклассифицируемый ВЗК [66].
Имеющиеся к настоящему моменту эпидемиологические данные демонстрируют наличие отрицательной корреляции между H. pylori и ВЗК [67, 68]. В целом считается, что желудочно-кишечные патогены являются экологическими триггерами для дебюта и обострения уже имеющегося ВЗК. Однако некоторые бактериальные патогены, такие как H. pylori, и паразиты, например, trichinella spiralis, имеют свойство снижать риск развития этой группы заболеваний [69, 70].
В одном из исследований было выяснено, что протективное влияние возбудителя на прогрессирование ВЗК может быть связано со снижением функции кислотного барьера желудка, наблюдаемым при хеликобактерной инфекции [71]. Также было установлено, что в снижении риска развития патологии кишечника играют роль следующие факторы: снижение регуляции провоспалительного иммунного ответа микроорганизмами [72], экспрессия штамм-специфичных компонентов, в частности CagA. Рядом исследователей была доказана значимая связь между снижением заболеваемости ВЗК и инфицированием Cag+ штаммами H. pylori, но не Cag- [73].
Вопрос о том, приводит ли эрадикация H. pylori к развитию ВЗК, требует дальнейшего изучения.
Иммунная тромбоцитопеническая пурпура (ИТП) – это еще один вид аутоиммунного заболевания, характеризующегося наличием аутореактивных антител, образующихся в результате иммунной дисрегуляции Т- и В-клеток, что приводит к нарушению клиренса и образования тромбоцитов. В последние годы появляется все больше доказательств того, что инфекция H. pylori имеет отношение к патогенезу ИТП. ИТП, вызванная инфекцией H. pylori, подтверждается множеством выдвинутых механизмов, включая молекулярную мимикрию, обусловленную выработкой аутоантител против CagA и перекрестной реактивностью антител с поверхностными антигенами тромбоцитов, фагоцитарную пертурбацию вследствие усиления фагоцитарной активности моноцитов, агрегацию тромбоцитов из-за наличия анти-H. pylori IgG и фактора фон Виллебранда, и, в конечном итоге, иммунный ответ паразитирующего организма против CagA и VacA, приводящий к ИТП [74].
Исследования показали, что в группе с имеющейся хеликобактерной инфекцией после эрадикационной терапии наблюдается значимое улучшение количества тромбоцитов, в отличие от групп, не инфицированных H. pylori и инфицированных, но без антибактериального лечения [75]. Существует еще ряд статей [76-79], подтверждающих эту закономерность. Таким образом, эрадикация H. pylori позволяет значительно повысить уровень тромбоцитов у пациентов с ИТП, в том числе из-за подавления выработки антитромбоцитарных аутоантител, в связи с чем есть возможность снизить тяжесть заболевания у многих пациентов, вплоть до полного выздоровления [80, 81].
Поскольку H. pylori тесно связана с ИТП, каждый пациент с необъяснимой тромбоцитопенией должен пройти тест на H. pylori. Если результат окажется положительным, необходимо провести эрадикационную терапию H. pylori в каждом случае ИТП, иначе есть риск того, что обычные методы лечения ИТП не окажут эффективного воздействия на пациентов [82].
Другие заболевания
Также было проведено множество исследований с целью установить возможную ассоциацию хеликобактерной инфекции с такими заболеваниями как ревматоидный артрит, синдром Шёгрена [65], аутоиммунный тиреоидит, сахарный диабет I типа, аутоиммунные заболевания печени, хроническая крапивница, псориаз [83]. Полученные результаты противоречивы и не вносят ясности в понимание роли возбудителя в патогенезе данных заболеваний, поэтому необходимо дельнейшее изучение этих вопросов.
Хотя инфекционные агенты являются важными триггерами как в индукции, так и в поддержании аутоиммунных реакций, роль инфекции H. pylori в этом процессе остается неясной. По этой причине необходимы дальнейшие исследования для оценки этой ассоциации и ее клинического значения, с акцентом на то, когда эрадикация возбудителя должна быть рекомендована пациентам с аутоиммунными заболеваниями или высоким риском их развития.
Вакцина против H. pylori
Для успешной разработки вакцины необходимо знать иммунные механизмы естественного инфицирования и персистенции H. pylori и учитывать их при проведении клинических испытаний. Только вакцина, способная вызывать специфический иммунный ответ против возбудителя и изменять воспалительную реакцию слизистой, обеспечивая её эффективную регенерацию, может представлять собой инструмент для достижения профилактического иммунитета у не инфицированных Н. pylori субъектов [84].
.png)
Источник: Li S. et al. How long will it take to launch an effective Helicobacter pylori vaccine for humans? //Infection and Drug Resistance. – 2023. – С. 3787-3805.
.png)
.png)
Источник: Li S. et al. How long will it take to launch an effective Helicobacter pylori vaccine for humans? //Infection and Drug Resistance. – 2023. – С. 3787-3805.
Долгое время разработка эффективной вакцины против H. pylori сочетала иммунизацию мышей классическими антигенами возбудителя (Ure, CagA, HP-NAP и HSP) и инновационные способы их доставки (микросферы, векторы и химерные адъюванты), но во всех случаях процесс был излишне трудоемок и ресурсозатратен [84].
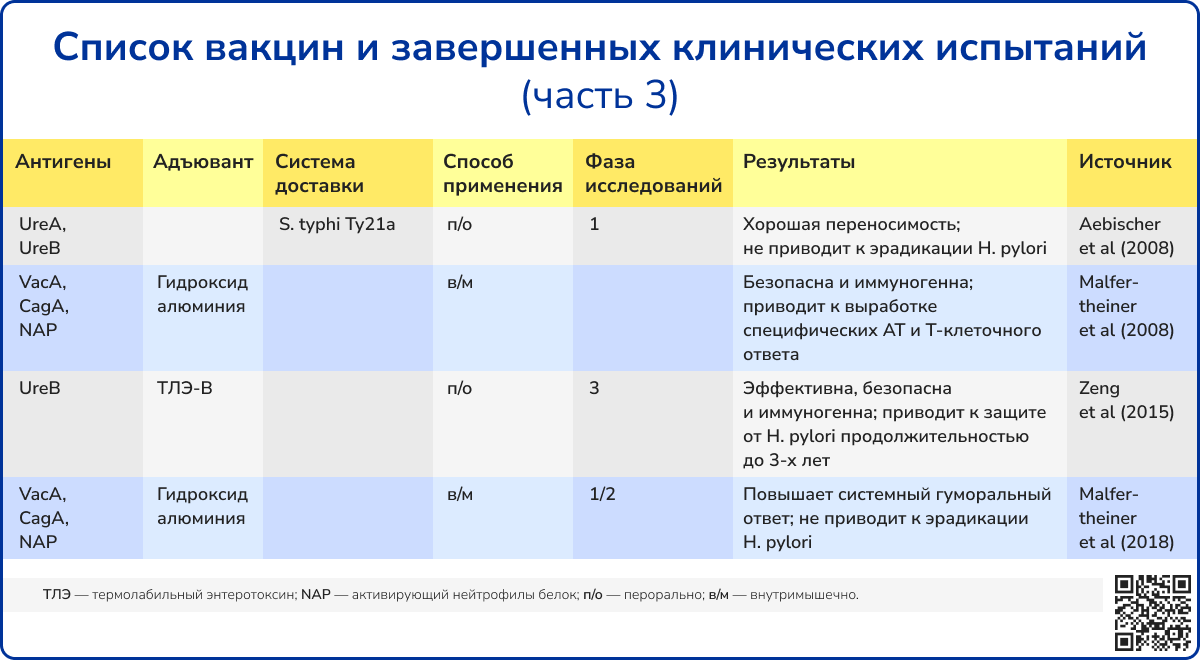
Среди вакцин-кандидатов, вышедших на стадию клинических испытаний, лишь немногие показали удовлетворительные результаты иммунизации. Был проведен ряд клинических испытаний по использованию S. enterica Typhi в качестве носителя вакцины. Удаленные по PhoP/phoQ вакцинные штаммы S. enterica Typhi Ty800, экспрессирующие UreA и UreB H. pylori, не смогли стимулировать достаточный гуморальный или мукозальный иммуный ответ на уреазу [85, 86].
Отдельно стоит отметить рекомбинантную пероральную вакцину, содержащую субъединицу UreB H. pylori в сочетании с термолабильным токсином E. coli, которая завершила III фазу клинических испытаний. Исследования демонстрировали значительное снижение частоты инфицирования у детей при применении вакцины и приемлемый профиль безопасность. Несмотря на то что через год после вакцинации частота естественного заражения H. pylori снижалась на 71,8% (95% ДИ: 48,2%-85,6%) [87], через 2 года уровень защиты уменьшался до 55%. К сожалению, дальнейшие испытания этой вакцины были прекращены.
Совсем недавно была разработана химерная субъединичная вакцина, содержащая Т-клеточные, В-клеточные и индуцирующие IFN-γ эпитопы. С помощью молекулярного докинга и иммунного моделирования было выявлено хорошее связывание с Toll-подобными рецепторами и индукция выраженного клеточно-опосредованного и гуморального иммунного ответа [88]. Клинические испытания мультиэпитопной вакцины только планируются, однако есть вероятность, что она покажет хорошие результаты и сможет быть внедрена в клиническую практику в обозримом будущем.
Список литературы
- Warren J. R., Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis //The lancet. – 1983. – Т. 321. – №. 8336. – С. 1273-1275.
- Marshall B. J. et al. Original isolation of Campylobacter pyloridis from human gastric mucosa //Microbios Letters. – 1984. – Т. 25. – №. 98. – С. 83-88.
- Brown L. M. Helicobacter pylori: epidemiology and routes of transmission //Epidemiologic reviews. – 2000. – Т. 22. – №. 2. – С. 283-297.
- Maleki Kakelar H. et al. Pathogenicity of Helicobacter pylori in cancer development and impacts of vaccination //Gastric Cancer. – 2019. – Т. 22. – С. 23-36.
- Hooi J. K. Y. et al. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis //Gastroenterology. – 2017. – Т. 153. – №. 2. – С. 420-429.
- Zamani M. et al. Systematic review with meta‐analysis: the worldwide prevalence of Helicobacter pylori infection //Alimentary pharmacology & therapeutics. – 2018. – Т. 47. – №. 7. – С. 868-876.
- Goderska K., Agudo Pena S., Alarcon T. Helicobacter pylori treatment: antibiotics or probiotics //Applied microbiology and biotechnology. – 2018. – Т. 102. – С. 1-7.
- Lee Y. C., Dore M. P., Graham D. Y. Diagnosis and treatment of Helicobacter pylori infection //Annual review of medicine. – 2022. – Т. 73. – С. 183-195.
- Sycuro L. K. et al. Peptidoglycan crosslinking relaxation promotes Helicobacter pylori's helical shape and stomach colonization //Cell. – 2010. – Т. 141. – №. 5. – С. 822-833.
- Hathroubi S., Zerebinski J., Ottemann K. M. Helicobacter pylori biofilm involves a multigene stress-biased response, including a structural role for flagella //MBio. – 2018. – Т. 9. – №. 5. – С. 10.1128/mbio. 01973-18..
- Fung C. et al. High-resolution mapping reveals that microniches in the gastric glands control Helicobacter pylori colonization of the stomach //PLoS biology. – 2019. – Т. 17. – №. 5. – С. e3000231.
- Oleastro M., Ménard A. The role of Helicobacter pylori outer membrane proteins in adherence and pathogenesis //Biology. – 2013. – Т. 2. – №. 3. – С. 1110-1134.
- Mahdavi J. et al. Helicobacter pylori SabA adhesin in persistent infection and chronic inflammation //Science. – 2002. – Т. 297. – №. 5581. – С. 573-578.
- Senkovich O. A. et al. Helicobacter pylori AlpA and AlpB bind host laminin and influence gastric inflammation in gerbils //Infection and immunity. – 2011. – Т. 79. – №. 8. – С. 3106-3116.
- De Jonge R. et al. Role of the Helicobacter pylori outer-membrane proteins AlpA and AlpB in colonization of the guinea pig stomach //Journal of medical microbiology. – 2004. – Т. 53. – №. 5. – С. 375-379.
- Teymournejad O. et al. In vitro suppression of dendritic cells by Helicobacter pylori OipA //Helicobacter. – 2014. – Т. 19. – №. 2. – С. 136-143.
- Teymournejad O. et al. Binding of the Helicobacter pylori OipA causes apoptosis of host cells via modulation of Bax/Bcl-2 levels //Scientific reports. – 2017. – Т. 7. – №. 1. – С. 8036.
- Gur C. et al. The Helicobacter pylori HopQ outermembrane protein inhibits immune cell activities //Oncoimmunology. – 2019. – Т. 8. – №. 4. – С. e1553487.
- Fagoonee S., Pellicano R. Helicobacter pylori: molecular basis for colonization and survival in gastric environment and resistance to antibiotics. A short review //Infectious Diseases. – 2019. – Т. 51. – №. 6. – С. 399-408.
- Mégraud F., Neman-Simha V., Brügmann D. Further evidence of the toxic effect of ammonia produced by Helicobacter pylori urease on human epithelial cells //Infection and immunity. – 1992. – Т. 60. – №. 5. – С. 1858-1863.
- Meyer-Rosberg K. et al. The effect of environmental pH on the proton motive force of Helicobacter pylori //Gastroenterology. – 1996. – Т. 111. – №. 4. – С. 886-900.
- Uberti A. F. et al. Pro-inflammatory properties and neutrophil activation by Helicobacter pylori urease //Toxicon. – 2013. – Т. 69. – С. 240-249.
- Olivera-Severo D. et al. A new role for Helicobacter pylori urease: contributions to angiogenesis //Frontiers in Microbiology. – 2017. – Т. 8. – С. 299313.
- Lee S. K. et al. Helicobacter pylori flagellins have very low intrinsic activity to stimulate human gastric epithelial cells via TLR5 //Microbes and infection. – 2003. – Т. 5. – №. 15. – С. 1345-1356.
- Luo Y. H., Yan J., Mao Y. F. Helicobacter pylori lipopolysaccharide: biological activities in vitro and in vivo, pathological correlation to human chronic gastritis and peptic ulcer //World Journal of Gastroenterology: WJG. – 2004. – Т. 10. – №. 14. – С. 2055.
- Gringhuis S. I. et al. Carbohydrate-specific signaling through the DC-SIGN signalosome tailors immunity to Mycobacterium tuberculosis, HIV-1 and Helicobacter pylori //Nature immunology. – 2009. – Т. 10. – №. 10. – С. 1081-1088.
- Tan G. M. Y. et al. Suppression of cell division-associated genes by Helicobacter pylori attenuates proliferation of RAW264. 7 monocytic macrophage cells //Scientific reports. – 2015. – Т. 5. – №. 1. – С. 11046.
- Ramarao N., Meyer T. F. Helicobacter pylori resists phagocytosis by macrophages: quantitative assessment by confocal microscopy and fluorescence-activated cell sorting //Infection and immunity. – 2001. – Т. 69. – №. 4. – С. 2604-2611.
- Lekmeechai S. et al. Helicobacter pylori outer membrane vesicles protect the pathogen from reactive oxygen species of the respiratory burst //Frontiers in microbiology. – 2018. – Т. 9. – С. 397542.
- Codolo G. et al. Helicobacter pylori dampens HLA-II expression on macrophages via the up-regulation of miRNAs targeting CIITA //Frontiers in immunology. – 2020. – Т. 10. – С. 478325.
- Kao J. Y. et al. Helicobacter pylori immune escape is mediated by dendritic cell–induced Treg skewing and Th17 suppression in mice //Gastroenterology. – 2010. – Т. 138. – №. 3. – С. 1046-1054.
- Lina T. T. et al. CagA-dependent downregulation of B7-H2 expression on gastric mucosa and inhibition of Th17 responses during Helicobacter pylori infection //The Journal of Immunology. – 2013. – Т. 191. – №. 7. – С. 3838-3846.
- Sarajlic M. et al. H. pylori modulates DC functions via T4SS/TNFα/p38-dependent SOCS3 expression //Cell Communication and Signaling. – 2020. – Т. 18. – С. 1-13.
- Shirai M. et al. Persistent Infection by Helicobacter pylori Down-Modulates Virus-Specific CD8/Cytotoxic T Cell Response and Prolongs Viral Infection //Journal of Infectious Diseases. – 1998. – Т. 177. – №. 1. – С. 72-80.
- D'Elios M. M. et al. T helper 1 effector cells specific for Helicobacter pylori in the gastric antrum of patients with peptic ulcer disease //Journal of immunology (Baltimore, Md.: 1950). – 1997. – Т. 158. – №. 2. – С. 962-967.
- Lina T. T. et al. Immune evasion strategies used by Helicobacter pylori //World journal of gastroenterology: WJG. – 2014. – Т. 20. – №. 36. – С. 12753.
- Andersen-Nissen E. et al. Evasion of Toll-like receptor 5 by flagellated bacteria //Proceedings of the national academy of sciences. – 2005. – Т. 102. – №. 26. – С. 9247-9252.
- Lv Y. et al. Helicobacter pylori–induced matrix metallopeptidase-10 promotes gastric bacterial colonization and gastritis //Science advances. – 2019. – Т. 5. – №. 4. – С. eaau6547.
- Gonzalez-Rivera C., Bhatty M., Christie P. J. Mechanism and function of type IV secretion during infection of the human host //Microbiology spectrum. – 2016. – Т. 4. – №. 3. – С. 10.1128/microbiolspec. vmbf-0024-2015.
- Frick-Cheng A. E. et al. Molecular and structural analysis of the Helicobacter pylori cag type IV secretion system core complex //MBio. – 2016. – Т. 7. – №. 1. – С. 10.1128/mbio. 02001-15.
- Kwok T. et al. Helicobacter exploits integrin for type IV secretion and kinase activation //Nature. – 2007. – Т. 449. – №. 7164. – С. 862-866.
- Tegtmeyer N. et al. A small fibronectin-mimicking protein from bacteria induces cell spreading and focal adhesion formation //Journal of biological chemistry. – 2010. – Т. 285. – №. 30. – С. 23515-23526.
- Ishijima N. et al. BabA-mediated adherence is a potentiator of the Helicobacter pylori type IV secretion system activity //Journal of Biological Chemistry. – 2011. – Т. 286. – №. 28. – С. 25256-25264.
- Semper R. P. et al. Helicobacter pylori exploits the NLRC4 inflammasome to dampen host defenses //The Journal of Immunology. – 2019. – Т. 203. – №. 8. – С. 2183-2193.
- Hatakeyama M. Oncogenic mechanisms of the Helicobacter pylori CagA protein //Nature Reviews Cancer. – 2004. – Т. 4. – №. 9. – С. 688-694.
- Takahashi-Kanemitsu A., Knight C. T., Hatakeyama M. Molecular anatomy and pathogenic actions of Helicobacter pylori CagA that underpin gastric carcinogenesis //Cellular & molecular immunology. – 2020. – Т. 17. – №. 1. – С. 50-63.
- Mimuro H. et al. Grb2 is a key mediator of Helicobacter pylori CagA protein activities //Molecular cell. – 2002. – Т. 10. – №. 4. – С. 745-755.
- Imai S. et al. Helicobacter pylori CagA elicits BRCAness to induce genome instability that may underlie bacterial gastric carcinogenesis //Cell Host & Microbe. – 2021. – Т. 29. – №. 6. – С. 941-958. e10.
- Li N. et al. Helicobacter pylori CagA promotes epithelial mesenchymal transition in gastric carcinogenesis via triggering oncogenic YAP pathway //Journal of Experimental & Clinical Cancer Research. – 2018. – Т. 37. – С. 1-15.
- de Bernard M. et al. Low pH Activates the Vacuolating Toxin of Helicobacter pylori, Which Becomes Acid and Pepsin Resistant (∗) //Journal of Biological Chemistry. – 1995. – Т. 270. – №. 41. – С. 23937-23940.
- Yahiro K. et al. Activation of Helicobacter pylori VacA toxin by alkaline or acid conditions increases its binding to a 250-kDa receptor protein-tyrosine phosphatase β //Journal of Biological Chemistry. – 1999. – Т. 274. – №. 51. – С. 36693-36699.
- Basso D. et al. Clinical relevance of Helicobacter pylori cagA and vacA gene polymorphisms //Gastroenterology. – 2008. – Т. 135. – №. 1. – С. 91-99.
- Ito Y. et al. Analysis and typing of the vacA gene from cagA-positive strains of Helicobacter pylori isolated in Japan //Journal of Clinical Microbiology. – 1997. – Т. 35. – №. 7. – С. 1710-1714.
- Montecucco C., Rappuoli R. Living dangerously: how Helicobacter pylori survives in the human stomach //Nature Reviews Molecular Cell Biology. – 2001. – Т. 2. – №. 6. – С. 457-466.
- Kim I. J. et al. Helicobacter pylori infection modulates host cell metabolism through VacA-dependent inhibition of mTORC1 //Cell host & microbe. – 2018. – Т. 23. – №. 5. – С. 583-593. e8.
- Gebert B. et al. Helicobacter pylori vacuolating cytotoxin inhibits T lymphocyte activation //Science. – 2003. – Т. 301. – №. 5636. – С. 1099-1102.
- Rahimian G. et al. Virulence factors of Helicobacter pylori vacA increase markedly gastric mucosal TGF-β1 mRNA expression in gastritis patients //Microbial pathogenesis. – 2014. – Т. 67. – С. 1-7.
- Correa P. et al. A model for gastric cancer epidemiology //The Lancet. – 1975. – Т. 306. – №. 7924. – С. 58-60.
- Correa P. Is gastric cancer preventable? //Gut. – 2004. – Т. 53. – №. 9. – С. 1217-1219.
- Youssefi M. et al. Helicobacter pylori infection and autoimmune diseases; Is there an association with systemic lupus erythematosus, rheumatoid arthritis, autoimmune atrophy gastritis and autoimmune pancreatitis? A systematic review and meta-analysis study //Journal of Microbiology, Immunology and Infection. – 2021. – Т. 54. – №. 3. – С. 359-369.
- Vieira S. M., Pagovich O. E., Kriegel M. A. Diet, microbiota and autoimmune diseases //Lupus. – 2014. – Т. 23. – №. 6. – С. 518-526.
- Luo X. M. et al. Gut microbiota in human systemic lupus erythematosus and a mouse model of lupus //Applied and environmental microbiology. – 2018. – Т. 84. – №. 4. – С. e02288-17.
- Tao Z. H., Han J. X., Fang J. Y. Helicobacter pylori infection and eradication: Exploring their impacts on the gastrointestinal microbiota //Helicobacter. – 2020. – Т. 25. – №. 6. – С. e12754.
- Alarcón T., Llorca L., Perez-Perez G. Impact of the microbiota and gastric disease development by Helicobacter pylori //Molecular Pathogenesis and Signal Transduction by Helicobacter pylori. – 2017. – С. 253-275.
- Etchegaray-Morales I. et al. Helicobacter pylori and its association with autoimmune diseases: systemic lupus erythematosus, rheumatoid arthritis and Sjögren syndrome //Journal of Translational Autoimmunity. – 2021. – Т. 4. – С. 100135.
- Uhlig H. H., Powrie F. Translating immunology into therapeutic concepts for inflammatory bowel disease //Annual review of immunology. – 2018. – Т. 36. – С. 755-781.
- Castaño-Rodríguez N. et al. Dual role of Helicobacter and Campylobacter species in IBD: a systematic review and meta-analysis //Gut. – 2017. – Т. 66. – №. 2. – С. 235-249.
- Lord A. R. et al. Protective effects of Helicobacter pylori for IBD are related to the cagA-positive strain //Gut. – 2018. – Т. 67. – №. 2. – С. 393-394.
- Axelrad J. E. et al. Systematic review: gastrointestinal infection and incident inflammatory bowel disease //Alimentary pharmacology & therapeutics. – 2020. – Т. 51. – №. 12. – С. 1222-1232.
- Axelrad J. E. et al. The role of gastrointestinal pathogens in inflammatory bowel disease: a systematic review //Therapeutic advances in gastroenterology. – 2021. – Т. 14. – С. 17562848211004493.
- Sonnenberg A., Turner K. O., Genta R. M. Upper gastrointestinal disease influences the occurrence of inflammatory bowel disease //Digestive Diseases and Sciences. – 2020. – Т. 65. – С. 2373-2378.
- Papamichael K., Konstantopoulos P., Mantzaris G. J. Helicobacter pylori infection and inflammatory bowel disease: is there a link? //World journal of gastroenterology: WJG. – 2014. – Т. 20. – №. 21. – С. 6374.
- Tepler A. et al. Systematic review with meta‐analysis: association between Helicobacter pylori CagA seropositivity and odds of inflammatory bowel disease //Alimentary pharmacology & therapeutics. – 2019. – Т. 50. – №. 2. – С. 121-131.
- Ihtesham A. et al. Helicobacter pylori induced Immune Thrombocytopenic Purpura and perspective role of Helicobacter pylori eradication therapy for treating Immune Thrombocytopenic Purpura //AIMS microbiology. – 2021. – Т. 7. – №. 3. – С. 284.
- Hwang J. J. et al. The effects of Helicobacter pylori eradication therapy for chronic idiopathic thrombocytopenic purpura //Gut and Liver. – 2016. – Т. 10. – №. 3. – С. 356.
- Lee A. et al. Helicobacter pylori eradication affects platelet count recovery in immune thrombocytopenia //Scientific reports. – 2020. – Т. 10. – №. 1. – С. 9370.
- Brito H. S. H. et al. Helicobacter pylori infection & immune thrombocytopenic purpura in children and adolescents: A randomized controlled trial //Platelets. – 2015. – Т. 26. – №. 4. – С. 336-341.
- Ikuse T. et al. Efficacy of Helicobacter pylori eradication therapy on platelet recovery in pediatric immune thrombocytopenic purpura-Case series and a systematic review //Microorganisms. – 2020. – Т. 8. – №. 10. – С. 1457.
- Ono Y. et al. Effectiveness of Helicobacter pylori eradication in pregnant women with idiopathic thrombocytopenic purpura //Journal of Obstetrics and Gynaecology Research. – 2017. – Т. 43. – №. 7. – С. 1212-1216.
- Sheema K. et al. Role of Helicobacter pylori eradication therapy on platelet recovery in chronic immune thrombocytopenic purpura //Gastroenterology Research and Practice. – 2017. – Т. 2017.
- Aljarad S. et al. The impact of helicobacter pylori eradication on platelet counts of adult patients with idiopathic thrombocytopenic purpura //BMC hematology. – 2018. – Т. 18. – С. 1-8.
- Zain M. A. et al. Helicobacter pylori: An underrated cause of Immune Thrombocytopenic Purpura. a comprehensive review //Cureus. – 2019. – Т. 11. – №. 9.
- Wang L., Cao Z. M., Lv W. Helicobacter pylori and autoimmune diseases: involving multiple systems //Frontiers in Immunology. – 2022. – Т. 13. – С. 833424.
- Stubljar D., Jukic T., Ihan A. How far are we from vaccination against Helicobacter pylori infection? //Expert review of vaccines. – 2018. – Т. 17. – №. 10. – С. 935-945.
- DiPetrillo M. D. et al. Safety and immunogenicity of phoP/phoQ-deleted Salmonella typhi expressing Helicobacter pylori urease in adult volunteers //Vaccine. – 1999. – Т. 18. – №. 5-6. – С. 449-459.
- Angelakopoulos H., Hohmann E. L. Pilot study of phoP/phoQ-deleted Salmonella enterica serovar typhimurium expressing Helicobacter pylori urease in adult volunteers //Infection and immunity. – 2000. – Т. 68. – №. 4. – С. 2135-2141.
- Zeng M. et al. Efficacy, safety, and immunogenicity of an oral recombinant Helicobacter pylori vaccine in children in China: a randomised, double-blind, placebo-controlled, phase 3 trial //The Lancet. – 2015. – Т. 386. – №. 10002. – С. 1457-1464.
- Keshri A. K. et al. Designing and development of multi-epitope chimeric vaccine against Helicobacter pylori by exploring its entire immunogenic epitopes: an immunoinformatic approach //BMC bioinformatics. – 2023. – Т. 24. – №. 1. – С. 358.
Болезни в статье:



