Современная фармакотерапия деформирующего остеоартроза
Д.м.н. Н.В.Чичасова, профессор кафедры ревматологии с курсом детской ревматологии ФППОВ ММА им. И.М. Сеченова
Деформирующий остеоартроз (ОА) относится к числу широкораспространенных заболеваний. Около 80% пациентов с заболеваниями суставов составляют именно больные ОА. Многие годы считалось, что ОА является следствием возрастного «изнашивания» хряща. Однако патогенез ОА намного сложнее (рис.1).
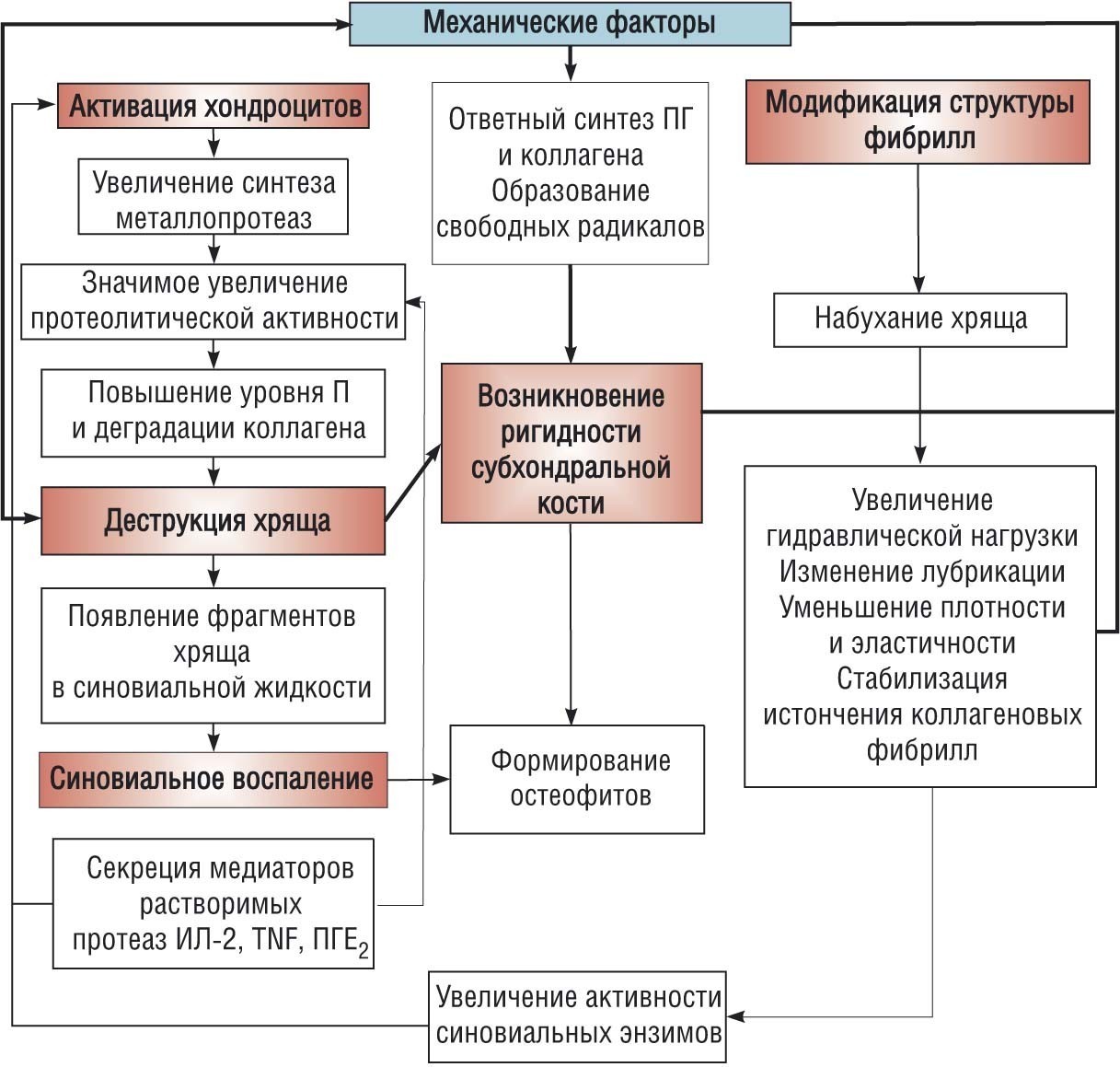
Рисунок 1. Этиопатогенетические предикторы остеоартроза
Как видно из рисунка, существует очень большое количество факторов, влияющих на развитие и прогрессирование основных звеньев патогенеза ОА: деструкция хряща, синовиальное воспаление, ригидность субхондральной кости. Следует отметить, что в большинстве случаев корреляция между рентгенологической картиной и клиническими проявлениями ОА, ведущим среди которых является боль, отсутствует: рентгенологические проявления ОА отмечены примерно у 30% взрослого населения, а болевой синдром развивается у 10–12%. В настоящий момент считается, что при ОА страдают все суставные структуры, а также периартикулярные ткани.
Основными направлениями лечения ОА являются:
1. Подавление воспалительных факторов (провоспалительные цитокины; ПГЕ2; увеличение активности синовиальных энзимов), т.к. синовит является практически облигатным проявлением ОА.
2. Подавление деструктивных факторов и процессов: снижение синтеза металлопротеаз и гликозаминогликанов (ГАГ); торможение деградации коллагеновых волокон и торможение протеолитической активности.
3. Уменьшение ригидности субхондральной кости.
4. Улучшение лубрикации сустава: при ОА уменьшается вязкость синовиальной жидкости, играющей не только роль «смазки», но и осуществляющей питание хряща, т.к. хрящ — бессосудистая ткань.
Фармакологические средства, применяющиеся при лечении ОА, подразделяются на быстро действующие (нестероидные и стероидные противовоспалительные препараты, анальгетики) и медленно действующие препараты. Последние нередко называют «хондропротекторами», хотя их действие при ОА не ограничивается влиянием только на метаболизм хряща. Основные направления лечения ОА представлены на рис. 2
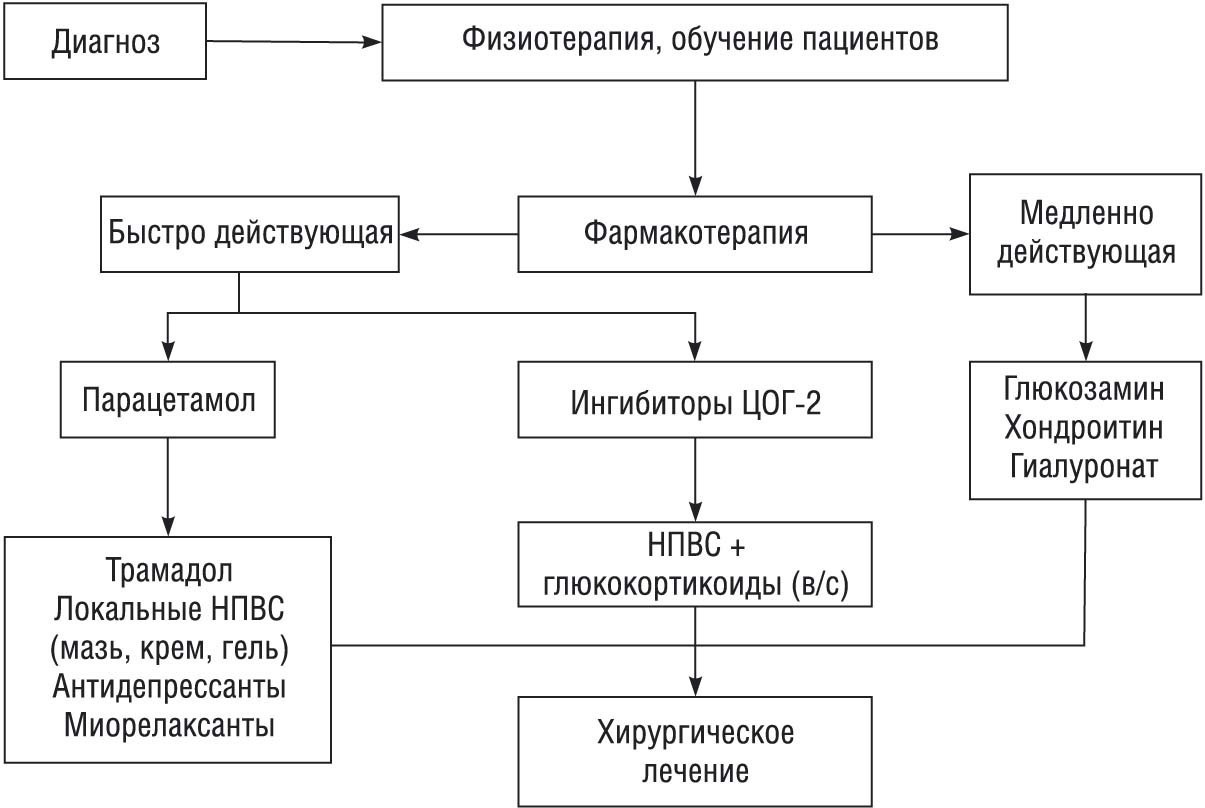
Рисунок 2. Лечение остеоартроза
Трудности лечения ОА определяются:
1) пожилым возрастом большинства пациентов,
2) необходимостью длительного многолетнего лечения,
3) сложностью оценки эффекта терапии,
4) отсутствием корреляции между выраженностью рентгенологических изменений в суставе и болевым синдромом,
5) опасностью длительной симптоматической обезболивающей и противовоспалительной терапии, которая проводится нестероидными противовоспалительными средствами (НПВС),
6) наличием сопутствующих заболеваний и комбинированной терапией, требующих от врача оценки совместимости различных фармакологических средств.
Самым ярким клиническим проявлением ОА является боль, приводящая к ухудшению качества жизни больных. Хотя синовит является частой причиной боли при ОА, причиной болевого синдрома могут стать и такие факторы, как трабекулярные микропереломы, внутримедуллярная гипертензия, давление на обнаженную субхондральную кость, спазм околосуставных мышц, дегенеративные изменения интраартикулярных связок, наличие остеофитов, поражение сосудов и нервов. Обезболивающая терапия выбирается в зависимости от характера боли (таблица 1)
Таблица 1
Характер боли при ОА и выбор обезболивающей терапии
| Причина боли | Клинические проявления | Фармакотерапия |
| Синовит | Утренняя скованность до 30 минут (при коксартрозе — до 60 минут), припухлость в области сустава, боль при движении | НПВС системно или локально терапии (мази, кремы, гели), жидкость Кармолис |
| Наличие остеофитов, давление на обнаженную субхондральную кость | «Механический» характер боли, боль на старте | Парацетамол (до 2 г/сутки), трамадол (50–100 мг/сутки), ортопедические мероприятия |
| Сосудистые боли | Ночные боли, прерывающие сон | Сосудистая терапия: пентоксифиллин, троксерутин, гепарин натрия (местно, гели) |
| Невральные боли | Боль «проводного» характера, онемение конечностей, преимущественно ночные боли | Физиотерапия, локальная анестезия в зависимости от локализации боли |
| Спазм околосуставных мышц | Связь боли с определенным движением, пальпаторно оцениваемый мышечный спазм | Тизанидин, толперизон. |
Поскольку синовит является почти облигатным при ОА наиболее часто первыми препаратами, которые врач назначает больному ОА, являются именно НПВС. Неселективные в отношении циклооксигеназы (ЦОГ) НПВС могут усугублять тяжесть ОА при длительном применении, поэтому при ОА они рекомедуются в низких дозах (до 100 мг/сутки диклофенака, 1200 мг/сутки ибупрофена) и короткими курсами.
Известно, что селективные ингибиторы ЦОГ−2 (нимесулид, мелоксикам, целекоксиб) лучше переносятся пожилыми пациентами с ОА, вследствие уменьшения частоты побочных явлений со стороны ЖКТ, почек, печени. Кроме того, эти препараты в меньшей степени снижают на синтез ГАГ и способны положительно влиять на ремоделирование костной ткани, т.к. активация остеокластов происходит при активном участии именно ЦОГ−2. В случаях, когда болевой синдром в основном обусловлен давлением на обнаженную кость или наличием остеофитов обезболивание лучше проводить парацетамолом или трамадолом. Преобладание болей в ночное время предполагает невральную, или, что бывает чаще, сосудистую этиологию и обусловливает необходимость назначения соответствующей терапии. Хороший симптоматический эффект приносит местная противовоспалительная/анальгетическая терапия: гели, мази, кремы, содержащие НПВС, жидкость Кармолис (длительность локальной терапии, как правило, не должна превышать 2–3 недель при 4-х кратном нанесении оптимального количества препарата на больной сустав). Хороший эффект при систематическом применении в течение 2–3 месяцев дает мазь, содержащая диметилсульфоксид в сочетании с хондроитина сульфатом (см. далее), что позволяет сочетать обезболивающее и противовоспалительное действие с хондропротективным. При наличии стойкого синовита, при формировании подколенной кисты (киста Беккера) эффективно введение в полость сустава глюкокортикоидов (ГК) (бетаметазон). Следует учитывать, что слишком частое введение (чаще, чем раз в 6 месяцев) ГК не только отрицательно влияет на обмен хряща, но и может вызвать такие осложнения, как развитие асептического некроза головки кости, усугубление течения сахарного диабета, артериальную гипертензию и т.д.
Медленно действующие препараты, применяющиеся при лечении ОА, являются компонентами матрикса хряща, полученными из хрящей животных или синтетическим путем. Одним из самых важных компонентов матрикса хряща являются протеогликаны (макромолекулы, в которых стержневой белок связан с одной или несколькими цепями гликозаминогликанов). ГАГ разделяют на 2 группы: несульфатированные (гиалуроновая кислота, хондроитин) и сульфатированные (хондроитина сульфат и кератана сульфат). Совместно с коллагеновыми волокнами ГАГ обеспечивают устойчивость хряща к внешним воздействиям. Эффект этой группы препаратов развивается обычно спустя 2–8 недель от начала лечения и сохраняется в течение 2–3 месяцев после прекращения приема медленнодействующих средств. В таблице 2 представлены основные медленно действующие препараты, применяемые при лечении ОА.
Таблица 2
Медленнодействующие препараты для лечения ОА
| Состав препарата и форма выпуска | Доза и длительность назначения |
| Средства для перорального приема | |
| Хондроитина сульфат, табл. | По 0,5 г 2 раза в день в течение 6 месяцев |
| Глюкозамина сульфат, табл. | 1400 мг 1 раз в день в течение 6 недель |
| Хондроитина сульфат (500 мг) + глюкозамина хлорид (500 мг), табл. | 1-й месяц — по 2 табл. 2 раза в день, 2–6 месяц — по 1 табл. 1 раз в день |
| Хондроитина сульфат ( 400 мг)+ глюкозамина хлорид (500 мг), капс. | 2 капсулы в сутки в 1-е 3–4 недели, далее — по 1 капсуле в сутки 4–6 мес. |
| Хондроитина сульфат (200 мг)+ глюкозамина сульфат (250 мг), табл. | По 2 табл. 2 раза в день в течение 4–6 месяцев |
| Экстракт авокадо и сои | По 1 капс. в день, в течение 6 мес. |
| Средства для в/м введения | |
| Глюкозамина сульфат | По 400 мг 2 раза в неделю в течение 6 недель |
| Концентрат морских организмов (активное вещество) | По 1 мл в день в течение 20 дней |
| Препараты для в/суставного введения | |
| Концентрат морских организмов (активное вещество) | По 2 мл 2 раза в неделю. Всего — 6 инъекций |
| Гиалуронат натрия | По 1 мл трехкратно с интервалом в неделю |
Наиболее изученными в лечении ОА являются хондроитина сульфат и глюкозамина сульфат — естественные компоненты хряща. Хондроитина сульфат — высокомолекулярный полисахарид из группы протеогликанов — является неотъемлемой частью аггрекановой молекулы хряща. Глюкозамин — продукт гидролиза и деацетилирования хитина ракообразных животных — служит субстратом для синтеза протеогликанов. Обладая комплексным механизмом действия и тропностью к хрящу, хондроитина сульфат и глюкозамина сульфат встраиваются в структуры хрящевой ткани, стимулируя ее синтез и угнетая деструкцию.
Мета-анализ многочисленных исследований подтвердил, что глюкозамина сульфат и хондроитина сульфат эффективны в лечении ОА. И хондроитина сульфат и глюкозамина сульфат обладают собственным обезболивающим и противовоспалительным действием за счет угнетения активности лизосомальных ферментов и ингибиции супероксидных радикалов. Положительное влияние этих субстанций на хрящ обуславливается подавлением катаболических и стимуляцией анаболических процессов в хряще. Препараты достоверно уменьшают болевой синдром, обладают противовоспалительными свойствами, улучшают функциональное состояние больных (по индексам Lekken и Womac), уменьшая тем самым потребность больного в анальгетических и противовоспалительных средствах. Было показано, что при применении хондроитина сульфата в течение 12 месяцев у больных с гонартрозом отсутствует отрицательная рентгенологическая динамика, в то время как в группе больных, получавших плацебо, отмечено прогрессивное сужение суставной щели. Трехлетнее плацебо-контролируемое исследование эффективности хондроитина сульфата и хондроитина полисульфата у больных с узелковым артрозом дистальных и проксимальных суставов пальцев рук продемонстрировало достоверно меньшее прогрессирование анатомических рентгенологических параметров, таких как образование остеофитов, уменьшение суставной щели, изменения в архитектонике субхондральной кости, при применении хондроитина сульфата и хондроитина полисульфата по сравнению с плацебо: у 8% больных леченных препаратом имело место рентгенологическое прогрессирование узелкового ОА, а в группе больных, получавших плацебо прогрессирование отмечено у 30% пациентов. Хондропротективные возможности глюкозамина сульфата были продемонстрированы в 2 рандомизированных контролируемых исследованиях среди 212 и 202 пациентов с гонартрозом. Было показано, что уменьшение суставной щели более чем на 0,5 мм в течение 3-летнего периода (считается серьезным рентгенологическим ухудшением) отмечено у 4,7% больных, получавших глюкозамина сульфат, и у 22,2% больных, получавших плацебо. Результаты лечения хондроитина сульфатом (1,5 г/сутки в течение первых 3 недель, далее по 1 г/сутки в течение 6 месяцев) больных ОА свидетельствовали об улучшении у 90% больных с гонартрозом и у 92% с коксартрозом, что выражалось в достоверном уменьшении боли в пораженном суставе, снижении дозы НПВС через 3 месяца лечения в 2,8 раза, а через 6 месяцев в 5,7 раза. Через 6 месяцев приема хондроитина сульфата 55% больных смогли отказаться от приема НПВС. Назначение глюкозамина сульфата больным с гонартрозом и коксартрозом в дозе 1500 мг/сутки приводило не только к достоверному уменьшению болевого синдрома, но и явному противовоспалительному действию (уменьшение выраженности синовита и утренней скованности) за 6-недельный период лечения. Эффект отсутствовал только у 8% больных, улучшение и значительное улучшение отмечено у 87% больных и исчезновение симптомов поражения сустава у 5% больных.
Доказанная эффективность монотерапии глюкозамина сульфатом и хондроитина сульфатом создала предпосылки для их включения в комбинированную терапию. Механизмы подавления катаболических процессов и активации анаболических процессов в хряще для этих двух субстанций несколько отличаются (таблица 3).
Таблица 3
Фармакодинамические свойства глюкозамина сульфата и хондроитина сульфата
| Фармакологический эффект | Механизм действия | |
| Глюкозамина сульфат | Хондроитина сульфат | |
| Анаболический | Является субстратом для синтеза ГАГ, стимулирует синтез протеогликанов | Увеличивает содержание РНК в хондроцитах, препятствует ИЛ−1 зависимой ингибиции синтеза гиалуроновой кислоты, стимулирует синтез протеогликанов |
| Антикатаболический | Ингибирует действие катаболических ферментов (стромелизин, аггреканаза, коллагеназа, фосфолипаза А2), активирует адгезию хондроцитов к фибронектину. | Ингибирует активность лейкоцитарной эластазы, синтез коллагеназы и активность аггреканазы |
| Противовоспалительный | Препятствует образованию супероксидных радикалов, ингибирует активность лизосомалльных ферментов, снижает уровень ИЛ-1 в синовиальной жидкости, ингибирует синтез оксида азота | Подавляет стимулированный ИЛ-1 синтез ПГ |
В состав комбинированных препаратов, зарегистрированных в России, входят 2 соли глюкозамина — глюкозамина хлорид или глюкозамина сульфат (получают из глюкозамина хлорида путем добавления в него сульфата калия или натрия). Биодоступность глюкозамина хлорида составляет около 84%, а глюкозамина сульфата — около 40%, поэтому суточная доза последнего должна быть приблизительно в 2–3 раза выше, чем глюкозамина хлорида.
Препараты, содержащие комбинацию хондроитина сульфата натрия с глюкозамина гидрохлоридом в разных дозах, продемонстрировали свою эффективность при лечении ОА. При приеме этих препаратов развитие эффекта зарегистрировано через 1–2 месяца от начала приема. Начиная с 3–4-го месяцев приема, несмотря на постепенное снижение больными суточной дозы НПВС или даже отказ от обезболивающей терапии, уменьшение боли и улучшение функции больных достоверно отличались от этих параметров на фоне лечения диклофенаком, а далее эффект нарастал при продолжении лечения до 4–6 месяцев и сохранялся в течение 2–3 месяцев после отмены препаратов. В этом отечественном исследовании к концу курса лечения комбинированными препаратами 40% больных отменили прием НПВС и остальные 60% значительно уменьшили суточную дозу НПВС. При этом была отмечена 100% переносимость комбинации хондроитина сульфата натрия с глюкозамина гидрохлоридом.
В лечении ОА используется обработанная по особой технологии комбинация экстрактов авокадо и сои. Свою эффективность — уменьшение боли и ограничения подвижности сустава — она продемонстрировала в нескольких плацебо-контролируемых исследованиях: хороший и очень хороший эффект отмечен у 62–67% больных и умеренный у 25–31% больных.
Следует отметить, что положительное влияние медленно действующих препаратов на течение ОА очень сложно оценить. Критерием клинического эффекта должно служить уменьшение болевого синдрома и, соответственно, уменьшение потребности больного в обезболивающей терапии, улучшение функциональной способности больного и наличие периода последействия — сохранение клинического эффекта после отмены препарата.
Большую роль в нормальном функционировании хряща играют гиалуроновая кислота и гиалуронан. Они осуществляют амортизационную и лубрикационную (смазывающую) функцию, являются субстратом для синтеза протеогликанов, защищают болевые рецепторы синовиальной оболочки от раздражения, улучшая свойства синовиальной жидкости, облегчают проникновение в хрящ питательных веществ и веществ, необходимых для построения матрикса хряща.
Механизм действия препарата, полученного из морских организмов (см. табл. 2), сочетает антигиалуронидазную активность (ингибируется деструкция соединительнотканных хрящевых структур) и стимуляцию синтеза гиалуроновой кислоты (усиливаются репаративные процессы). В состав препарата входят хондроитина−6-сульфат, хондроитина−4-сульфат, кератана сульфат, гиалуроновая кислота, дерматана сульфат, полипептиды, аминокислоты и микроэлементы. Показана эффективность препарата при лечении гонартроза, коксартроза и межпозвонкового артроза.
Предпосылкой внутрисуставного введения препаратов гиалуроновой кислоты (гиалуронана, гиалуроната) является тот факт, что нативный гиалуронан в суставной жидкости здорового человека имеет средний молекулярный вес 2–4 млн дальтон, но с возрастом и особенно у больных ОА его молекулярный вес снижается. Кроме того, при наличии явного выпота в суставную полость, концентрация гиалуронана уменьшается. Гиалуронан выполняет функцию стабилизации структуры протеогликанов, которые, связываясь с ним, образуют макромолекулы, откладывающиеся в коллагеновой сети суставного хряща и придающие последнему упругость и эластическую прочность. Введение препаратов гиалуронана в сустав приводит к быстрому купированию боли и нормализации свойств синовиальной жидкости. При введении не следует пользоваться анестетиками, попадание их в полость сустава приводит к распаду препарата и снижению лечебного эффекта.
Препараты, содержащие гиалуронан, получают путем длительной бактериальной ферментации либо выделяют из петушиных гребешков. До лечения препаратами гиалуронана необходимо купировать синовит. Введение этих препаратов больным с наличием воспалительного выпота в суставе может привести к обострению болевого синдрома, покраснению сустава в течение 1–2 недель после внутрисуставной манипуляции. Препараты гиалуронана следует осторожно использовать у пациентов с аллергией на птичий белок и птичье перо, с венозным и лимфатическим стазом нижних конечностей.
Все медленно действующие препараты, применяемые per os или внутримышечно, используются при лечении артроза крупных и мелких суставов. Внутрисуставное введение используется в лечении гонартроза.
В соответствии с рекомендациями Европейской антиревматической Лиги больным с ОА показано сочетание фармакологических и нефармакологических (обучение больного, снижение веса, защита сустава, физические упражнения) методов лечения. Для выбора оптимальной терапии следует учитывать локализацию поражения, выраженность боли и воспаления, факторы риска развития побочных реакций фармакотерапии.


