L27.2 Дерматит, вызванный съеденной пищей, МКБ-10
Отредактировано: 05.07.2024
Пищевая аллергия
Определение и классификация
Пищевая аллергия (ПА) – побочная реакция на пищевые аллергены, опосредованная рядом иммунологических механизмов, включающих реакции с участием специфических IgE, клеточно-опосредованные и смешанные (IgE- и не IgE-опосредованные) реакции [1].
В клинической практике применяется классификация проявлений ПА Европейской Академии Аллергологии и Клинической Иммунологии (EAACI) по патогенетическому принципу [2]:
- IgE-посредованные реакции:
- оральный аллергический синдром (пищевая аллергия, обусловленная сенсибилизацией к пыльце);
- крапивница/ангиоотек;
- риноконъюнктивит/астма;
- гастроинтестинальные симптомы:
- тошнота,
- рвота,
- боли в животе,
- диарея;
- анафилаксия;
- анафилаксия при пищевой аллергии, индуцированная физической нагрузкой;
- Смешанные IgE-опосредованные и клеточные реакции:
- атопический дерматит (АтД);
- эозинофильная гастроинтестинальная патология;
- Аллергические реакции, опосредованные клеточными механизмами:
- индуцированный пищей проктит, проктоколит, энтероколит;
- индуцированная пищей энтеропатия.
Примеры формулировки диагноза:
- Аллергическая крапивница, острая, легкое течение (L50.0). Пищевая аллергия на киви.
- Аллергический и алиментарный гастроэнтерит и колит (К52.2). Пищевая аллергия к БКМ (не IgE- зависимый вариант).
_1.png)
Источник: Lin C. H. Food allergy: what it is and what it is not? //Current Opinion in Gastroenterology. – 2019. – Т. 35. – №. 2. – С. 114-118.
Этиология
В большинстве случаев в качестве причинно-значимых аллергенов при ПА выступают белки пищевых продуктов массой 10-70 кДа. Значение имеет не только наличие в молекуле белка определенных участков – эпитопов, необходимых для активации Т-хелперов 2-го типа (Тh2) и выработки IgЕ-антител, но и количество поступивших во внутреннюю среду организма белковых молекул. Так, избыточный контакт с антигенами пищи, который происходит при нарушении барьерной функции желудочно-кишечного тракта (ЖКТ), также способствует развитию сенсибилизации к ним [1, 2].
Наиболее часто аллергические реакции вызывают следующие продукты – представители так называемой «большой восьмерки»:
- коровье молоко,
- куриное яйцо,
- арахис,
- орехи,
- рыба,
- морепродукты,
- пшеница,
- соя.
Некоторые аллергены термолабильны, т.е. могут изменять свои свойства под действием высоких температур и терять аллергенность. На термостабильные аллергены, напротив, нельзя повлиять в процессе кулинарной обработки продукта.
Сенсибилизация к таким продуктам, как цитрусовые, клубника, кофе, какао, шоколад и мед, менее распространена. Однако содержащиеся в них вещества (например, гистамин, тирамин, гистаминолибераторы) способны усиливать имеющиеся проявления ПА или вызывать похожие на ПА реакции за счет механизмов неиммунного характера: в этом случае развиваются псевдоаллергические реакции. В патогенезе таких реакций лежит неспецифическое высвобождение медиаторов (в основном – гистамина) из базофилов и тучных клеток.
Некоторые содержащиеся в пище вещества способны провоцировать возникновение аллергической реакции из-за перекрестной реактивности с другими аллергенами (как правило, пыльцевыми), к которым пациент уже сенсибилизирован [1].
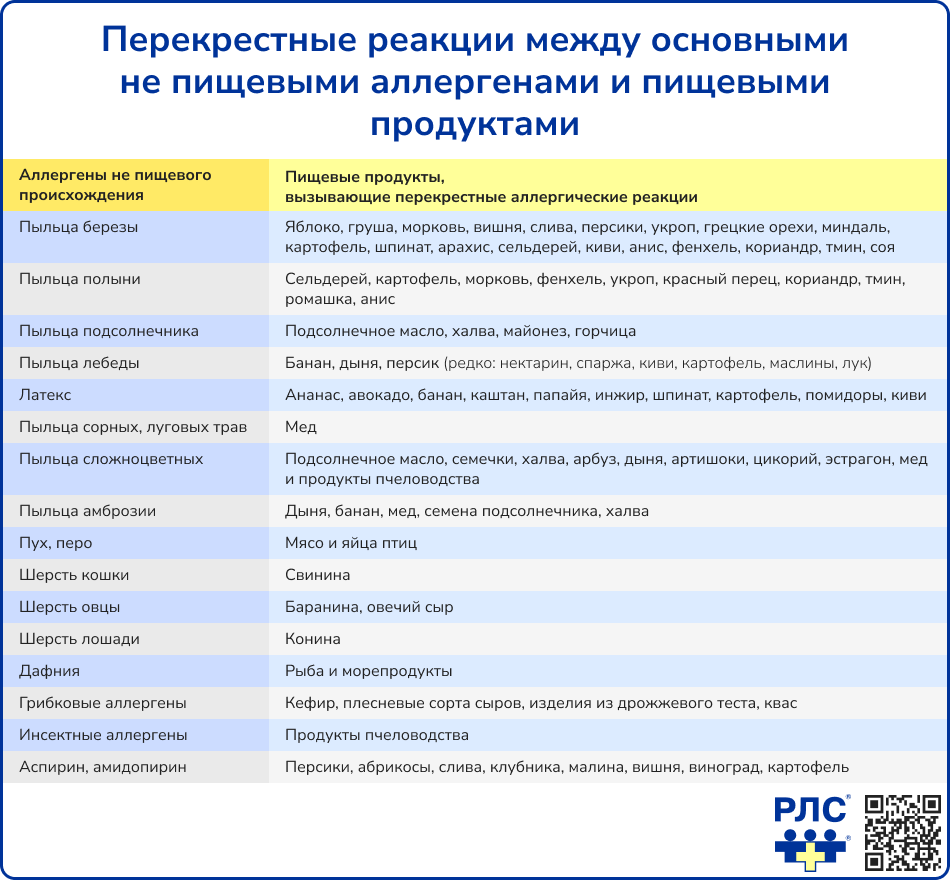
_1.png)
Аллергические реакции также могут развиваться в ответ на употребление продуктов, содержащих некоторые пищевые добавки, преимущественно натурального происхождения [1]:
- аннато (Е160b),
- кармин (Е120),
- шафран,
- эритритол (ERT),
- гуаровая камедь (Е412),
- каррагинан,
- желатин,
- пектин (IIВ),
- сульфиты и их производные,
- салицилаты,
- бензойная кислота (Е–210) и ее производные (Е 211–Е 219),
- тартразин (Е102).
Патогенез
Согласно классификации EAACI, в основе ПА лежат два типа реакций – IgE-опосредованные и клеточно-опосредованные [2].
IgE-опосредованная пищевая аллергия
Этот класс пищевой аллергии связан с риском развития тяжелых или смертельных реакций.
Иммунологические механизмы, лежащие в основе как местных, так и системных проявлений IgE-опосредованной ПА, представляют собой реакции гиперчувствительности I типа на специфические пищевые аллергены. На этапе аллергической сенсибилизации происходит первый контакт с аллергеном, который определяет начальный иммунологический ответ, приводящий к нарушению толерантности и последующей выработке специфических IgE. Первый контакт обычно происходит перорально, но возможны и другие пути сенсибилизации – через измененную кожу (при АтД) или ингаляционно. В случае орального аллергического синдрома пациент сенсибилизируется к вдыхаемым пыльцевым аллергенам, которые перекрестно реагируют с пищевыми аллергенами [3, 4]. После выработки IgE связываются с высокоаффинным рецептором для Fc-фрагмента на мембране тканевых тучных клеток и циркулирующих базофилов, в цитоплазме которых содержатся вазоактивные вещества и медиаторы анафилаксии, такие как гистамин. Таким образом, эти клетки становятся сенсибилизированными и при повторном контакте с аллергеном активируются и дегранулируют, высвобождая медиаторы анафилаксии в тканях и кровотоке. Эти процессы лежат в основе немедленной (ранней) фазы аллергических реакций, которая обуславливает клинические проявления ПА. После дегрануляции эффекторных клеток происходит выработка «de novo» других иммуномедиаторов, включая фактор активации тромбоцитов (ФАТ), лейкотриены и интерлейкины IL-4, IL-5 и IL-13, которые способствуют дальнейшему развитию аллергического воспаления [4-6].
Помимо немедленной фазы, существует также отсроченная (поздняя) фаза IgE-опосредованной аллергической реакции, которая отличается от реакций клеточной гиперчувствительности замедленного типа. Некоторые медиаторы, высвобождаемые в ранней фазе, действуют как хемоаттрактанты и привлекают другие эффекторные воспалительные клетки (эозинофилы, базофилы, лейкоциты), которые дополнительно активируют воспалительный процесс и приводят к его хронизации [7].
Хотя ранняя и поздняя фазы аллергического воспаления тесно связаны между собой, сигнальные пути и медиаторы, участвующие в каждой из них, различаются, из-за чего проявления их неодинаковы. Симптомы ранней фазы преимущественно функциональные, острые и быстро обратимые, в то время как проявления поздней фазы менее обратимы. В начальной фазе гистамин и ФАТ выделяются в основном тучными клетками и находятся под контролем регуляторных Т-лимфоцитов (Treg). Если аллерген попадает в кровь, дополнительные пути активации могут быть также опосредованы базофилами и нейтрофилами. Специфические воспалительные цитокины, включая фактор некроза опухоли (TNF)-альфа и цитокины Th2, такие как IL-9, IL-31 и IL-33, лежат в основе позднего воспаления тканей [4].
При системном распространении аллергена могут возникать симптомы, вызванные гистамином и ФАТ, которые поражают не только желудочно-кишечный тракт, но и другие органы, включая кожу (крапивница) и легкие (астма). Серотонин и ФАТ играют центральную роль в острых желудочно-кишечных проявлениях, например, при диарее. Распространяющиеся аллергены взаимодействуют не только с тучными клетками, но и с циркулирующими сенсибилизированными базофилами, вызывая жизнеугрожающие анафилактические реакции, характеризующиеся полиорганным поражением, гипотонией и развитием шока [4, 8].
Не-IgE-опосредованная пищевая аллергия
В основе этого типа ПА лежат реакции гиперчувствительности замедленного типа (реакции IV типа по классификации Джелла и Кумбса). Большинство изученных не-IgE-опосредованных пищевых аллергий в первую очередь поражают желудочно-кишечный тракт. Считается, что аллерген-специфические Т-клетки играют роль в развитии индуцированного пищей проктита, проктоколита, энтероколита и энтеропатии, которые в основном возникают у младенцев и детей младшего возраста с аллергией на коровье молоко и, как правило, проходят после 1-5 лет [9].
Смешанная пищевая аллергия
Этот класс пищевой аллергии характеризуется как IgE-зависимыми, так и IgE-независимыми путями развития. Атопические проявления, возникающие под влиянием IgE-независимых факторов, включают отсроченный атопический дерматит (через 6-48 часов после воздействия), обусловленный действием Тh2 клеток, и эозинофильный эзофагит (ЭоЭ), характеризующийся стойкой эозинофильной инфильтрацией тканей [6, 10, 11].
Клиническая картина
Клинические проявления и возраст манифестации ПА зависят от типа реакции, которая составляет основу патогенеза этого состояния.


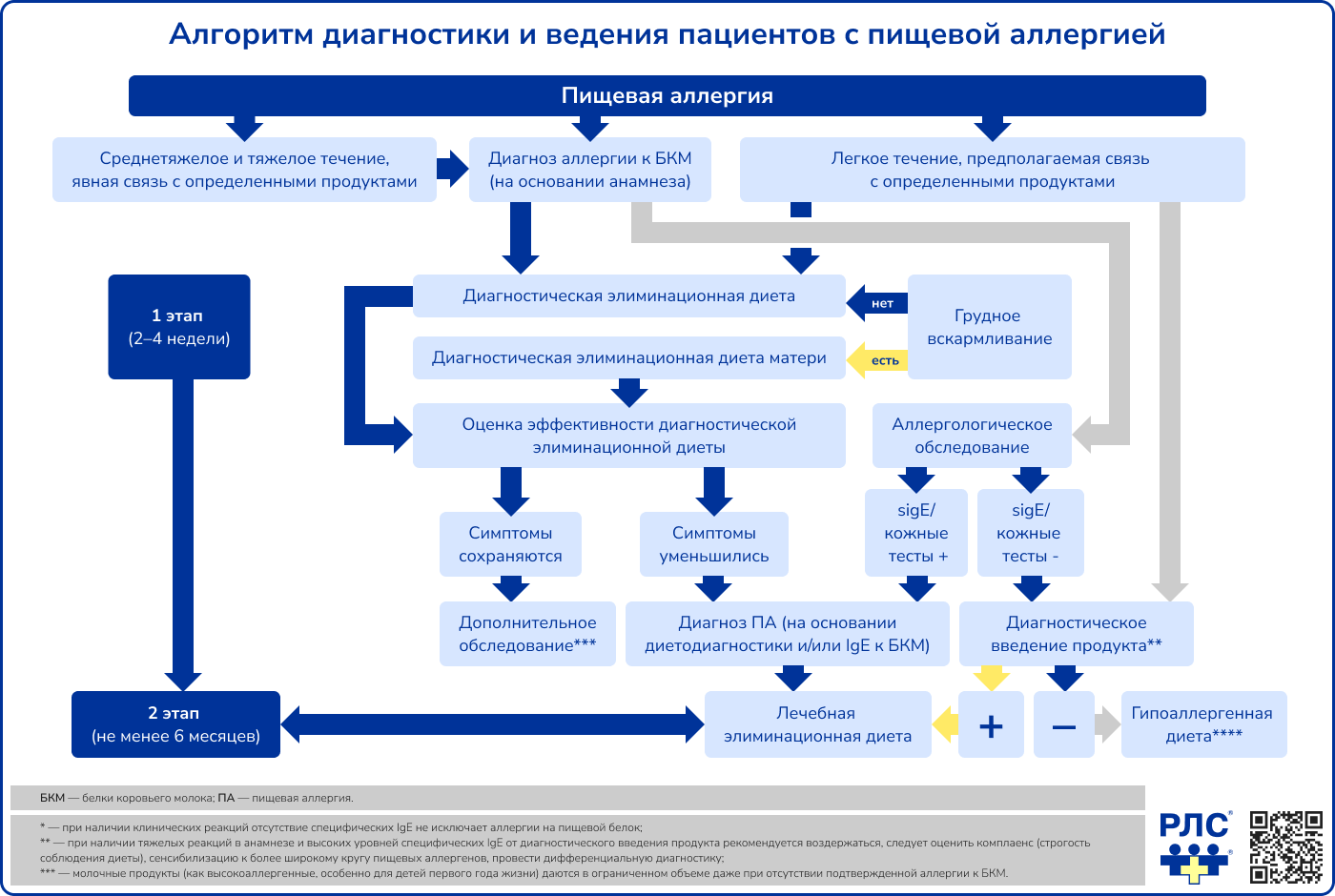
Диагностика
Жалобы и анамнез
При сборе анамнеза и жалоб оценивают [1]:
- наличие причинно-значимого аллергена;
- характер реакции (немедленного или замедленного типа);
- характер клинических симптомов и их тяжесть;
- воспроизводимость реакции;
- наличие сопутствующих факторов;
- семейный анамнез;
- наличие сопутствующей патологии, включая аллергические заболевания.
Физикальное обследование
Рекомендовано провести стандартный клинический осмотр и обратить внимание на рост и массу тела, оценить состояние кожных покровов и наличие признаков атопии.
Аллергологическое обследование
К методам первой линии для установления причинно-значимого пищевого аллергена относят:
- кожное тестирование,
- определение уровня специфических IgE-антител (sIgE) в крови.
Дополнительными методами идентификации аллергена являются:
- диагностическая элиминационная диета,
- диагностическое введение продукта,
- оральный провокационный тест.
Кожное тестирование
К кожным аллергологическим тестам относят прик-тест, внутрикожный тест и ПАТЧ-тест [12].
Противопоказания к проведению кожного тестирования:
- наличие в анамнезе анафилактических реакций,
- прием β-блокаторов,
- выраженное обострение аллергического заболевания,
- дерматографическая крапивница,
- возраст до 2 лет,
- острое респираторное заболевание или обострение хронического процесса.
На результаты исследования влияет прием антигистаминных препаратов, системных и топических глюкортикостероидов, нейротропных средств [13, 14].
Определение уровня специфических IgE-антител в крови
Метод помогает идентифицировать причинно-значимый аллерген при наличии противопоказаний к проведению кожного тестирования, а также в ряде других случаев [14]:
- детям с множественной пищевой аллергией;
- при предположении о наличии нескольких триггеров анафилаксии;
- в случае неясного триггера (например, анафилаксия, возникшая при употреблении ряда возможных аллергенных продуктов);
- при отсутствии очевидного триггера (идиопатическая анафилаксия);
- при наличии или предполагаемой сенсибилизации к «опасным» аллергенам (например, арахис);
- при непостоянном возникновении симптомов при экспозиции предполагаемого или установленного аллергена.
В клинической практике применяются мультиплексные диагностические системы – «аллергочипы», которые способны выявлять сенсибилизацию к отдельным молекулам аллергена – аллергокомпонентам. Наиболее популярные системы такого типа – чипы системы ImmunoCAP ISAC и ALEX – одномоментно определяют наличие у пациента sIgE к широкому спектру аллергенов: 170 для ImmunoCAP ISAC и 282 для ALEX.
При отрицательных результатах кожного тестирования или отсутствии повышенного уровня sIgE и наличии убедительных анамнестических данных в пользу ПА предполагается присутствие у пациента не-IgE-опосредованной ПА.
Диагностическая элиминационная диета
Диагностическая элиминационная диета используется для диагностики как IgE-зависимых, так и не-IgE-зависимых форм ПА. В основе метода лежит исключение продуктов, содержащих предполагаемый аллергенный белок (при грудном вскармливании такие продукты исключаются из рациона матери). Такая диета назначается на срок, достаточный для оценки изменения клинических симптомов: от 7-10 дней у детей с реакциями немедленного типа (например, ангионевротический отек, рвота, возникновение кожных проявлений в течение 2 часов) до 2-4 недель у детей с отсроченными и хроническими реакциями (например, атопический дерматит) [15, 16].
Диагностическое введение продукта
Продукт, содержащий подозреваемый причинно-значимый аллерген, вводят в минимальном количестве, исходя из данных анамнеза – количества продукта и выраженности реакции на него при предыдущем употреблении. Начинают с дозы, значительно меньшей той, которая вызвала реакцию. Срок последующего наблюдения за пациентом также зависит от характера аллергической реакции: от 2 часов при реакциях немедленного типа до 2 суток при реакциях замедленного типа в анамнезе. Только при отсутствии реакции на первое введение продукта продолжают дальнейшее введение в постепенно возрастающих дозах. После введения продукта регистрируют симптомы, возникающие у пациента: кожные, респираторные, гастроинтестинальные реакции [1, 16-18]. Метод не используется при наличии анафилактических реакций в анамнезе.
Оральный провокационный тест
Не сертифицирован в РФ и сопряжен с риском возникновения тяжелых аллергических реакций [1, 14].
Другие исследования
Эзофагогастродуоденоскопия (ЭГДС) используется при наличии стойких жалоб со стороны желудочно-кишечного тракта, при задержке развития или железодефицитной анемии, иные причины которых не удалось установить [2].
Лечение
Патогенетическая терапия
Наиболее эффективный метод избавления от симптомов ПА – исключение взаимодействия с причинно-значимым аллергеном. С этой целью используются [1, 14]:
- Элиминационная диета (возможно постепенное возвращение продуктов в рацион из-за формирования толерантности в более старшем возрасте – например, к молоку, куриному яйцу, пшенице и сое [19]);
- Специализированные смеси на основе высокогидролизованного молочного белка или аминокислот у детей раннего возраста с аллергией на белок коровьего молока.
Аллерген-специфическая иммунотерапия (АСИТ) не рекомендуется для использования в рутинной практике при ПА из-за отсутствия стандартизованных схем и препаратов с доказанной эффективностью, а также из-за риска развития жизнеугрожающих аллергических реакций и высокой вероятности возобновления симптомов после проведенного лечения [20, 21]. АСИТ рекомендуется только для симптомных пациентов с подтвержденной аллергией к респираторным аллергенам и проводится соответствующими препаратами.
Симптоматическая терапия
В случае, если полное исключение источников аллергена из рациона невозможно, для купирования симптомов ПА применяют [1]:
- Антигистаминные препараты системного действия (II поколения):
- Эпинефрин – для купирования тяжелых и жизнеугрожающих проявлений ПА;
- Средства для купирования симптомов астмы (как правило, комбинации ингаляционных глюкокортикостероидов и короткодействующих β-агонистов) – используются больными с БА при возникновении респираторных симптомов после приема причинно-значимого аллергена.
Список литературы
- Союз педиатров России. Клинические рекомендации "Пищевая аллергия". 2021.
- Muraro A. et al. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy //Allergy. – 2014. – Т. 69. – №. 8. – С. 1008-1025.
- Schmiechen Z., Weissler K. A., Frischmeyer-Guerrerio P. A. Recent developments in understanding the mechanisms of food allergy //Current opinion in pediatrics. – 2019. – Т. 31. – №. 6. – С. 807.
- De Martinis M. et al. New perspectives in food allergy //International journal of molecular sciences. – 2020. – Т. 21. – №. 4. – С. 1474.
- Johnston L. K., Chien K. B., Bryce P. J. The immunology of food allergy //The Journal of Immunology. – 2014. – Т. 192. – №. 6. – С. 2529-2534.
- Yu W., Freeland D. M. H., Nadeau K. C. Food allergy: immune mechanisms, diagnosis and immunotherapy //Nature Reviews Immunology. – 2016. – Т. 16. – №. 12. – С. 751-765.
- Aalberse R. C., Platts-Mills T. A., Rispens T. The developmental history of IgE and IgG4 antibodies in relation to atopy, eosinophilic esophagitis, and the modified TH 2 response //Current allergy and asthma reports. – 2016. – Т. 16. – С. 1-9.
- Deschildre A., Lejeune S. How to cope with food allergy symptoms? //Current Opinion in Allergy and Clinical Immunology. – 2018. – Т. 18. – №. 3. – С. 234-242.
- Nowak-Węgrzyn A. et al. Non–IgE-mediated gastrointestinal food allergy //Journal of Allergy and Clinical Immunology. – 2015. – Т. 135. – №. 5. – С. 1114-1124.
- Spergel J. M. Nonimmunoglobulin E-mediated immune reactions to foods //Allergy, Asthma & Clinical Immunology. – 2006. – Т. 2. – №. 2. – С. 1-8.
- Simon D. et al. Eosinophilic esophagitis is characterized by a non‐IgE‐mediated food hypersensitivity //Allergy. – 2016. – Т. 71. – №. 5. – С. 611-620.
- Ansotegui I. J. et al. IgE allergy diagnostics and other relevant tests in allergy, a World Allergy Organization position paper //World allergy organization journal. – 2020. – Т. 13. – №. 2. – С. 100080.
- Балаболкин И. И., Мачарадзе Д. Ш. Кожные пробы: показания и противопоказания //Вопросы современной педиатрии. – 2013. – Т. 12. – №. 3. – С. 31-37.
- Лепешкова Т. С. и др. Пищевая аллергия. Диагностика, лечение и профилактика. – 2021.
- Molina-Infante J. et al. Step-up empiric elimination diet for pediatric and adult eosinophilic esophagitis: the 2-4-6 study //Journal of Allergy and Clinical Immunology. – 2018. – Т. 141. – №. 4. – С. 1365-1372.
- Kagalwalla A. F. et al. Efficacy of a 4-food elimination diet for children with eosinophilic esophagitis //Clinical Gastroenterology and Hepatology. – 2017. – Т. 15. – №. 11. – С. 1698-1707. e7.
- Lambert R. et al. Evidence that eating baked egg or milk influences egg or milk allergy resolution: a systematic review //Clinical & Experimental Allergy. – 2017. – Т. 47. – №. 6. – С. 829-837.
- Nachshon L. et al. Food allergy to previously tolerated foods: Course and patient characteristics //Annals of Allergy, Asthma & Immunology. – 2018. – Т. 121. – №. 1. – С. 77-81. e1.
- Chinthrajah R. S. et al. Diagnosis of Food Allergy //Pediatric Clinics of North America. – 2015. – Т. 62. – №6. – С. 1393–1408.
- Wood R. A. Oral immunotherapy for food allergy //J Investig Allergol Clin Immunol. – 2017. – Т. 27. – №. 3. – С. 151-159.
- Nurmatov U. et al. Allergen immunotherapy for IgE‐mediated food allergy: a systematic review and meta‐analysis //Allergy. – 2017. – Т. 72. – №. 8. – С. 1133-1147.
Описание проверено экспертом
Статьи по теме Иммунология
- Аллергический ринит
- Гиперчувствительный пневмонит
- Наследственный ангиоотек
- Крапивница
- Атопический дерматит
- Анафилаксия
- Мастоцитоз
- Эозинофильный эзофагит
- Узловатая почесуха
- Бронхиальная астма
- Системная красная волчанка
Болезни в статье:
- L50.0 Аллергическая крапивница
- J30.1 Аллергический ринит, вызванный пыльцой растений
- J45.0 Астма с преобладанием аллергического компонента
- L20 Атопический дерматит
- L50.3 Дерматографическая крапивница
Фармгруппы в статье:
Оцените статью:
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
пищевая аллергия
аллергические реакции на арахис, гиперчувствительность к арахису, гиперчувствительность к сое, Непереносимость сои, повышенная чувствительность к арахису или сое, гиперчувствительность или непереносимость глютена, так как в составе препарата содержится пшеничный крахмал, аллергия на арахисовое масло, Аллергия на белок соевых бобов, гиперчувствительность к ореховому маслу, пищевой аллергией, пищевая аллергия, Повышенная чувствительность к сое, повышенная чувствительность к арахис, Повышенная чувствительность к арахису, аллергическая реакция на арахис, повышенная чувствительность к сою, Повышенная чувствительность к белку соевых бобов, известной непереносимостью продуктов из кукурузы, аллергия на пшеницу, повышенная чувствительность к арахиса, аллергией на моллюски, аллергией на креветки, повышенная чувствительность к продуктам из сои, с известной непереносимостью продуктов из кукурузы, известной непереносимостью кукурузы, аллергией на морепродукты, аллергией на рыбу и морепродукты, Известная гиперчувствительность к арахисовому белку, Выявленная гиперчувствительность к ореховому маслу, Известная гиперчувствительность к соевым белкам, у пациентов с известной непереносимостью меда, тяжелые аллергические реакции на пищевые продукты, Пищевая аллергия к рыбе, Установленная аллергия на рыбу, Выявленная гиперчувствительность к белку соевых бобов, аллергия на белки молока, белку сои, гиперчувствительность к соевым белкам, аллергия на арахис, аллергией на морковь, гиперчувствительность к белку арахиса, гиперчувствительность к арахисовым белкам, Известная гиперчувствительность к соевому белку, Известная гиперчувствительность к арахису, аллергия на сою,


