D35.2 Гипофиза, МКБ-10
Отредактировано: 23.08.2023
Опухоли гипофиза составляют около 10% внутричерепных новообразований. Делятся на: опухоли аденогипофиза (передней доли гипофиза) — аденома и рак гипофиза; и опухоли нейрогипофиза (задней доли и воронки гипофиза) — глиомы и зернисто-клеточная опухоль воронки (хористома, инфундибулома). Рак гипофиза — казуистика, опухоли нейрогипофиза встречаются очень редко, как и метастазы в гипофиз рака и некоторых внутричерепных опухолей, в частности герминомы.
В большей части случаев опухоли гипофиза представлены аденомами — доброкачественными новообразованиями, возникающими из клеток передней доли гипофиза. Заболеваемость — 1,2 на 100 тыс. населения в год, половых различий нет, пик заболеваемости приходится на 3 и 4 декады жизни. Опухоли чаще спонтанны, но могут быть проявлением синдрома множественных эндокринных опухолей 1 типа (см. соответствующий раздел). Также описано развитие аденом гипофиза по принципу «обратной связи» после двусторонней адреналэктомии, тиреоидэктомии и кастрации.
Аденомы гипофиза
Классифицируются по вырабатываемому клетками новообразования гормону (подразделяются на пролактиномы, соматотропиномы, адрекокортикотропиномы и т.д.), и 30% из них — гормонально не активны. Использовавшаяся ранее гистологическая классификация аденом по отношению к красителям (на эозинофильные, базофильные и хромофобные) смысла не имеет, поскольку не коррелирует с гормональной активностью и биологическим поведением аденомы.
Опухоли менее 1 см в максимальном измерении называют микроаденомами (рис. 1). По мере роста опухоли она вызывает увеличение размеров турецкого седла, затем распространяется в полость черепа, сдавливает хиазму и зрительные нервы, что проявляется нарушениями остроты и полей зрения (чаще по типу битемпоральной гемианопсии). При распространении опухоли в кавернозный синус появляются глазодвигательные нарушения, при сдавлении III желудочка — внутричерепная гипертензия. Помимо неврологических, как правило, выявляются эндокринные нарушения — гипопитуитаризм (как результат снижения выработки гормонов сдавленным или разрушенным опухолью гипофизом) той или иной степени выраженности, часто в сочетании с проявлениями гиперпродукции того или иного гормона клетками опухоли.
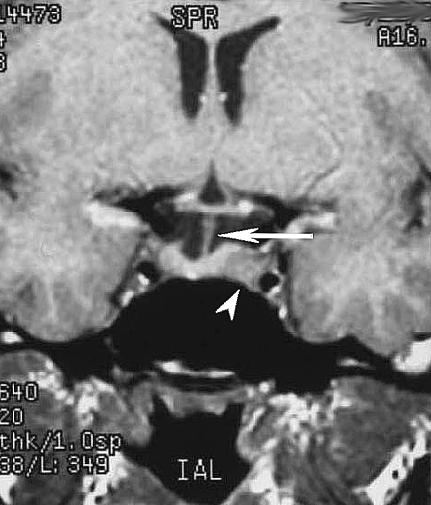
Рисунок 1. Микроаденома гипофиза (стрелка) (МРТ, Т1-взвешенное изображение, фронтальная проекция)
Диагностика опухоли гипофиза включает МРТ, исследование остроты и полей зрения и оценку эндокринологического статуса больного — как клиническую, так и исследование содержания гормонов (передней и задней долей гипофиза, щитовидных, половых, кортизола) в сыворотке крови. Большинство аденом характеризуется низким сигналом на Т1— и высоким — на Т2-взвешенных изображениях (рис. 2–4). Микроаденомы лучше визуализируются после внутривенного введения препарата гадолиния. КТ может иметь значение для уточнения характера костных изменений и размеров турецкого седла.
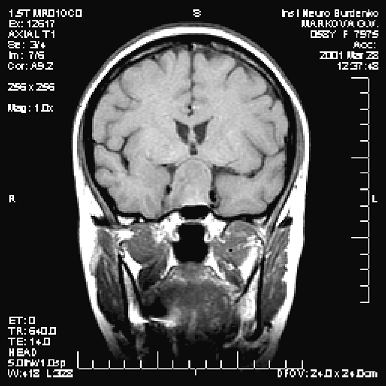
Рисунок 2. Аденома гипофиза средних размеров (МРТ, Т1-взвешенное изображение, фронтальная проекция)
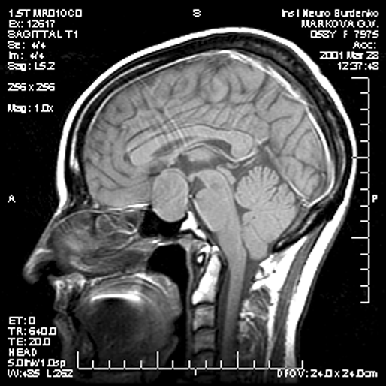
Рисунок 3. Аденома гипофиза средних размеров (МРТ, Т1-взвешенное изображение, сагиттальная проекция)
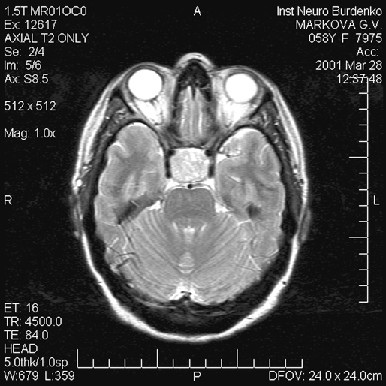
Рисунок 4. Аденома гипофиза средних размеров (МРТ, Т2-взвешенное изображение, аксиальная проекция)
Хирургическое лечение опухолей гипофиза осуществляется посредством либо трансназосфеноидального (через основную пазуху), либо транскраниального доступов. Первый доступ — метод выбора при микроаденомах, второй — при больших и гигантских опухолях. Иногда опухоль гипофиза характеризуется как большими размерами внутричерепного узла, так и инвазивным ростом в структуры основания черепа. В этих случаях операция обычно разделяется на 2 этапа: вначале из транскраниального доступа удаляется внутричерепная часть опухоли, затем из трансназального — опухоль из полости турецкого седла и структур основания черепа.
Трансназосфеноидальное удаление аденомы гипофиза производится в условиях общей анестезии с использованием рентгентелевизионного контроля, операционного микроскопа и специального инструментария. После отделения слизистой оболочки носовая перегородка пересекается в задних отделах вблизи передней стенки основной пазухи и смещается в сторону, производится трепанация передней стенки основной пазухи, затем — трепанация дна и передней стенки турецкого седла, после чего становится видна опухоль, покрытая капсулой. Капсула рассекается и опухоль удаляется. Ткань гипофиза, чаще распластанного в задненижних отделах полости турецкого седла, обычно удается визуализировать и сохранить, что уменьшает или даже исключает потребность в гормонозаместительной терапии в послеоперационном периоде. В конце операции полость седла тампонируется фрагментом жировой ткани или гемостатической губкой, трепанационный дефект дна седла закрывается костными и хрящевыми фрагментами носовой перегородки. Затем носовая перегородка со слизистой оболочкой устанавливается на место, фиксируется тампонами на 4–5 сут.
При применении современных антисептиков для полости носа и периоперационной антибиотикопрофилактики число инфекционных осложнений после трансназосфеноидальной хирургии составляет доли процента. Риск назальной ликвореи — около 4%. Ликворея обычно прекращается после установки люмбального дренажа на 5–10 сут, повторные хирургические вмешательства (закрытие ликворной фистулы или люмбоперитонеальное шунтирование) требуются крайне редко.
Выбор конкретного варианта транскраниального доступа определяется преимущественной локализацией внутричерепного узла опухоли и предпочтениями хирурга. Обычно используются односторонний субфронтальный или лобно-височный (птериональный) доступы, в отдельных случаях — двусторонний субфронтальный доступ. При распространении опухоли в кавернозный синус иногда используют сочетание интрадурального и экстрадурального подходов.
После доступа к хиазмально-селлярной области путем приподнимания лобной доли (что при субфронтальном доступе может вести к повреждению обонятельного тракта) визуализируется капсула опухоли, обычно смещающая зрительные нервы латерально и хиазму — кзади. Капсула опухоли представляет собой растянутую диафрагму турецкого седла, она рассекается и производится удаление опухоли. Особое внимание уделяется сохранению зрительных нервов, хиазмы и воронки («стебля») гипофиза. При опухоли больших размеров от ее заднего полюса приходится отделять переднюю соединительную, передние мозговые артерии и структуры дна III желудочка. При распространении опухоли кзади, за спинку турецкого седла, она может достигать задних отделов вилизиева круга и даже основной артерии.
Освобождение зрительных нервов от сдавления опухолью достигается в подавляющем большинстве случаев, соответственно, нарушения зрения у больных обычно регрессируют. Однако радикальное удаление большой аденомы гипофиза, обрастающей магистральные сосуды и распространяющейся в кавернозный синус, обычно бывает невозможным.
Инфекционные осложнения и ликворея при транскраниальных вмешательствах наблюдаются редко. Самое опасное осложнение — кровоизлияние в остатки опухоли, что оправдывает стремление к максимально радикальному удалению аденомы.
Летальность после удаления аденом гипофиза зависит от размеров опухоли и колеблется от практически нулевой при микроаденомах до 4–5% при опухолях большого и гигантского (обычно свыше 5 см в максимальном измерении) размера.
В послеоперационном периоде обычно отмечается нарастание выраженности имевшихся и/или появление новых эндокринных нарушений (гипокортицизма, несахарного диабета, гипотиреоза, гипогонадизма). У большинства (примерно 90%) больных эти нарушения в течение нескольких недель регрессируют по крайней мере до предоперационного уровня. В этот период (а при сохранении эндокринных нарушений — в течение всей жизни) больным требуется заместительная терапия под наблюдением квалифицированного нейроэндокринолога.
Помимо хирургического существуют дополнительные и альтернативные методы лечения аденом гипофиза.
Лучевая терапия в настоящее время применяется редко, обычно при повторных рецидивах опухоли. Это связано, во-первых, с достаточно низкой радиочувствительностью аденом и соответственно низкими цифрами контроля роста опухоли, во-вторых, с длительным сроком ожидания биохимической ремиссии (нормализации или снижения уровня вырабатываемого опухолью гормона в крови), и, наконец, с высокой частотой развития лучевых осложнений — от пангипопитуитаризма до лучевого некроза мозга. Использовавшаяся ранее рентгенотерапия применяться не должна по причине неэффективности и высокого числа осложнений.
Радиохирургия — перспективный метод и в ряде случаев — альтернатива хирургическому вмешательству. Однако следует иметь в виду, что даже при эффективном радиохирургическом лечении биохимическая ремиссия наступает не сразу, а через несколько месяцев после операции.
Помимо указанных существуют и способы медикаментозного лечения некоторых аденом.
Выбор оптимального метода (или набора методов) лечения определяется гормональным профилем опухоли.
Пролактиномы
Встречаются чаще других аденом. Клетки опухоли секретируют пролактин. Первые проявления у женщин — аменорея и галакторея, по поводу которых они сразу обращаются к врачу и соответственно диагноз устанавливается обычно на стадии микроаденомы. У мужчин пролактиномы вызывают снижение либидо, затем импотенцию и гинекомастию, но поводом для обращения к врачу обычно бывает появление зрительных нарушений, т.е. на момент диагностики пролактиномы у мужчин достигают больших размеров.
Диагноз пролактиномы устанавливается на основании повышения уровня пролактина в сыворотке крови выше 200 нг/мл. Уровень от 25 до 200 нг/мл делает диагноз пролактиномы предположительным.
Тактика лечения определяется размерами опухоли. При микроаденомах вначале назначаются агонисты дофамина (бромокриптин, каберголин и др.) в индивидуально подбираемой дозе, обеспечивающей нормализацию уровня пролактина и обычно стабилизацию или уменьшение опухоли. У большинства женщин при адекватном лечении агонистами дофамина восстанавливается менструальный цикл, становится возможной беременность (предпочтительный метод родоразрешения — кесарево сечение).
Основной побочный эффект агонистов дофамина — снижение АД, вызывающее головные боли, тошноту, головокружения, некоторые больные жалуются на кошмарные сновидения, возможен ортостатический коллапс. Обычно эти эффекты наиболее выражены в первые недели лечения. Препараты рекомендуется принимать на ночь и дозу увеличивать постепенно.
Бромокриптин обычно назначают внутрь с 1,25 мг на ночь и увеличивают на 1,25 мг каждые 3–4 дня до нормализации уровня пролактина, обычно эффективной дозой бывает 5–7,5 мг/сут. При необходимости назначения высоких доз препарата 50% дозы следует принимать на ночь, остальные 50% — в 2–3 приема в течение дня.
Каберголин назначают внутрь с 0,25 мг 2 раза в нед, через 4 нед лечения контролируют уровень пролактина и при необходимости увеличивают дозу до 0,5 мг 2 раза в нед и через 4 нед вновь контролируют уровень пролактина. Обычно эффективна доза каберголина — 0,5–1 мг 2 раза в нед, при необходимости доза может быть постепенно увеличена до 1,5 мг 2 раза в неделю.
При неэффективности или непереносимости консервативного лечения, а также при опухолях больших размеров, вызывающих зрительные нарушения и внутричерепную гипертензию, пролактинома удаляется и продолжается лечение теми же препаратми (обычно в меньшей, лучше переносимой дозе). При противопоказаниях, а также при отказе больного от операции возможно радиохирургическое лечение. Дистанционная гамма-терапия малоэффективна, применяется изредка при рецидивирующих пролактиномах. Цитостатики неэффективны.
Соматотропиномы
Соматотропиномы вырабатывают гормон роста, гиперпродукция которого вызывает акромегалию или (при развитии заболевания в периоде роста) гигантизм. Поскольку изменения нарастают медленно, большинство больных обращается к нейрохирургу в развернутой стадии заболевания. Диагностическое значение имеет повышение уровня соматотропина в сыворотке свыше 5 нг/мл. При уровнях ниже 5, но выше 2 нг/мл проводится сахарная нагрузка, если на этом фоне уровень соматропина не снижается, то это указывает на его выработку клетками опухоли. Опухоли обычно не достигают больших размеров и соответственно не вызывают неврологической симптоматики. Без лечения большинство больных с соматотропиномами погибает в возрасте до 60 лет от сердечно-сосудистых осложнений.
В плане консервативного лечения может использоваться аналог соматостатина октреотид, который вводится п/к вначале по 50 мкг каждые 8 ч, через месяц лечения контролируют уровень СТГ в крови и при необходимости увеличивают дозу препарата до 100 мкг 3 раза в день. В дальнейшем контроль уровня СТГ производят ежемесячно, обычно эффективна доза препарата — 100–200 мкг п/к каждые 8 ч. На фоне лечения препаратом уровень СТГ снижается более чем у 90% больных, причем у 2/3 — до нормальных значений. У 30% пациентов отмечается уменьшение размеров соматотропиномы. Однако исключительно высокая стоимость лечения препаратом пока ограничивает его применение.
Хирургическое лечение — оптимальный метод, при условии полного удаления опухоли обеспечивающий нормализацию уровня соматотропина и, тем самым, останавливающий развитие акромегалии (обратного ее развития не происходит, но уменьшение отечности тканей обеспечивает определенный косметический эффект).
Радиохирургия также эффективна, но уровень соматотропина снижается медленно, в срок до 4–6 мес, в течение которого продолжается прогрессирование акромегалии. Лучевая терапия малоэффективна, цитостатики неэффективны.
Адренокортикотропиномы
Адренокортикотропиномы вырабатывают АКТГ, что ведет к гиперпродукции кортизола и развитию синдрома Иценко — Кушинга (ожирение, лунообразное лицо, пурпурные стрии, артериальная гипертензия, гипергликемия, глюкозурия и остеопороз). В отличие от других опухолей гипофиза, встречаются преимущественно (в 9 раз чаще) у женщин. У многих больных развивается миокардиопатия и хроническая недостаточность кровообращения, вторичный (стероидный) иммунодефицит, нарушения сна, психики (от эмоциональной лабильности до психоза), у 20% — инсулинорезистентный сахарный диабет.
Информативно повышение содержания АКТГ в сыворотке свыше 60 нг/мл (но очень высокие уровни — свыше 120 нг/мл — патогномоничны для эктопической секреции АКТГ, т.е. в первую очередь для бронхогенного (мелкоклеточного) рака легких, затем тимомы, феохромоцитомы и рака щитовидной железы. Примечательно, что эктопическая секреция АКТГ встречается преимущественно у мужчин (в соотношении 10:1).
Эффективно хирургическое лечение — удаление адренокортикотропиномы. Однако примерно в половине наблюдений опухоль бывает столь малого размера, что не выявляется при МРТ. В этом случае может быть произведена катетеризация каменистых или сигмовидных синусов с раздельным определением в оттекающей крови уровня АКТГ, после чего производится удаление ткани примерно половины гипофиза на стороне большей концентрации гормона. При микроаденомах биохимическая ремиссия достигается у 85% больных.
При неэффективности хирургического лечения или при наличии противопоказаний к операции показана радиохирургия (при отсутствии такой возможности — лучевая терапия).
Медикаментозное лечение болезни Иценко — Кушинга направлено на коррекцию гиперкортизолизма. Назначается на время подготовки к операции, на период развития биохимической ремиссии после радиохирургии и (при неэффективности других способов лечения) в качестве самостоятельного метода. При медикаментозном лечении следует иметь в виду риск развития острой надпочечниковой недостаточности, поэтому правилом является медленное увеличение дозы препарата и биохимический контроль функции надпочечников.
Препарат выбора — кетоконазол, противогрибковое средство. Блокирует синтез стероидов в надпочечниках. Назначается с 200 мг внутрь 1 раз в сутки, доза может увеличиваться в зависимости от концентрации кортизола и 17-ОКС в моче, обычно эффективной дозой (разделенной на несколько приемов) бывает 400–1200 мг кетоконазола в сутки. Назначение свыше 1600 мг в сутки нецелесообразно. Эффективность (нормализация концентрации кортизола и 17-ОКС в моче) — свыше 75%, со временем может уменьшаться.
Метирапон ингибирует конечные этапы синтеза кортизола (фермент 11-бета-гидроксилазу). Назначают с 250 мг 3 раза в день внутрь во время еды, доза может быть увеличена (под контролем уровня кортизола в плазме) до 6000 мг/сут. Эффективность — 75%, со временем снижается.
Аминоглутетимид ингибирует начальные этапы синтеза стероидов из холестерина. Назначается со 125–250 мг внутрь 1 раз в сутки, доза коррегируется в зависимости от концентрации кортизола и 17-гидроксикортикостероидов в моче, нецелесообразно назначать более 1000 мг/сут. Эффективность — 50%, со временем уменьшается.
В резистентных случаях может быть использован цитостатик митотан, ингибирующий синтез кортизола и одновременно токсичный для клеток кортикального слоя надпочечников.
В резистентных ко всем видам лечения случаях производится двусторонняя адреналэктомия, после которой требуется постоянная замещающая терапия и у примерно 20% больных развивается синдром Нельсона (выраженная гиперпигментация кожи).
Тиреотропиномы
Тиреотропиномы — очень редкие опухоли, вырабатывают тиреотропный гормон (ТТГ). Первым проявлением бывает гипертиреоз. Опухоли обычно характеризуются агрессивным биологическим поведением, инвазивным ростом в структуры основания черепа и большими размерами на момент постановки диагноза. Радикальное удаление часто невозможно, даже при условии проведения лучевой терапии в послеоперационном периоде биохимическая ремиссия достигается только в 1/3 наблюдений. Перспективно радиохирургическое лечение, но накопленный на сегодня опыт невелик.
Поскольку клетки опухоли содержат рецепторы соматостатина, большинство тиреотропином реагирует на лечение октреотидом, схема лечения — такая же, как и при соматотропиномах. Снижение уровней Т3 и Т4 в плазме достигается у всех больных, нормализация — у 75%, уменьшение размеров опухоли — в 33% наблюдений.
При неэффективности или невозможности лечения октреотидом иногда помогает назначение небольших доз бета-блокаторов.
Гормонально-неактивные аденомы
Гормонально-неактивные аденомы вызывают вторичные эндокринные нарушения (гипопитуитаризм), но обычно поводом для обращения к нейрохирургу служат зрительные нарушения, т.е. на момент диагностики опухоль достигает значительных размеров. По мере внедрения в клиническую практику иммуногистохимических методик установлено, что многие, относившиеся к гормонально-неактивным, аденомы на самом деле вырабатывали ЛГ или ФСГ (гиперпродукция которых клинически не проявляется). Опухоли практически резистентны к медикаментозному лечению, поэтому оптимальный метод лечения — хирургическое вмешательство. При выявлении гормонально неактивной микроаденомы оправдано динамическое наблюдение (МРТ и исследование гормонального профиля раз в 6 мес).
Литература
Самотокина Б.А., Хилько В.А.Опухоли гипофиза и хиазмально-селлярной области. (Ред.).— Л.: Медицина, 1985.— 303 с.
Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Магнитно-резонансная томография в нейрохирургии.— М.: Видар, 1997.— 471 с.
Вайс Питер Г., Лейкок Джон Ф. Основы эндокринологии (Пер. с англ.).— М.: Медицина, 2000.— 500 с.
Нейроэндокринология ( клинические очерки)/ Под ред. проф. Маровой Е.И.— Ярославль: Диа-пресс, 1999.— 505 с.
Dolenc V.V. Anatomy and Surgery of the Cavernous Sinus. Springer-Verlag, Wien —New York, 1989.— 344 p.
Thapar K., Kovacs K., Scheithauer B., Lloyd R.V. Diagnosis and Management of Pituitary Tumors. USA: Humana Press, 2001.— 479 p.
Описание проверено экспертом
Оцените статью:
- Пролактинома
- Макропролактинома
- Микропролактиномы
- Аденома гипофиза
- Соматолиберинома
- Аумады-дель Кастильо синдром
- Опухоли гипофиза и супраселлярной области
- Пролактиномы
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
новообразование гипофиза
пролактинома
опухоль гипофиза, Опухоль гипофиза, секретирующая ГР, опухоли гипофиза, прогрессирующей опухолью гипофиза, опухолями гипофиза, секретирующими гормон роста, Пролактин-секретирующая опухоль гипофиза (пролактинома), Пролактинома, пролактиномы гипофиза, пролактинома гипофиза,


