M32 Системная красная волчанка, МКБ-10
- M32.0 Лекарственная системная красная волчанка
- M32.1 Системная красная волчанка с поражением других органов или систем
- M32.8 Другие формы системной красной волчанки
- M32.9 Системная красная волчанка неуточненная
Отредактировано: 12.03.2025
Системная красная волчанка
Определение
Системная красная волчанка (СКВ) – это аутоиммунное заболевание неустановленной этиологии, связанное с генетически обусловленными нарушениями иммунной регуляции, приводящими к выработке антиядерных антител и образованию иммунных комплексов, что вызывает воспаление в различных органах и тканях [1].
Классификация
Выделяют следующие степени активности аутоиммунного процесса при системной красной волчанке:
- Ремиссия – отсутствие у пациента клинических и лабораторных признаков активности процесса.
- Низкая активность (I степень): общее состояние пациента не нарушено, слабовыраженные изменения со стороны кожи и опорно-двигательного аппарата, незначительные отклонения лабораторных показателей; поражение внутренних органов выявляется только при инструментальном обследовании.
- Умеренная активность (II степень): наблюдаются субфебрильная лихорадка, поражение суставов (полиартралгии, полиартрит), кожи и слизистых оболочек, почек (нефрит без нефротического синдрома и нарушения функции органа), умеренные отклонения лабораторных показателей (антинуклеарный фактор (АНФ), антитела к ДНК, циркулирующие иммунные комплексы (ЦИК) в умеренном титре, повышение СОЭ до 25-45 мм/ч).
- Высокая активность (III степень): у пациента наблюдаются выраженные изменения со стороны внутренних органов (нефрит с нефротическим синдромом, эндомиокардит, экссудативный перикардит или плеврит), вовлечение центральной нервной системы (ЦНС), кожи, опорно-двигательного аппарата (острый полиартрит, полимиозит), фебрильная лихорадка, выраженные воспалительные изменения (СОЭ более 45 мм/ч, высокие титры АНФ и антител к ДНК), значительное снижение уровня С3, С4 компонентов системы комплемента и гемолитической активности.
- «Волчаночный криз» – развитие недостаточности функции органа на фоне крайне высокой активности аутоиммунного процесса.
Этиология
Этиология системной красной волчанки остается неясной, однако высказываются предположения о влиянии ряда эндогенных и экзогенных факторов.
Гормональные факторы
СКВ чаще встречается у женщин, причем у подростков болезнь нередко начинается с менархе, а у взрослых обостряется во время беременности и после родов. Это связывают с воздействием половых гормонов на иммунный ответ [2]. Эстрадиол активирует В-клетки, повышая продукцию IgG и ИЛ-10, тогда как тестостерон обладает противовоспалительным действием [3]. У женщин с СКВ снижен уровень андрогенов из-за повышенной активности ароматаз, что ведет к избыточному синтезу провоспалительных цитокинов и активации сигнальных путей интерферонов I типа (ИФН-I), играющих ключевую роль в патогенезе болезни.
Факторы внешней среды
Наибольшее значение имеет инсоляция. Ультрафиолетовое облучение изменяет антигенные свойства ДНК клеток кожи, провоцируя аутоиммунные реакции и высвобождение провоспалительных цитокинов (ИЛ-1, ИЛ-3, ИЛ-6, ФНО-α), что приводит к развитию локального воспаления [4].
К другим факторам внешней среды относят курение и контакт с кремнием. Также рассматривается влияние загрязнения воздуха, ожирения, дефицита витамина D, вируса Эпштейна-Барр, пестицидов и изменения состава микробиоты [5].
Генетическая предрасположенность
Высокая частота развития СКВ в семьях пациентов, повышенная конкордантность среди монозиготных близнецов и наличие антинуклеарных антител у клинически здоровых родственников подтверждают роль наследственности в возникновении заболевания. При наличии болезни у матери риск ее развития у дочерей составляет 1:40, у сыновей – 1:250.
СКВ – преимущественно полигенное заболевание, ассоциированное с более чем 80 генами, участвующих в регуляции иммунных процессов [6]. Редкие моногенные формы связаны с дефектами системы комплемента (C1q, C2, C4), ферментных систем фагоцитов, процессов апоптоза, репарации и деградации ДНК, а также нарушениями ИФН-I сигнальных путей и формирования В-клеток [7].
Патогенез
Системная красная волчанка характеризуется множественными нарушениями иммунной системы, включая дефекты апоптоза, повышенную реакцию на антигены, содержащие нуклеиновые кислоты, и постоянную продукцию ИФН-I. Также отмечается пониженный порог активации аутореактивных B-лимфоцитов, продуцирующих аутоантитела. Одним из ключевых факторов возникновения таких антител является недостаточное устранение фрагментов погибших клеток, что делает аутоантигены доступными для иммунной системы.
Современные исследования показали, что помимо апоптоза и некроза существуют и другие формы клеточной гибели, такие как нетоз, аутофагия, некроптоз и пироптоз [8]. Дефекты механизмов, регулирующих эти процессы, связаны с повышенным риском развития аутоиммунных реакций и прогрессированием СКВ [8, 9]. В настоящее время ведутся исследования, направленные на выявление наиболее значимых патогенетических путей в развитии заболевания.
В одном из исследований у пациентов с СКВ были обнаружены повышенные уровни ИФН-I в сыворотке крови [10]. Важная роль ИФН-I в патогенезе была подтверждена при выявлении случаев развития СКВ у пациентов, получавших терапию ИФН-α при злокачественных заболеваниях [11]. Установлено, что у большинства пациентов с СКВ наблюдается повышенная экспрессия генов, регулируемых ИФН-I (так называемая «ИФН1-сигнатура»), которая коррелирует с активностью и тяжестью заболевания. Клинические проявления, аналогичные таковым при вирусных инфекциях, такие как лихорадка, кожные высыпания и лейкопения, связаны с эффектами ИФН-I.
Ключевую роль в формировании «ИФН1-сигнатуры» играет активация плазмоцитоидных дендритных клеток (пДК) аутоантигенами, содержащими нуклеиновые кислоты [12]. Образующиеся интерфероногенные иммунные комплексы интернализуются пДК посредством FcγRIIa и попадают в эндосомы, где их нуклеиновая кислота взаимодействует с Toll-подобными рецепторами (TLR) 7 и 9 типов. Недавние исследования также выявили аналогичный механизм для поглощения пДК IgE-антител, связывающих ДНК, с последующей TLR9-опосредованной активацией [13]. После активации пДК продуцируют ИФН, что приводит к усилению презентации антигенов, поддержанию выживания активированных T-клеток и стимуляции продукции антител B-лимфоцитами [12].
ИФН-I влияет не только на иммунную систему, но и на другие клетки организма, и может способствовать развитию таких осложнений, как преждевременный атеросклероз. Также показано, что тромбоциты, активированные иммунными комплексами, могут взаимодействовать с пДК и индуцировать продукцию ИФН-α, что сопровождается прогрессированием сердечно-сосудистых заболеваний у пациентов с СКВ [14, 15].
В патогенезе СКВ ключевую роль играют B-лимфоциты, демонстрирующие поликлональную активацию с усиленной продукцией аутоантител. ИФН-α снижает порог активации B-клеточного рецептора, усиливает пролиферацию и дифференцировку B-клеток в плазматические клетки. Одним из факторов выживания и активации B-клеток является стимулятор B-лимфоцитов (B lymphocyte stimulator, BLyS), принадлежащий к семейству фактора некроза опухоли (ФНО). BLyS продуцируется клетками миелоидного ряда, включая моноциты, нейтрофилы и пДК, а его экспрессия усиливается под влиянием ИФН-I, что связывает эти две цитокиновые системы в патогенезе СКВ [16].
Аутоантитела при СКВ также оказывают множество патогенетических эффектов. Например, анти-ДНК антитела способны связываться с задерживающимися в базальной мембране клубочков нуклеосомами, вызывая воспаление и повреждение почечных структур [17]. Кроме того, ДНК-реактивные аутоантитела могут проникать в ЦНС и взаимодействовать с N-метил-D-аспартатными рецепторами (NMDAR), что приводит к неврологическим проявлениям заболевания [18].
Важным открытием является обнаружение аутоантител против молекул межклеточного взаимодействия у пациентов с СКВ. Например, в подгруппе пациентов выявлены аутоантитела к рецепторам CD94/NKG2A и CD94/NKG2C, которые нарушают HLA-E-опосредованную регуляцию цитотоксичности NK-клеток. Наличие этих аутоантител коррелирует с активностью заболевания и более тяжелым клиническим течением [19].
Недавние исследования также подтвердили значимость нейтрофилов в патогенезе СКВ. Особый интерес представляют гранулоциты низкой плотности (ГНП), повышенное содержание которых выявлено в периферической крови пациентов с СКВ. Эти клетки обладают способностью продуцировать ИФН-α и спонтанно образовывать нейтрофильные внеклеточные ловушки (neutrophil extracellular traps, NET), содержащие основные аутоантигены – гистоны и ДНК. Аутоантитела к компонентам NET могут нарушать их деградацию, способствовать образованию иммунных комплексов и усиливать продукцию ИФН-α, что связано с активностью заболевания [20, 21].
Кроме того, нетоз может играть роль в развитии сердечно-сосудистых осложнений при СКВ. Потенциальные механизмы включают токсическое воздействие ГНП на эндотелий и окисление липопротеинов высокой плотности, что делает их более атерогенными [22].
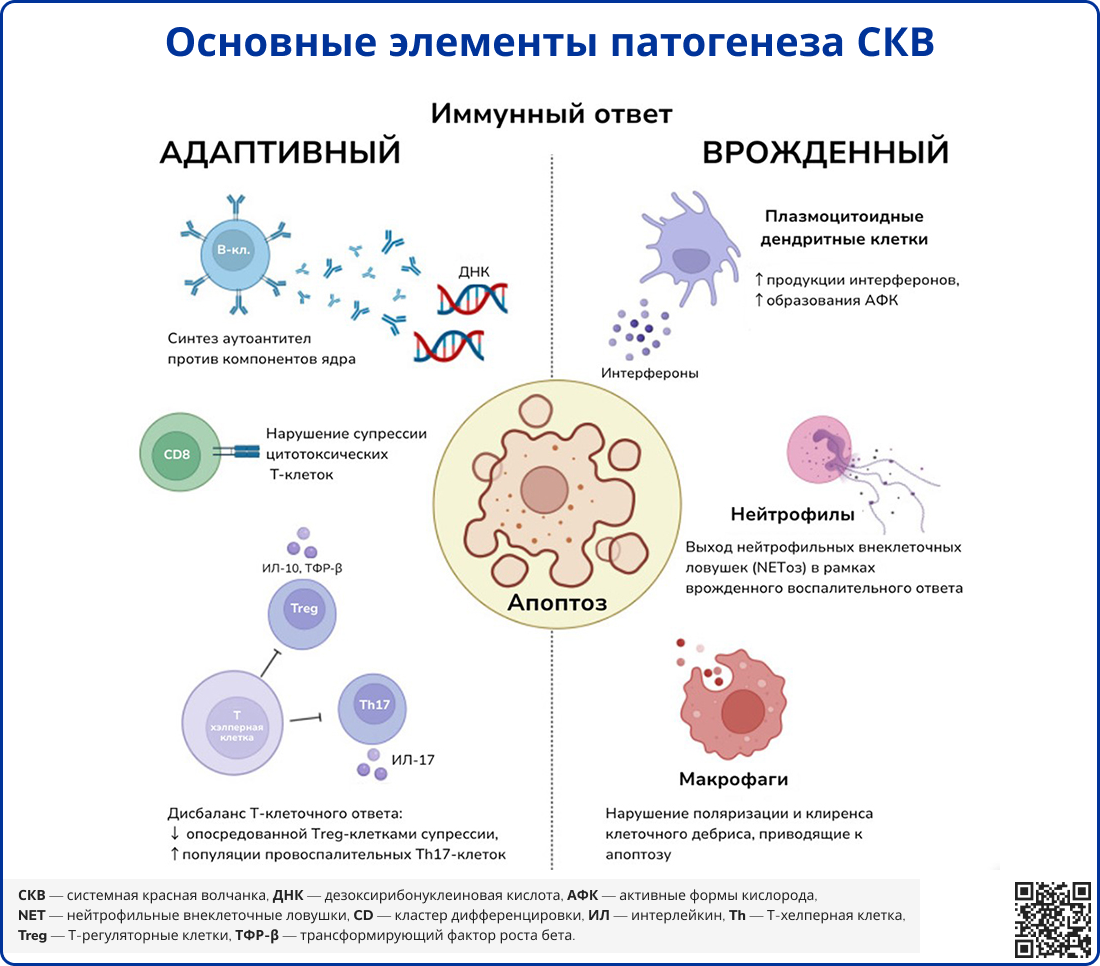
Источник: Robinson G. A., Wilkinson M. G. L., Wincup C. The role of immunometabolism in the pathogenesis of systemic lupus erythematosus //Frontiers in Immunology. – 2022. – Т. 12. – С. 806560.
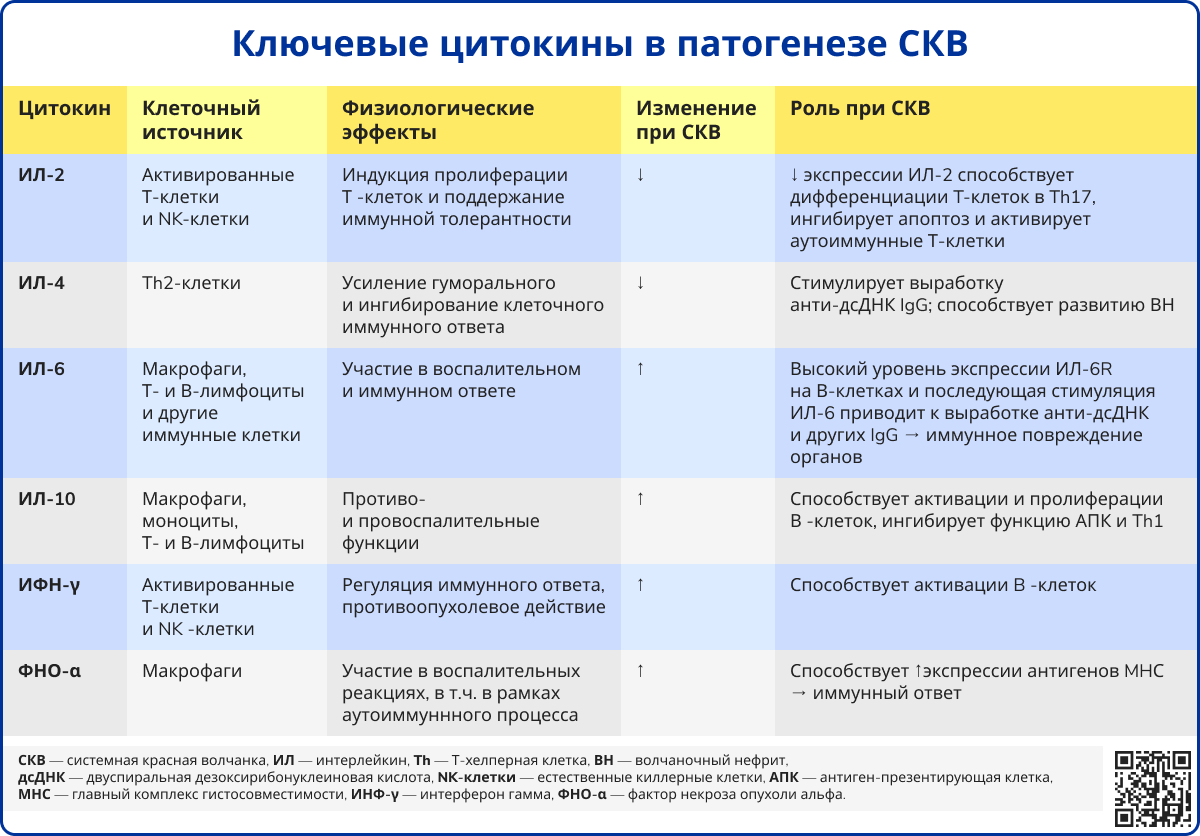
Источник: Pan L. et al. Immunological pathogenesis and treatment of systemic lupus erythematosus //World Journal of Pediatrics. – 2020. – Т. 16. – С. 19-30.
Клиническая картина
Дебют СКВ нередко сопровождается неспецифическими симптомами, такими как:
- лихорадка (обычно неправильного типа),
- нарастающая слабость,
- недомогание,
- снижение аппетита,
- потеря массы тела,
- усиленное выпадение волос.
Ювенильная СКВ по сравнению с СКВ у взрослых отличается острым началом и тяжелым течением, большей частотой рецидивов, что обусловливает более высокие показатели летальности. У детей и подростков чаще развивается полиорганное поражение, тогда как моноорганные варианты дебюта наблюдаются только у 20% [1].
Поражение кожи и слизистых оболочек
Кожные проявления наблюдаются у 80-95% больных. Волчаночная «бабочка» на лице выявляется у 80% детей, в 40% случаев – уже в дебюте заболевания. Эритематозные высыпания нередко возникают на открытых участках тела (область декольте, локти, колени) после эпизода длительной инсоляции. При дальнейшем течении кожные элементы усиливаются весной и летом в результате фотосенсибилизации. Для хронического течения характерны дискоидные очаги с инфильтрацией и рубцовой атрофией. У пациентов могут наблюдаться капиллярит, геморрагические высыпания, сетчатое ливедо, синдром Рейно, а также алопеция, проявляющаяся истончением и выпадением волос, потерей бровей и ресниц.
Более чем у 30% детей диагностируется поражение слизистых оболочек: волчаночная энантема (эритематозные пятна на твердом нёбе), афтозный стоматит и хейлит.
Поражение опорно-двигательного аппарата
Артралгии и артриты отмечаются у большинства пациентов. Острый артрит проявляется симметричным поражением суставов, выраженной болью и периартикулярными изменениями. Подострый артрит имеет волнообразное течение с умеренными экссудативными изменениями и преходящим ограничением функции суставов. Хронический артрит поражает проксимальные межфаланговые суставы пальцев кистей и приводит к их деформации. У 10-15% пациентов развивается асептический некроз головки бедренной кости, сопровождающийся стойкой болью и нарушением функции сустава.
Симптомы со стороны мышц в активном периоде заболевания встречаются у 30-40% пациентов детского возраста, чаще поражаются проксимальные мышцы конечностей. Выявляются миалгии симметричных групп мышц и полимиозит, сопровождающийся болезненностью при пальпации, умеренным повышением активности ферментов мышечного распада и развитием выраженной мышечной слабости.
Поражение серозных оболочек
Плевра, перикард или брюшина вовлекаются в патологический процесс у 30-50% пациентов.
Плеврит чаще сухой, но при высокой активности заболевания может быть экссудативным. Проявляется сухим кашлем, болями в грудной клетке; при аускультации – шумом трения плевры.
Перикардит у детей встречается чаще, чем у взрослых, и зачастую протекает бессимптомно. При эхокардиографии (ЭхоКГ) выявляются утолщение и сепарация листков перикарда. В редких случаях на фоне высокой активности СКВ возможно развитие тампонады сердца.
У ряда пациентов развивается асептический перитонит, который проявляется клиникой острого живота, либо болями в подреберье при локализованном варианте (перигепатит, периспленит).
Поражение дыхательной системы
У 10-30% пациентов диагностируется острый волчаночный пневмонит, сопровождающийся кашлем, одышкой, акроцианозом, хрипами. При рентгенографии выявляют инфильтраты, ателектазы, плевродиафрагмальные спайки. Также возможно развитие хронического интерстициального поражения легких, проявляющегося нарастающей дыхательной недостаточностью, и легочных геморрагий, сопровождающихся острым респираторным дистресс-синдромом и выраженной гипоксемией, что может привести к летальному исходу.
Поражение сердца
Поражение сердца развивается у 52-89% больных, чаще поражаются оболочки сердца и миокард, реже – коронарные сосуды. Миокардит проявляется расширением границ сердца, ослаблением тонов, снижением сократимости миокарда, нарушением ритма и проводимости, признаками сердечной недостаточности. Клинические проявления обычно скудны, выявляются при инструментальном исследовании. Эндокардит встречается реже, характеризуется вальвулитом митрального, реже – аортального или трехстворчатого клапанов, редко приводит к порокам сердца. Бородавчатый эндокардит Либмана-Сакса специфичен для СКВ и сопровождается бородавчатыми наложениями на эндокарде с возможной перфорацией клапанов и разрывом хорд. Коронарит у детей редок, протекает бессимптомно, иногда приводит к развитию аневризм коронарных артерий.
Поражение почек
Поражение почек диагностируется у 70-75% детей, чаще развивается в первые два года болезни, у трети пациентов – уже в дебюте СКВ. Наиболее часто выявляют диффузные пролиферативные изменения в почках (IV класс волчаночного нефрита). Клинические проявления варьируют от умеренной изолированной гематурии или протеинурии до нефротического синдрома, возможны острое повреждение почек и развитие хронической болезни почек (ХБП). Клиническая картина не всегда коррелирует с тяжестью поражения и не предсказывает исход заболевания.

Поражение желудочно-кишечного тракта
Наблюдается у 30-40% детей с СКВ. Проявляется снижением аппетита, тошнотой, болями в животе, иногда диареей. При эндоскопии выявляют эзофагит, гастрит, дуоденит, реже – эрозии и язвы. Поражение кишечника может приводить к геморрагиям, инфарктам, некрозам, кишечным кровотечениям и фибринозно-гнойному перитониту, что существенно ухудшает прогноз. Возможен волчаночный абдоминальный криз. Поражение печени сопровождается гепатомегалией и гепатитом, при антифосфолипидном синдроме (АФС) – инфарктами печени и синдромом Бадда-Киари. У ряда лиц с СКВ может развиваться панкреатит, который может быть как проявлением аутоиммунного процесса, так и следствием применения больших доз глюкокортикостероидов (ГКС).
Поражение нервной системы
Поражение нервной системы диагностируется у 30-50% больных, обусловлено аутоиммунным воспалением и тромботическими или ишемическими повреждениями. Психические расстройства включают острое нарушение сознания, психоз, галлюцинации, шизофреноподобные расстройства, аффективные синдромы, нарушения сна. Органический мозговой синдром проявляется ухудшением когнитивных функций, снижением интеллекта, ухудшением успеваемости, эмоциональной лабильностью, апатией, депрессией. Возможны мигренеподобные головные боли, судорожный синдром, хорея, транзиторные нарушения мозгового кровообращения. Ишемический инсульт у детей встречается реже, чем у взрослых, однако чаще наблюдается при АФС. Поперечный миелит приводит к парапарезу, нарушению чувствительности, тазовым расстройствам, выраженной боли в спине. Встречается поражение черепно-мозговых нервов: глазодвигательного, тройничного, лицевого и зрительного. У ряда пациентов развивается периферическая невропатия, чаще – дистальная сенсорная полинейропатия, возможно развитие множественной мононейропатии. В редких случаях наблюдается синдром Гийена-Барре.
Поражение органа зрения
Поражение органа зрения встречается у 35% больных. Возможны эписклерит, иридоциклит, неврит зрительного нерва, ретиноваскулит (окклюзия сосудов, субретинальный и ретинальный отек, геморрагии), пролиферативная ретинопатия и нарушение зрения.
Сопутствующие состояния
Антифосфолипидный синдром
Антифосфолипидный синдром – аутоиммунное заболевание, сопровождающееся образованием антител к фосфолипидам и приводящее к венозным и артериальным тромбозам, а также осложнениям беременности. АФС может протекать изолированно или в сочетании с СКВ. У детей с первичным АФС в дальнейшем возможно развитие СКВ, а у пациентов с ювенильной формой СКВ – возникновение АФС.
Клинические проявления АФС определяются локализацией тромбозов. Венозные тромбозы включают поражение глубоких вен конечностей, синдром верхней или нижней полой вены, тромбоэмболию легочной артерии. Артериальные тромбозы чаще всего проявляются ишемическим инсультом, транзиторными ишемическими атаками, инфарктами миокарда, а также ишемией почек, печени, селезенки, легких и сетчатки.
Помимо тромботических осложнений, АФС может сопровождаться неврологическими (мигрень, эпилепсия, когнитивные нарушения), гематологическими (тромбоцитопения, гемолитическая анемия), дерматологическими (сетчатое ливедо, синдром Рейно), костно-мышечными (остеонекроз, артрит), кардиальными (поражение клапанов), легочными (гипертензия, интерстициальные изменения) и почечными (интраренальная васкулопатия, артериальная гипертензия) проявлениями.
Диагноз АФС устанавливают согласно Сиднейским критериям (2006 г.), включающим клинические и лабораторные параметры. Терапия направлена на предотвращение тромбообразования и включает применение антикоагулянтов, ГКС и иммунодепрессантов в зависимости от тяжести заболевания.
Гемофагоцитарный синдром
Гемофагоцитарный синдром (ГФС) – редкое, но тяжелое осложнение СКВ, характеризующееся неконтролируемым воспалением и гиперцитокинемией при неэффективном иммунном ответе. Чаще всего ГФС развивается в ответ на инфекционные агенты, включая вирус Эпштейна-Барр, цитомегаловирус и герпесвирусы. Он также может быть спровоцирован некоторыми лекарственными препаратами (НПВП, сульфасалазином и др.).
Патогенез ГФС связан с чрезмерной активацией фагоцитирующих мононуклеаров и Т-лимфоцитов, что приводит к цитопении, системному воспалению и поражению печени и селезенки. В норме эти клетки участвуют в элиминации опухолевых и инфицированных клеток, токсинов и иммунных комплексов, однако при ГФС их активация становится избыточной и приводит к повреждению тканей.
Диагностика ГФС затруднена, так как его клинические и лабораторные проявления могут напоминать обострение СКВ или инфекционный процесс. Без своевременной диагностики и лечения ГФС может привести к полиорганной недостаточности и летальному исходу.
Критерии вторичного ГФС включают [23]:
- Обязательные критерии:
- лихорадка ≥ 38,5°С,
- уровень ферритина в сыворотке крови ≥ 684 нг/мл.
- Дополнительные критерии:
- число тромбоцитов в крови < 181 тыс/мкл,
- активность АСТ в сыворотке крови > 48 Ед/л,
- уровень триглицеридов в сыворотке крови > 156 мг/дл,
- уровень фибриногена в крови < 360 мг/дл.
Диагноз вГФС устанавливается при наличии двух обязательных и как минимум двух дополнительных критериев.
Диагностика
Сбор анамнеза и физикальное обследование
При подозрении на СКВ важно изучить акушерско-гинекологический анамнез матери:
- хроническое невынашивание беременности,
- преждевременные роды и другие признаки АФС,
- наличие урогенитальных инфекций (хламидии, микоплазма, вирус Эпштейна-Барр и др.), которые могли быть потенциальными триггерами СКВ у ребенка.
При сборе анамнеза жизни оценивают наличие аллергических реакций, реакций на прививки, контакта с животными, фотодерматита, аутоиммунных заболеваний (тиреоидита, аутоиммунного гепатита, гломерулонефрита и др.), хронического артрита, эпилепсии, алопеции. Анализ наследственного анамнеза необходим для выявления семейной предрасположенности к аутоиммунным заболеваниям.
Выясняют характер дебюта болезни (острый, подострый) и вероятные триггеры (инфекции, стресс, переохлаждение, травмы). Проводят физикальное обследование: измеряют температуру, осматривают кожу (высыпания, признаки васкулита), слизистые оболочки (энантема, афты), суставы (артрит, ограничение движений), оценивают состояние сердца, лёгких и органов ЖКТ [1].
Лабораторные исследования
Лабораторная диагностика СКВ включает развернутый общий анализ крови, в котором могут выявляться лейкопения с лимфопенией, анемия, тромбоцитопения и повышение СОЭ. Биохимический анализ крови позволяет оценить активность заболевания: повышение уровня КФК, ЛДГ, АЛТ и АСТ может указывать на развитие миопатического синдрома, а увеличение концентрации ферритина и триглицеридов – о вторичном гемофагоцитарном синдроме (вГФС) или токсическом воздействии лекарственных препаратов. Уровень С-реактивного белка при СКВ обычно не повышен, его увеличение может указывать на бактериальные осложнения или АФС.
Серологическая диагностика включает выявление антинуклеарных антител, антител к двуспиральной ДНК, Sm-антигену, Ro- и La-антигенам, U1РНП, Scl-70 и фосфолипидам. Антитела к двуспиральной ДНК выявляются у 40-70% пациентов и коррелируют с активностью волчаночного нефрита. Антитела к Sm-антигену специфичны для СКВ, но встречаются у 10-30% больных. Антитела к Ro- и La-антигенам ассоциированы с фотосенсибилизацией и гематологическими нарушениями, могут предсказывать развитие неонатальной волчанки. Антитела к фосфолипидам выявляются у 50-60% детей с СКВ и являются маркерами сопутствующего АФС.
Исследование системы комплемента (С3, С4 фракции) помогает определить активность заболевания, их снижение обычно также наблюдается при ВН. Оценка системы гемостаза проводится с помощью тромбоэластографии и определения уровня гепарина в крови. Для СКВ характерны нарушения коагуляции с риском как гиперкоагуляции, так и кровотечений.
При подозрении на аутоиммунный тиреоидит определяют антитела к тиреоглобулину и тиреопероксидазе, а также уровни тироксина (Т4) и трийодтиронина (Т3).
Общий анализ мочи и исследование суточной протеинурии помогают выявить поражение почек. Протеинурия, гематурия, лейкоцитурия и цилиндрурия могут свидетельствовать о развитии ВН. В качестве критерия ВН используют определение протеин/креатининового соотношения, а определение альбумин/креатининового соотношения проводят для оценки прогноза у лиц с ХБП.
Инструментальные методы обследования
Инструментальная диагностика направлена на выявление поражения внутренних органов при системной красной волчанке.
Ультразвуковое исследование позволяет оценить состояние почек, печени, селезенки и лимфатических узлов, выявить их увеличение и изменения структуры. При наличии суставного синдрома проводят ультразвуковое исследование суставов: оценивают наличие выпота, утолщение синовиальной оболочки и повреждение хряща. Эхокардиография (ЭхоКГ) необходима для диагностики миокардита, перикардита и поражения клапанов сердца. Электрокардиограмма помогает выявить признаки перегрузки отделов сердца и ишемии миокарда.
У пациентов с лихорадкой и/или симптомами со стороны ЖКТ для дифференциальной диагностики с воспалительными заболеваниями кишечника и другими желудочно-кишечными патологиями используют эзофагогастродуоденоскопию (ЭГДС) и колоноскопию с последующим морфологическим исследованием биоптатов.
Компьютерная томография (КТ) органов грудной клетки позволяет выявить поражение легких и исключить другие заболевания, такие как туберкулез и онкопатология. Магнитно-резонансная томография (МРТ) применяется при миопатическом синдроме для диагностики воспалительных миопатий.
В зависимости от симптомов пациента проводят расширенное обследование соответствующих органов и систем (УЗИ, КТ, МРТ, специфичные функциональные исследования). При обнаружении признаков органного поражения показана консультация с профильным специалистом (оториноларинголог, кардиолог, офтальмолог, психиатр и др.).
Критерии диагноза
Для установления диагноза СКВ наиболее широко используются критерии Американской коллегии ревматологии и классификационные критерии SLICC 2012 года – в обеих системах оцениваются характер и степень поражения отдельных органов и систем, выраженность воспалительного процесса и специфические признаки аутоиммунных реакций (наличие аутоантител) [1].
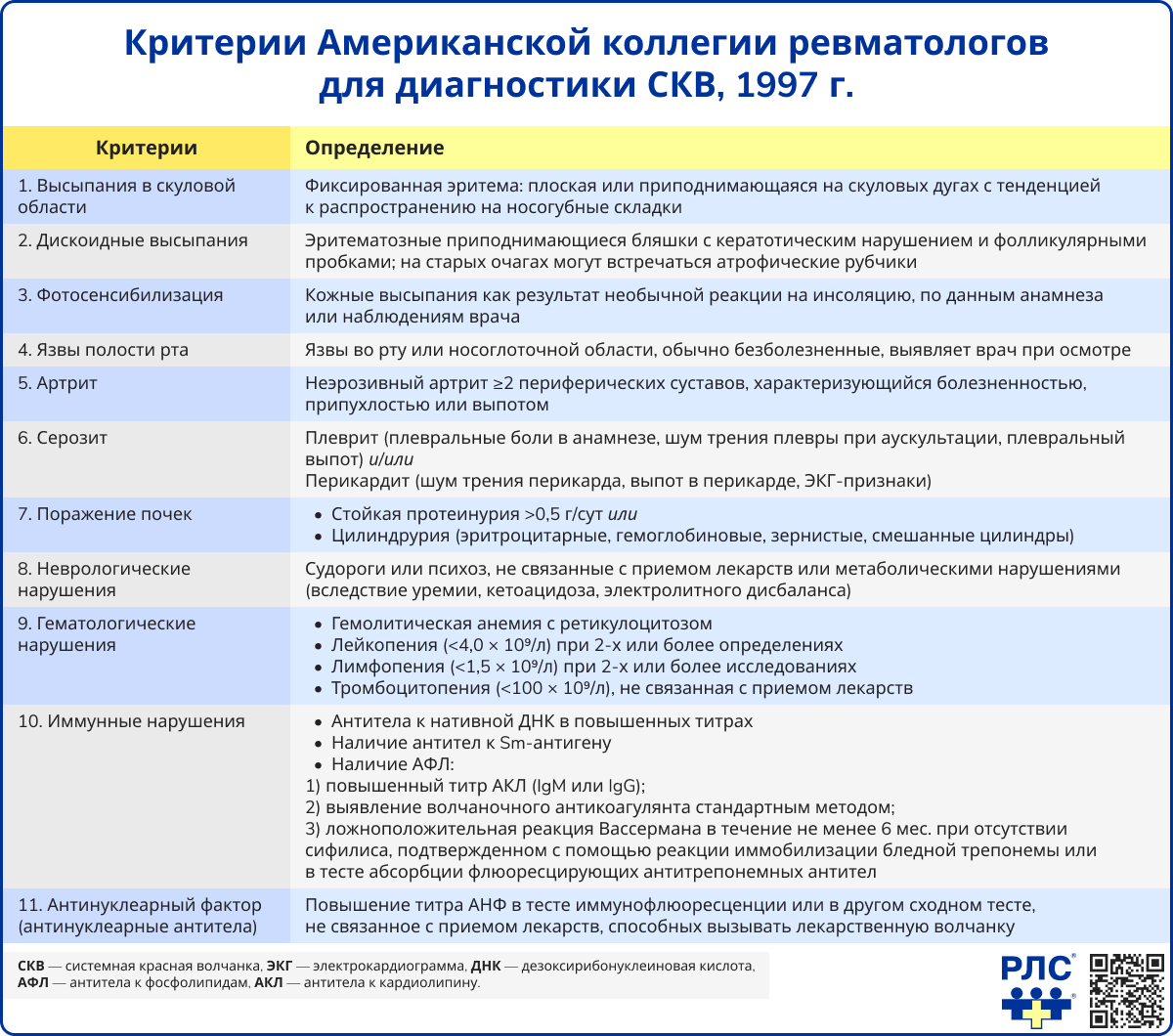
Дифференциальная диагностика
Важно исключить заболевания с похожей симптоматикой перед назначением противоревматической терапии [1]:
- Онкологические: нейробластома, гемобластозы.
- Аутоиммунные: ювенильный артрит, дерматополимиозит, болезнь Кавасаки, саркоидоз, системный склероз.
- Инфекционные: туберкулёз, бактериальный эндокардит, токсоплазмоз, боррелиоз, цитомегаловирус, вирус Эпштейна-Барр.
- Гематологические: гемолитическая анемия, тромбоцитопеническая пурпура.
- Почечные: гломерулонефрит.
- Неврологические: эпилепсия, энцефалит, полинейропатия.
- Лекарственная волчанка, токсико-аллергические реакции.
Лечение
Общие рекомендации
Ультрафиолетовое (УФ) излучение может вызывать обострение СКВ [24]. Прямого или отраженного солнечного света рекомендуется избегать, а также учитывать возможное воздействие флуоресцентного и светодиодного освещения. Рекомендуется использование солнцезащитных средств с SPF ≥55, защищающих от УФ-A и УФ-B. Также возможно развитие фотосенсибилизации при приеме некоторых препаратов: в этих случаях необходимо корректировать их дозировку или заменять альтернативными средствами.
Специальные жесткие ограничения в питании для пациентов с СКВ не установлены, но рекомендуется сбалансированное питание с достаточным количеством углеводов, белков и жиров. У большинства пациентов наблюдается дефицит витамина D, поэтому его уровень следует контролировать и при необходимости проводить коррекцию с назначением холекальциферола [25]. Больным с гипертонией или нефритом может потребоваться ограничение соли.
Малоподвижность при обострении заболевания может привести к потере мышечной массы, развитию остеопороза и усилению усталости. Регулярные физические нагрузки, такие как изометрические упражнения и дозированная активность, помогают поддерживать общее состояние здоровья [26].
Курение способствует повышению активности СКВ, ускоряет развитие атеросклероза и снижает эффективность гидроксихлорохина, поэтому пациентам рекомендуется полный отказ от никотина [27, 28].
Медикаментозная терапия
Выбор терапии при системной красной волчанке зависит от выраженности симптомов, поражения органов, эффективности предыдущего лечения и активности заболевания. Учитываются побочные эффекты препаратов, предпочтения пациента и вопросы планирования семьи.
Нестероидные противовоспалительные препараты (НПВП) применяются для купирования болевого синдрома, суставных проявлений и лихорадки. Глюкокортикостероиды (ГКС) необходимы для быстрого подавления воспаления и модуляции иммунного ответа. В тяжелых случаях проводится пульс-терапия метилпреднизолоном в дозе 10-30 мг/кг внутривенно в течение 3-5 дней, после чего назначают поддерживающие дозы с постепенным снижением. Гидроксихлорохин назначается всем пациентам с СКВ, так как обладает иммуносупрессивным и антитромботическим эффектами [29].
Иммуносупрессивные препараты используются при активном течении болезни, особенно при поражении почек, ЦНС и других жизненно важных органов. Метотрексат применяется у пациентов с нетяжелым течением СКВ, без поражения почек, но с резистентным кожно-суставным синдромом. Микофенолата мофетил (ММФ) и азатиоприн назначаются для индукции ремиссии и поддерживающей терапии, особенно при волчаночном нефрите. Циклофосфамид используется при тяжелых формах заболевания, включая поражение почек, легких и ЦНС, с последующим переходом на поддерживающую терапию микофенолатом мофетилом или азатиоприном. При непереносимости или недостаточной эффективности других иммуносупрессантов может быть назначен циклоспорин.
Генно-инженерные биологические препараты применяются как в сочетании с иммунодепрессантами, так и в качестве самостоятельной терапии. Белимумаб, анти-BLyS моноклональные антитела (МАТ), является препаратом первой линии для индукции ремиссии [1]. Ритуксимаб, анти-CD20 МАТ, используется при тяжелых формах СКВ, включая поражение почек и центральной нервной системы, и рефрактерности к стандартной терапии ГКС и иммунодепрессантами. Анифролумаб, МАТ против рецепторов ИФН I типа, показан пациентам со среднетяжелым и тяжелым течением заболевания, преимущественно с кожно-суставными проявлениями. Тофацитиниб, селективный ингибитор Янус-киназ, назначается при выраженном суставном синдроме и поражении кожи.
Дополнительно при СКВ могут применяться антитромботические препараты, включая гепарин, ингибиторы фактора Xa и антиагреганты, особенно при активном васкулите, гиперкоагуляции и антифосфолипидном синдроме. Простагландины, такие как алпростадил, используются для улучшения микроциркуляции при синдроме Рейно, гангренах и поражении нервной системы. В тяжелых случаях, сопровождающихся резистентной тромбоцитопенией, кожно-слизистыми поражениями и крайне тяжелым АФС, возможно кратковременное назначение внутривенного иммуноглобулина в качестве вспомогательной терапии.
Лечение волчаночного нефрита определяется его морфологическим классом. При I-II классах назначаются низкие дозы ГКС с возможным добавлением ММФ или циклофосфамида при отсутствии эффекта. При III-IV классах препаратами первой линии являются ММФ и азатиоприн, при рефрактерности могут применяться ритуксимаб или белимумаб. У пациентов с ВН V класса применяют ММФ в сочетании с глюкокортикостероидами, а при отсутствии эффекта могут быть назначены циклофосфамид или ингибиторы кальциневрина, такие как циклоспорин или такролимус, однако их нефротоксичность требует осторожности в назначении [1, 29].
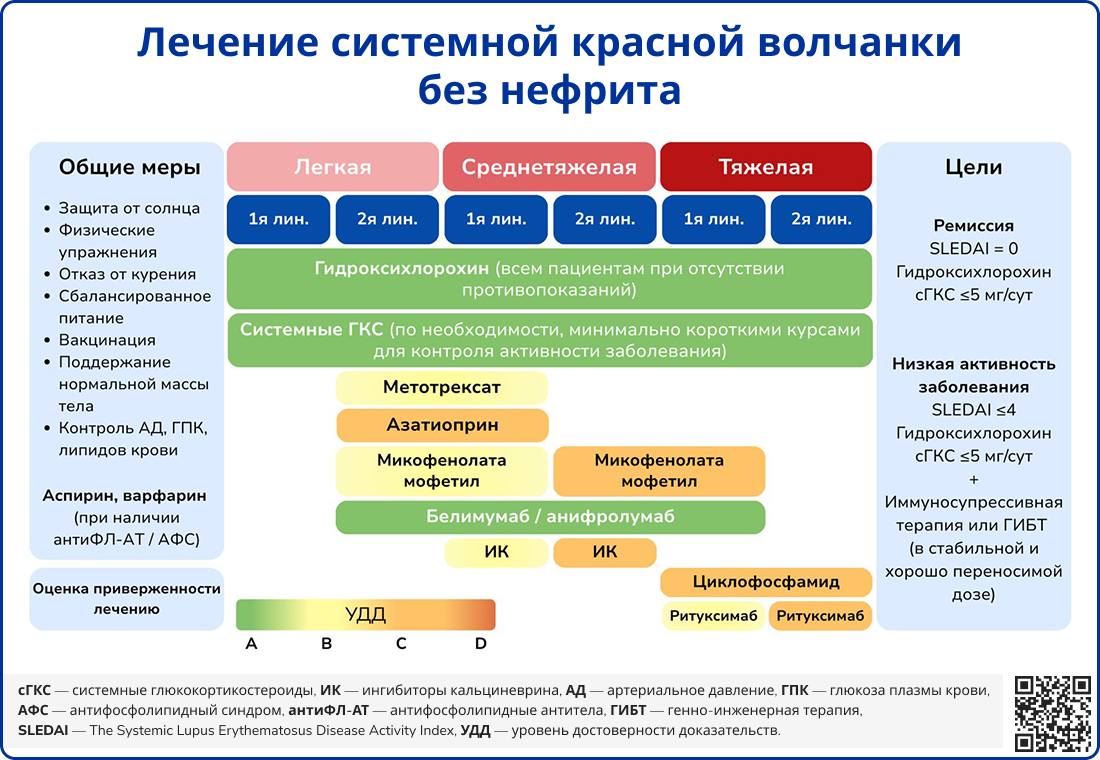
Источник: Fanouriakis A. et al. EULAR recommendations for the management of systemic lupus erythematosus: 2023 update //Annals of the rheumatic diseases. – 2024. – Т. 83. – №. 1. – С. 15-29.
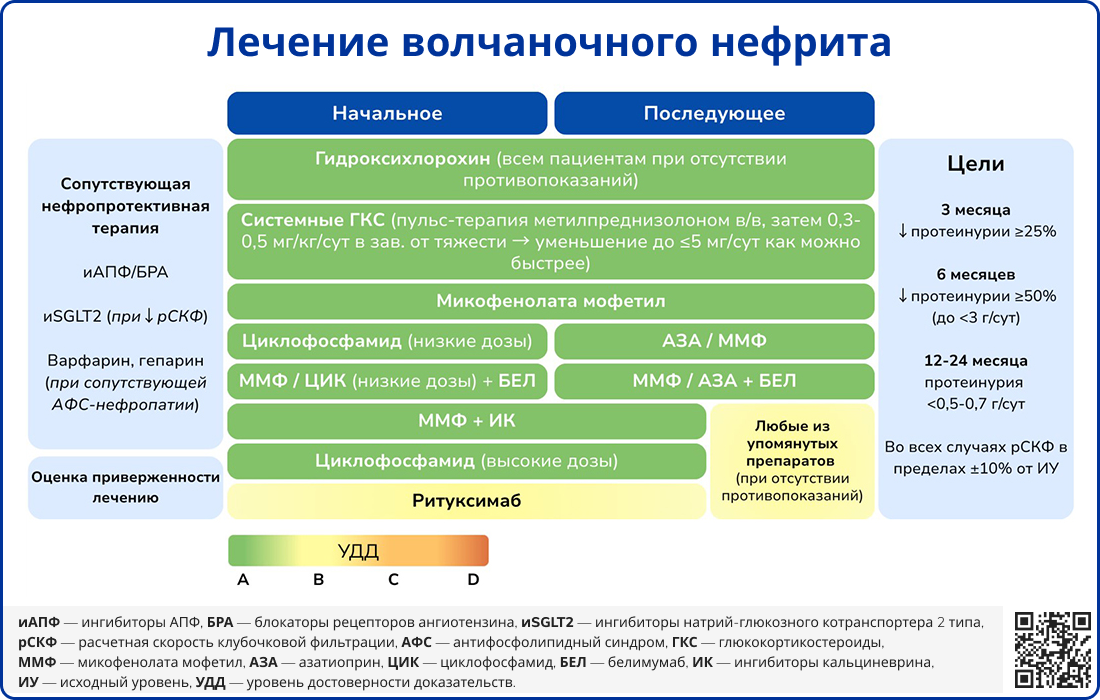
Источник: Fanouriakis A. et al. EULAR recommendations for the management of systemic lupus erythematosus: 2023 update //Annals of the rheumatic diseases. – 2024. – Т. 83. – №. 1. – С. 15-29.
Список литературы
- Клинические рекомендации Ассоциации детских ревматологов "Системная красная волчанка", М.: 2024
- Hughes G. C., Choubey D. Modulation of autoimmune rheumatic diseases by oestrogen and progesterone //Nature Reviews Rheumatology. – 2014. – Т. 10. – №. 12. – С. 740-751.
- Krasselt M., Baerwald C. Sex, symptom severity, and quality of life in rheumatology //Clinical reviews in allergy & immunology. – 2019. – Т. 56. – С. 346-361.
- Lehmann P. et al. Experimental reproduction of skin lesions in lupus erythematosus by UVA and UVB radiation //Journal of the American Academy of Dermatology. – 1990. – Т. 22. – №. 2. – С. 181-187.
- Gergianaki I., Bortoluzzi A., Bertsias G. Update on the epidemiology, risk factors, and disease outcomes of systemic lupus erythematosus //Best Practice & Research Clinical Rheumatology. – 2018. – Т. 32. – №. 2. – С. 188-205.
- Chen L., Morris D. L., Vyse T. J. Genetic advances in systemic lupus erythematosus: an update //Current opinion in rheumatology. – 2017. – Т. 29. – №. 5. – С. 423-433.
- Demirkaya E. et al. New horizons in the genetic etiology of systemic lupus erythematosus and lupus-like disease: monogenic lupus and beyond //Journal of clinical medicine. – 2020. – Т. 9. – №. 3. – С. 712.
- Berghe T. V. et al. Regulated necrosis: the expanding network of non-apoptotic cell death pathways //Nature reviews Molecular cell biology. – 2014. – Т. 15. – №. 2. – С. 135-147.
- Magna M., Pisetsky D. S. The role of cell death in the pathogenesis of SLE: is pyroptosis the missing link? //Scandinavian journal of immunology. – 2015. – Т. 82. – №. 3. – С. 218-224.
- Ytterberg S. R., Schnitzer T. J. Serum interferon levels in patients with systemic lupus erythematosus //Arthritis & Rheumatism: Official Journal of the American College of Rheumatology. – 1982. – Т. 25. – №. 4. – С. 401-406.
- Rönnblom L. E., Alm G. V., Öberg K. E. Possible induction of systemic lupus erythematosus by interferon‐α treatment in a patient with a malignant carcinoid tumour //Journal of internal medicine. – 1990. – Т. 227. – №. 3. – С. 207-210.
- Eloranta M. L., Alm G. V., Rönnblom L. Disease mechanisms in rheumatology—tools and pathways: plasmacytoid dendritic cells and their role in autoimmune rheumatic diseases //Arthritis & Rheumatism. – 2013. – Т. 65. – №. 4. – С. 853-863.
- Henault J. et al. Self-reactive IgE exacerbates interferon responses associated with autoimmunity //Nature immunology. – 2016. – Т. 17. – №. 2. – С. 196-203.
- Kaplan M. J., Salmon J. E. How does IFN-α insult the vasculature? let me count the ways //Arthritis and rheumatism. – 2011. – Т. 63. – №. 2. – С. 334.
- Lood C. et al. Platelet transcriptional profile and protein expression in patients with systemic lupus erythematosus: up-regulation of the type I interferon system is strongly associated with vascular disease //Blood, The Journal of the American Society of Hematology. – 2010. – Т. 116. – №. 11. – С. 1951-1957.
- López P. et al. A pathogenic IFNα, BLyS and IL-17 axis in Systemic Lupus Erythematosus patients //Scientific reports. – 2016. – Т. 6. – №. 1. – С. 20651.
- Olin A. I. et al. Pathogenic mechanisms in lupus nephritis: nucleosomes bind aberrant laminin β1 with high affinity and colocalize in the electron‐dense deposits //Arthritis & Rheumatology. – 2014. – Т. 66. – №. 2. – С. 397-406.
- Chang E. H. et al. Selective impairment of spatial cognition caused by autoantibodies to the N-methyl-D-aspartate receptor //EBioMedicine. – 2015. – Т. 2. – №. 7. – С. 755-764.
- Hagberg N. et al. Functional anti‐CD94/NKG2A and anti‐CD94/NKG2C autoantibodies in patients with systemic lupus erythematosus //Arthritis & Rheumatology. – 2015. – Т. 67. – №. 4. – С. 1000-1011.
- Denny M. F. et al. A distinct subset of proinflammatory neutrophils isolated from patients with systemic lupus erythematosus induces vascular damage and synthesizes type I IFNs //The journal of immunology. – 2010. – Т. 184. – №. 6. – С. 3284-3297.
- Leffler J. et al. A subset of patients with systemic lupus erythematosus fails to degrade DNA from multiple clinically relevant sources //Arthritis Research & Therapy. – 2015. – Т. 17. – С. 1-10.
- Smith C. K. et al. Neutrophil extracellular trap–derived enzymes oxidize high‐density lipoprotein: an additional proatherogenic mechanism in systemic lupus erythematosus //Arthritis & rheumatology. – 2014. – Т. 66. – №. 9. – С. 2532-2544.
- Ravelli A. et al. 2016 classification criteria for macrophage activation syndrome complicating systemic juvenile idiopathic arthritis: a European League Against Rheumatism/American College of Rheumatology/Paediatric Rheumatology International Trials Organisation collaborative initiative //Annals of the Rheumatic Diseases. – 2016. – Т. 75. – №. 3. – С. 481-489.
- Lehmann P., Homey B. Clinic and pathophysiology of photosensitivity in lupus erythematosus //Autoimmunity reviews. – 2009. – Т. 8. – №. 6. – С. 456-461.
- Toloza S. M. A. et al. Vitamin D insufficiency in a large female SLE cohort //Lupus. – 2010. – Т. 19. – №. 1. – С. 13-19.
- Tench C. M. et al. Fatigue in systemic lupus erythematosus: a randomized controlled trial of exercise //Rheumatology. – 2003. – Т. 42. – №. 9. – С. 1050-1054.
- Ghaussy N. O. et al. Cigarette smoking and disease activity in systemic lupus erythematosus //The Journal of rheumatology. – 2003. – Т. 30. – №. 6. – С. 1215-1221.
- Urowitz M. B., Ibañez D., Gladman D. D. Atherosclerotic vascular events in a single large lupus cohort: prevalence and risk factors //The Journal of rheumatology. – 2007. – Т. 34. – №. 1. – С. 70-75.
- Fanouriakis A. et al. EULAR recommendations for the management of systemic lupus erythematosus: 2023 update //Annals of the rheumatic diseases. – 2024. – Т. 83. – №. 1. – С. 15-29.
Описание проверено экспертом
Статьи по теме Иммунология
- Аллергический ринит
- Пищевая аллергия
- Гиперчувствительный пневмонит
- Наследственный ангиоотек
- Крапивница
- Бронхиальная астма
- Атопический дерматит
- Анафилаксия
- Мастоцитоз
- Эозинофильный эзофагит
- Узловатая почесуха
Статьи по теме Ревматология
Болезни в статье:
- E66 Ожирение
- E55 Недостаточность витамина D
- I70 Атеросклероз
- N18 Хроническая почечная недостаточность
- I63 Инфаркт мозга
- G61.0 Синдром Гийена-Барре
- G45.9 Транзиторная церебральная ишемическая атака неуточненная
- I21 Острый инфаркт миокарда
- I73.0 Синдром Рейно
- E06.3 Аутоиммунный тиреоидит
- G40 Эпилепсия
- A15-A19 Туберкулез
- C71 Злокачественное новообразование головного мозга
- C81-C96 Злокачественные новообразования лимфоидной, кроветворной и родственных им тканей
- M08 Юношеский [ювенильный] артрит
- M33 Дерматополимиозит
- M30.3 Слизисто-кожный лимфонодулярный синдром [Кавасаки]
- D86 Саркоидоз
- M34 Системный склероз
- I33.0 Острый и подострый инфекционный эндокардит
- B58 Токсоплазмоз
- A69.2 Болезнь Лайма
- D55-D59 Гемолитические анемии
- D69.3 Идиопатическая тромбоцитопеническая пурпура
- N05 Нефритический синдром неуточненный
- M32.0 Лекарственная системная красная волчанка
Фармгруппы в статье:
- Глюкокортикостероиды
- Ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
- Иммунодепрессанты
- Антиагреганты
- Простагландины, тромбоксаны, лейкотриены, их аналоги и антагонисты
Оцените статью:
- Волчанка красная диссеминированная
- Диссеминированная красная волчанка
- Хроническая красная волчанка
Редкий дебют системной красной волчанки – острый панкреатит: описание случая
В статье рассмотрен клинический случай системной красной волчанки с дебютом в виде острого панкреатита.
Опубликовано на сайте: 06.12.23 | Обновлено на сайте: 12.01.24
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
системная красная волчанка
Системная красная волчанка, тяжелое активное волчаночное поражение ЦНС, при применении для снижения активности СКВ - детский возраст до 5 лет, системной красной волчанкои, системной красной волчанке, системная красная волчанка (скв), СКВ, системной красной волчанкой, системную красную волчанку, эритематозная волчанка, красная волчанка, системной красной волчанке (СКВ), красная системная волчанка, скв (системная красная волчанка),


