- Эпидемиология
- Этиология
- Клиническая и морфологическая классификации РПЖ
- Простатическая интраэпителиальная неоплазия
- Морфология
- Классификация РПЖ по TNM (2002 г.)
- Клиническая картина РПЖ
- Диагностика рака предстательной железы
- Пальцевое исследование прямой кишки
- Определение уровня простатаспецифического антигена (ПСА)
- Ультразвуковое исследование
- Биопсия предстательной железы
- Рентгеновская компьютерная томография
- Магнитно-резонансная томография
- Позитронная эмиссионная томография
- Экскреторная урография
- Цистоскопия
- Сцинтиграфия костей
- Скрининг рака предстательной железы
C61 Злокачественное новообразование предстательной железы, МКБ-10
Отредактировано: 02.04.2024
д.м.н., проф. Матвеев Б.П.
ГУ РОНЦ им. Н.Н. Блохина РАМН
Эпидемиология, этиология, клиническая и морфологическая классификации. Клиническая картина. Диагностика. Хирургическое лечение, лучевая и химиотерапия рака предстательной желез
Эпидемиология
Рак предстательной железы (РПЖ) — злокачественная опухоль, которой с каждым годом уделяется все больше внимания. Это обусловлено тем, что быстрыми темпами увеличивается заболеваемость, особенно у мужчин пожилого возраста.
Ежегодно в мире выявляется до 396 тыс. случаев РПЖ, что в структуре онкологической заболеваемости мужчин составляет 9,2% (14,3% в развитых странах и 4,3% — в развивающихся). Наиболее высокие показатели заболеваемости регистрируются у мужчин старше 65 лет — 81% случаев. Средний возраст заболевших составляет 70 лет, умерших — 71 год. В структуре онкологических заболеваний в ряде стран РПЖ выходит на 2–3 место после рака легких и желудка, а в США — на первое место. В экономически развитых странах увеличивается продолжительность жизни, и имеется общемировая тенденция к старению населения, при этом отмечается и рост заболеваемости.
Вместе с тем смертность от РПЖ среди прочих онкологических заболеваний занимает второе место после рака легкого.
Заболеваемость РПЖ в странах Азии и Африки в 100 раз ниже, чем в США. Например, в Китае на 100 тыс. населения приходится только один больной. Примерно такие же показатели в Японии (6,6 на 100 тыс. населения), Алжире (2,0) и т.д. Однако заболеваемость этнических китайцев и японцев, проживающих в США, значительно возрастает.
Несмотря на большую разницу в выявлении клинических форм РПЖ в различных странах мира, частота латентно протекающего рака практически одинакова во всех регионах. На это указывают результаты вскрытий, проведенных в разных странах. Латентный рак встретился на вскрытии у 10–15% мужчин, умерших от различных причин (не от РПЖ). У мужчин 75 лет и старше частота латентного рака выше — 30–35%.
Также следует отметить, что заболеваемость РПЖ имеет значительные географические и этнические различия.
О заболеваемости РПЖ в России можно говорить, начиная с 1989 г., когда в отчетных формах онкологических диспансеров была отдельно выделена эта нозология. Доля РПЖ в структуре онкологической заболеваемости мужского населения России неуклонно возрастала и в 2000 г. составила 5,4% по сравнению с 2,8% в 1989 г. Абсолютное число вновь выявленных случаев достигло 11,6 тыс. За 1989–2000 гг. число впервые диагностированных заболеваний увеличилось в два раза — с 5,5 тыс. до 11,6 тыс. Средний возраст больных РПЖ в России — 69 лет, а умерших — 70 лет; в США — 72 и 77 лет соответственно. Стандартизованный показатель заболеваемости в России в 2000 г. составил 13,6 на 100 тыс. мужского населения (рис. 1).
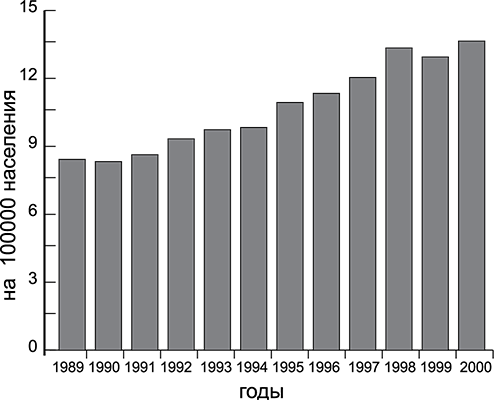
Рисунок 1. Динамика заболеваемости РПЖ в России
В 30% случаев приходится на I и II стадии. По-видимому, это больные, у которых диагноз был случайно установлен после операции по поводу доброкачественной гиперплазии предстательной железы.
Этиология
Этиология РПЖ до конца не изучена. Предстательная железа имеет достаточно сложную нейроэндокринную регуляцию и находится под гормональным влиянием яичек, коры надпочечников и аденогипофиза; в свою очередь, синтез и секреция гормонов этих органов осуществляются под контролем гипоталамуса и аутокринных-паракринных факторов, регулирующих процессы роста, деления и дифференцировки клеток предстательной железы.
В настоящее время сформировано представление о молекулярных механизмах возникновения и развития РПЖ. Предстательная железа, развивающаяся с 12 нед внутриутробной жизни плода, остается рудиментарной вплоть до полового созревания, “просыпаясь” под действием возросшего уровня андрогенов (тестостерон, андрогены надпочечников).
Тестостерон — гормон, который синтезируется клетками Лейдига яичек под влиянием ЛГ. Экскреция ЛГ регулируется посредством ЛГ-рилизинг-гормона (ЛГРГ) гипоталамуса. Посредством отрицательной обратной связи осуществляется и поддерживается на нормальном уровне регуляция концентрации тестостерона в плазме крови (10–35 мкг/л). Колебание уровня содержания тестостерона крови в пределах этих значений в течение суток является нормальным явлением. 95% циркулирующего тестостерона связано с белками, основным из которых является глобулин (SHBG — sex hormone binding globulin). Оставшиеся 5% свободного тестостерона проникают в клетки путем обычной диффузии.
Еще одним источником андрогенов является кора надпочечников. Под влиянием АКТГ из коры надпочечников высвобождаются андростен и андростендион. В пределах предстательной железы тестостерон и андрогены надпочечников достаточно быстро метаболизируются 5-альфа-редуктазой (фермент, преимущественно располагающийся на ядерной мембране) до дегидротестостерона (ДГТ). Этот гормон является в 3–5 раз более сильным андрогеном, чем оригинальный тестостерон. Андрогенная активность ДГТ наступает, главным образом, в ядре клетки при его взаимодействии с андрогенным рецептором, локализующемся, как правило, на ядерной мембране. Ассоциация ДГТ + андрогенный рецептор высвобождает HSP90 (heat-shock белок) и позволяет ДНК-связанной части рецептора димеризоваться и вступить во взаимодействие со специфической последовательностью, т.н. “гормон-ответным элементом” (hormone response element, HRE) генов-мишеней генома.
Нормальный рост и развитие предстательной железы регулируется посредством тонкого баланса гомеостаза между клеточным ростом и клеточной смертью. Так как андрогены являются абсолютно необходимым звеном данного процесса саморегуляции, то выполнение медикаментозной или хирургической кастрации быстро активизирует эпителиальный апоптоз и стромальную гипоплазию. В течение 10 дней после начала лечения уровень ДНК в лишенных андрогенной стимуляции клетках предстательной железы снижается до 10%.
Эпителиальные клетки простаты делятся регулярно для обеспечения структурной целостности гранулярной и эпителиальной протоковой поверхностей. Наиболее активно делятся клетки дистальной части желез простаты. Дифференцированные клетки интермедиального слоя активно функционируют, клетки же проксимального, наиболее близкого к уретре слоя, находятся, как правило, в состоянии апоптоза. Активный процесс апоптоза, уравновешивающий процесс активной пролиферации клеток, происходит и при элиминации андрогенов. Определены два гена, являющиеся, по-видимому, ключевыми для данного процесса — BAX и BCL–2. Принципиальной морфологической характеристикой апоптоза является конденсация, уплотнение хроматина, вызванная выработкой 180–200 парных базовых фрагментов ДНК, что является результатом действия эндонуклеаз. Синергизм ингибиторов фосфатазы и ФНО активизирует фрагментацию ДНК во “встроенном” процессе клеточного “самоубийства”.
Потенциальными стимуляторами роста клеток предстательной железы являются и некоторые полипептиды, такие как эпидермальный фактор роста (EGF), основной фактор роста фибробластов (bFGF) и др. Рецепторы этих полипептидов расположены на поверхности и эпителиальных, и стромальных клеток.
Вероятная цепочка развития РПЖ выглядит с современных позиций следующим образом. Инвазивный РПЖ развивается, когда в клетке происходит мутация или серия мутаций, дающие ей преимущества в скорости роста по сравнению с остальными. Деление мутированной материнской клетки обеспечивает перенос измененной генетической информации к дочерним клеткам, в т.ч. и способность к более быстрому росту. Дальнейшие циклы дифференциации мутированных клеток сопровождаются дополнительными мутациями. Измененная клетка приобретает способность инфильтрировать близлежащие ткани, а также метастазировать.
Одним из примеров антионкогенов, играющих определенную роль в этиологии РПЖ, является белок р53, отсутствие которого приводит к драматическому увеличению частоты появления различных форм рака. По данным литературы, у больных РПЖ отсутствие р53 отмечено в 6–20% случаев.
Клиническая и морфологическая классификации РПЖ
Простатическая интраэпителиальная неоплазия
Простатическую интраэпителиальную неоплазию (ПИН) считают морфологическим эквивалентом предрака предстательной железы. Аутопсийные данные показывают, что ПИН “опережает” инвазивную карциному предстательной железы примерно на 10 лет и впервые выявляется у мужчин третьей декады жизни. ПИН формируется на базе предсуществующих пролиферативных изменений эпителия протоков, дуктул, ацинусов. В биоптатах ПИН обычно определяется в единичных ацинусах или их небольших группах, но может быть и более распространенной.
ПИН подразделяют на две степени — низкую и высокую.
При ПИН низкой степени клетки эпителия, выстилающего протоки и ацинусы, расположены тесно, местами нагромождаются друг на друга, формируя пласт неравномерной толщины, ядра клеток разной величины. Встречаются удлиненные гиперхромные ядра с мелкими ядрышками, однако они не преобладают. Диагноз ПИН в этом случае основывается на совокупности цитологических изменений и нарушений архитектоники эпителиального пласта с признаками умеренной атипии. Часть патологов предпочитают не выделять ПИН низкой степени и не упоминать ее в своих заключениях, т.к. отличить этот процесс от реактивных изменений доброкачественного эпителия трудно.
ПИН высокой степени считается предшественником большинства случаев РПЖ. Микроскопически в этих случаях обнаруживают пролиферацию эпителия, по цитологическим признакам напоминающую рак (прежде всего, увеличение размеров ядер и ядрышек). ПИН высокой степени отличается от ПИН низкой степени более выраженными “нагромождениями” клеток и многорядностью эпителия. При этом вариабельность размера ядер не очень заметна, т.к. большинство из них значительно укрупнены. Наличие хорошо видимых нуклеол, часто множественных, типично для ПИН высокой степени и имеет важное диагностическое значение (McNeal J.E. et al., 1986; Montironi R. et al., 1990; Bostwick D.G., 1995).
ПИН, скорее, служит маркером возможного наличия РПЖ, нежели является его непосредственным предшественником. Биопсия остается единственным надежным методом выявления ПИН и раннего инвазивного РПЖ. Если при наличии ПИН рак не выявлен, необходимо последующее наблюдение, предполагающее обследование больного с морфологическим контролем каждые 3–6 мес в течение 2 лет и далее 1 раз в год в течение всей жизни. Обнаружение только ПИН не играет решающей роли в выборе тактики лечения.
Морфология
Морфологически злокачественные опухоли предстательной железы подразделяются на эпителиальные и неэпителиальные. В свою очередь, эпителиальные опухоли делятся на аденокарциному, переходно-клеточный рак и плоскоклеточный рак. Две последние формы опухоли встречаются довольно редко. Наиболее часто встречающейся эпителиальной опухолью является аденокарцинома. При этом аденокарцинома по своему строению неоднородна. Различают следующие типы аденокарциномы:
1) мелкоацинарная,
2) крупноацинарная,
3) криброзный рак,
4) папиллярная,
5) сóлидно-трабекулярная,
6) эндометриоидная,
7) железисто-кистозная,
8) слизеобразующая.
В настоящее время наиболее широкое применение нашла гистологическая классификация Глисона (рис. 2), т.к. она во многом отвечает требованиям клиники при выборе тактики лечения и прогноза заболевания.

Рисунок 2. Гистологическая классификация Глисона
Классификация Глисона основана на степени дифференцировки железистых структур опухоли. Опухоль с показателем 1 по Глисону образуют практически нормальные железы, структура которых по мере увеличения показателя Глисона утрачивается, а при показателе 5 по Глисону опухоль характеризуется недифференцированными клетками. Чем ниже дифференцировка тканей, тем хуже прогноз у больного.
По классификации Глисона выделяются пять градаций степени дифференцировки опухоли:
- Градация 1. Опухоль состоит из небольших однородных желез с минимальными изменениями ядер.
- Градация 2. Опухоль состоит из скоплений желез, все еще разделенных стромой, но расположенных ближе друг к другу.
- Градация 3. Опухоль состоит из желез различного размера и строения и, как правило, инфильтрирует строму и окружающие ткани.
- Градация 4. Опухоль состоит из явно атипичных клеток и инфильтрирует окружающие ткани.
- Градация 5. Опухоль представляет собой слои недифференцированных атипичных клеток.
За редким исключением РПЖ имеет неоднородную структуру. Поэтому для того, чтобы подсчитать показатель Глисона, суммируют две наиболее часто встречающиеся градации.
Чаще всего встречается опухоль, которая состоит из атипичных клеток и инфильтрирует окружающие, что соответствует градации Глисона 4. Проведенный анализ исходов выжидательной тактики в лечении РПЖ показал, что у больных с показателем по Глисону менее 4 опухоль метастазировала в 2,1% случаев в год, у больных с показателем по Глисону от 5 до 7 — в 5,4% случаев, а у больных с показателем по Глисону более 7 — в 13,5% случаев.
Классификация РПЖ по TNM (2002 г.)
Критерий Т (опухоль):
Т1 — cлучайно выявленная (не пальпируемая и не выявляемая при УЗИ),
Т1а — случайно выявленная опухоль (при трансуретральной резекции предстательной железы), занимающая менее 5% резецированной ткани,
Т1b — случайно выявленная опухоль (при трансуретральной резекции предстательной железы), занимающая более 5% резецированной ткани,
T1c — непальпируемая опухоль предстательной железы, выявленная при биопсии под контролем трансректального УЗИ; показания к биопсии — повышенный уровень ПСА,
Т2 — опухоль ограничена предстательной железой,
Т2a — опухоль занимает не более половины одной доли,
T2b — опухоль занимает более половины одной доли,
Т2c — опухоль локализуется в обеих долях,
Т3 — опухоль прорастает за пределы капсулы предстательной железы,
Т3a — экстракапсулярное распространение опухоли,
Т3b — экстракапсулярное распространение с инвазией семенных пузырьков,
Т4 — опухоль фиксирована или прорастает в соседние органы.
Критерий N (регионарные лимфоузлы):
NX — метастазы в регионарные лимфоузлы не могут быть оценены,
N0 — нет метастазов в регионарные лимфоузлы,
N1 — метастазы в регионарные лимфоузлы.
Критерий М (отдаленные метастазы):
МХ — отдаленные метастазы не могут быть оценены,
М0 — отдаленных метастазов нет,
М1 — отдаленные метастазы,
М1а — метастазы в лимфоузлы, не относящиеся к регионарным,
М1b — метастазы в кости,
М1c — метастазы в другие органы (прямая кишка, семенные пузырьки).
Клиническая картина РПЖ
На начальных стадиях РПЖ клинически практически не проявляется и выявляется, как правило, случайно после трансуретральной резекции доброкачественной гиперплазии предстательной железы либо после морфологического изучения материала, полученного после надлобкового удаления узлов по поводу доброкачественной гиперплазии. Примерно у 5–10% мужчин после названных операций выявляется рак; из них у 2/3 — обычно высокодифференцированные опухоли, которые занимают менее 5% иссеченной ткани.
За последние годы благодаря внедрению в клиническую практику новых методов диагностики (УЗИ, КТ, МРТ, маркеры), значительно чаще стали выявляться ранние стадии РПЖ. Раньше у многих больных заболевание проявлялось похуданием, болями в костях, сонливостью, симптомами обструкции мочевых путей, что было обусловлено местнораспространенной опухолью или метастазами. Однако за последние годы РПЖ все чаще диагностируют на более ранних стадиях, когда больные практически не предъявляют жалоб.
Ранняя диагностика заболевания привела, в свою очередь, к возможности выбирать метод лечения.
Симптомокомплекс РПЖ имеет множество различных проявлений, основными из которых являются:
— симптомы инфравезикальной обструкции (учащенное и затрудненное мочеиспускание, вялая струя и т.д.);
— симптомы, вызванные распространением опухоли (гематурия и боль).
Условно симптомы РПЖ можно разделить на характерные для ограниченного заболевания и характерные для местнораспространенного опухолевого процесса.
Симптомы обструкции мочевыводящих путей стоят на первом месте среди клинических проявлений РПЖ. При прорастании опухолью простатической части уретры возникает гематурия и болезненное мочеиспускание. Если в опухолевый процесс вовлекается сфинктер мочеиспускательного канала, развивается недержание мочи. В подобной ситуации необходимо дифференцировать недержание мочи из-за хронической задержки мочи с опухолевым поражением сфинктера. При хронической задержке симптомы обструкции возможно устранить при помощи трансуретральной резекции предстательной железы. РПЖ может распространиться на дистальный отдел прямой кишки и сдавить ее просвет. В подобных случаях заболевание будет проявляться запорами, тенезмами, кровотечениями, выделением слизи из прямой кишки, вплоть до толстокишечной непроходимости.
В России около 70% больных РПЖ обращаются к врачам уже в 3–4 стадии заболевания, при наличии метастазов. Основной симптом, который заставляет пациента обращаться к врачу — это боли, обусловленные метастатическим поражением костей скелета. Локализация болей обычно соответствует локализации метастазов — за исключением конечностей, где боли могут быть проводниковыми за счет сдавления нервных корешков на фоне метастатического поражения позвоночника. Боли имеют тенденцию к постепенному усилению. Особенно резкие боли возникают при патологических переломах, в частности, переломе шейки бедра.
Метастазы в позвоночнике могут привести к компрессии спинного мозга, что, в свою очередь, может вызвать параплегию.
Диагностика рака предстательной железы
Тщательно собранный анамнез помогает установить некоторые особенности заболевания. Симптомы РПЖ, особенно дизурия, развиваются быстро. Иногда постепенно ухудшается общее состояние, больной жалуется на слабость, похудание. Внешний вид пациента изменяется только при далеко зашедшем опухолевом процессе. Истощение и выраженная бледность кожи наблюдаются редко. При осмотре следует обращать внимание на состояние лимфатических узлов, печени, почек, мочевого пузыря, определять количество остаточной мочи. При подозрении на РПЖ в первую очередь принято проводить три необходимых исследования:
1. Пальцевое исследование предстательной железы.
2. Определение уровня простатаспецифического антигена (ПСА).
3. УЗИ предстательной железы, при необходимости — одновременно с биопсией.
Пальцевое исследование прямой кишки
Самый простой и безопасный метод диагностики РПЖ. Однако результаты исследования во многом зависят от размера опухоли и ее локализации. Пальпация железы осуществляется в коленно-локтевом положении больного, либо в положении на правом боку. При РПЖ выявляются следующие изменения:
— асимметрия предстательной железы;
— участки предстательной железы плотной или деревянистой консистенции. Плотность может определяться в виде отдельных узлов либо различной величины инфильтратов, вплоть до перехода их на стенки таза;
— неподвижность железы вследствие сращения ее с окружающими тканями;
— пальпируемые семенные пузырьки.
Данные, полученные при пальпации, не всегда легко интерпретировать, т.к. подобные изменения в предстательной железе могут возникать при различных заболеваниях, с которыми нужно дифференцировать РПЖ, в т.ч.:
— доброкачественная гиперплазия предстательной железы;
— камни предстательной железы;
— простатит;
— флеболиты стенки прямой кишки;
— полипы или рак прямой кишки;
— аномалии семенных пузырьков.
При оценке результатов пальпации, безусловно, очень трудно дифференцировать РПЖ от перечисленных заболеваний, но сомнения являются веским основанием для дальнейшего обследования пациента. Только у 30% больных при наличии пальпируемых узлов предстательной железы впоследствии верифицируют РПЖ.
Определение уровня простатаспецифического антигена (ПСА)
ПСА имеет большое значение не только для диагностики, но и лечения, прогноза больных РПЖ.
В скрининговых программах для всех возрастных групп традиционно используют пороговый уровень ПСА — 4 нг/мл. Использование предложенного уровня снижает количество ложноположительных определений при гиперплазии предстательной железы. Необходимо учитывать, что уровень ПСA в сыворотке крови может быть повышен по следующим причинам:
— рак простаты;
— доброкачественная гиперплазия предстательной железы;
— наличие простатита;
— ишемия или инфаркт простаты;
— эякуляция накануне исследования.
Увеличение уровня ПСA до 20 нг/мл и выше является высокоспецифичным для РПЖ даже при нормальных результатах пальцевого ректального исследования. Поэтому при высоких значениях ПСA должна обязательно проводиться биопсия предстательной железы. Уровень ПСA более 50 нг/мл указывает на экстракапсулярную инвазию простаты в 80% случаев и поражение регионарных лимфатических узлов у 66% больных. Исследования Rana et al. (1992) показали, что результаты ПСA более 100 нг/мл указывают на 100%-ное метастазирование (регионарное или отдаленное).
Наибольшие трудности возникают при интерпретации значений ПСA в диапазоне от 4 до 20 нг/мл. Проведенные исследования свидетельствуют о том, что частота РПЖ достигает по разным данным 27–37% у пациентов с концентрацией ПСА от 4 до 15 нг/мл и нормальными данными пальцевого ректального исследования.
Помимо первичной диагностики РПЖ, определение ПСА широко применятся в следующих случаях:
1. После радикальной простатэктомии. Через несколько дней ПСА перестает определяться либо держится на уровне 0,1 нг/мл. Регулярные контрольные исследования (каждые 3 мес) позволяют своевременно выявить рецидив заболевания в случае повышения ПСА. Если же показатели ПСА составляют 0,1 нг/мл и отсутствуют клинические симптомы болезни, то необходимости в других исследованиях нет, т.к. рецидив маловероятен.
2. У больных, получавших лучевую терапию, отмечается значительное снижение уровня ПСА в сыворотке крови, что свидетельствует об эффективности лечения. В то же время повышение ПСА говорит о малой чувствительности опухоли к проводимому лечению либо о рецидиве заболевания. Следует отметить, что снижение ПСА до нормальных значений коррелирует с уровнем этого антигена до лечения. Пациенты с уровнем ПСА, составляющим до лечения не более 20 нг/мл, имеют после лечения в 82% случаев нормальные показатели ПСА, в то время как у больных с более высокими значениями ПСА до лечения это соотношение составляет лишь 30%. Большинство пациентов со стабильным снижением ПСА остаются в ремиссии в течение последующих 3–5 лет.
3. Повышение уровня ПСА у больных местнораспространенным и диссеминированным РПЖ, получающих гормональную терапию, свидетельствует о прогрессировании заболевания и необходимости изменить характер лечения. При гормональном лечении уровни ПСА в сыворотке крови являются точным индикатором успеха или неуспеха терапии. После начала терапии уровень ПСА быстро снижается у 50% больных (от 85 до 2,1 нг/мл), в то время как при неудачной терапии величина ПСА не изменяется.
Ультразвуковое исследование
УЗИ нашло широкое применение в диагностике многих заболеваний предстательной железы, в т.ч. и РПЖ. Золотым стандартом стало трансректальное УЗИ. Современные трансректальные ультразвуковые датчики обеспечивают очень высокое качество изображения и позволяют детально визуализировать структуру предстательной железы, окружающих ее органов и тканей, а также прицельно взять биопсию из измененного участка железы. Неизмененная предстательная железа при УЗИ имеет треугольную форму. Основание железы обращено к прямой кишке, а верхушка — к шейке мочевого пузыря. Наибольший размер железы в поперечном направлении составляет 40–45 мм, в переднезаднем направлении он равен 20–27 мм, в продольном — 35–45 мм. На ультразвуковых томограммах различаются центральная и периферическая зоны предстательной железы. Рак чаще всего развивается в периферической зоне простаты. Учитывая эту особенность, проще проводить дифференциальную диагностику с другими заболеваниями. Выявляемые структурные изменения, локализирующиеся в пределах центральной зоны, с большей вероятностью могут быть отнесены к проявлению доброкачественного процесса, в то время как обнаружение структурной перестройки, локализующейся в периферической зоне, чаще соответствует злокачественной опухоли.
Периферическая зона занимает 75% объема предстательной железы, и в этой части железы рак возникает в 80% случаев. Большей частью опухоль располагается на глубине 3–4 мм от пограничного слоя. Центральная зона занимает около 20% объема железы, здесь развивается только 5% злокачественных новообразований. Наиболее характерным признаком РПЖ, локализующегося в периферической зоне, является наличие одного или нескольких узлов неправильной формы и пониженной эхогенности.
Важное значение имеет выявление инфильтрации по переднебоковой поверхности железы, которая недоступна пальцевому исследованию. Наиболее сложными для диагностики являются опухоли, локализующиеся в центральной и переходной зонах железы. Зачастую, развиваясь на фоне доброкачественной гиперплазии, рак по эхогенности практически не отличается от окружающих тканей, в связи с чем нередко возникают диагностические ошибки. По мере увеличения опухолевой инфильтрации стромы железы меняется ее ультразвуковая структура. Ткань железы становится неоднородной с беспорядочными отражениями низкой интенсивности. УЗТ позволяет выявить инфильтрацию капсулы простаты, семенных пузырьков, мочевого пузыря, стенки прямой кишки, лимфатических узлов, что, естественно, позволяет уточнить стадию заболевания.
Биопсия предстательной железы
Диагноз РПЖ требует обязательной верификации. С этой целью выполняется пункционная биопсия, которая наиболее достоверна при выполнении ее под ультразвуковым наведением. Особенно это касается обследования больных с малыми образованиями.
Биопсию предстательной железы можно производить через промежность, трансректально или трансуретральным доступом. Открытая биопсия применяется крайне редко.
Трансуретральная резекция предстательной железы не только позволяет уточнить диагноз, но и обеспечивает восстановление мочеиспускания.
Трансвезикальная биопсия предстательной железы — вынужденная манипуляция, производимая больным с подозрением на РПЖ при срочном выполнении цистостомии в связи с острой задержкой мочеиспускания, обострением хронического пиелонефрита и высокой азотемией.
В настоящее время общепринятым методом верификации диагноза является трансректальная биопсия под контролем УЗИ. Hodge K.K. et al. (1989) была обоснована и предложена ставшая в дальнейшем общепринятой методика биопсии предстательной железы из 6 точек (“секстантная” биопсия), при которой взятие образцов ткани осуществляется по парасагиттальной линии между срединной бороздой и латеральной границей из основания, средней части и верхушки правой и левой долей. По данным Catalona W.J. et al. (1991), частота обнаружения рака при биопсии с помощью трансректальной ультрасонографии составила 22,6% (264 случая у 1167 пациентов). Несмотря на хорошую выявляемость РПЖ при секстантной биопсии, число ложноотрицательных биопсий составляло, по разным данным, от 30 до 45%. В последние годы появились исследования, согласно которым выявляемость РПЖ обратно пропорциональна объему предстательной железы. Осложнения пункционной биопсии встречаются крайне редко и могут быть связаны с повреждением мочевого пузыря и мочеиспускательного канала. Возможны гематурия, гематоспермия, промежностная и позадилобковая гематома. Для профилактики инфекционных осложнений, которые составляют около 2%, за сутки до биопсии и после нее назначают антибиотики широкого спектра действия.
В некоторых сложных случаях дифференциальной диагностики с успехом применяют цитологическую диагностику РПЖ. Для цитологического исследования используют аспират из предстательной железы.
Рентгеновская компьютерная томография
РКТ не является методом ранней диагностики РПЖ вследствие незначительной разницы в плотности опухолевой и неизмененной ткани предстательной железы. Показаниями к его применению являются:
— уточнение макроструктуры железы при отсутствии опухоли по данным УЗИ;
— большие аденомы;
— Т3-Т4 стадии — для определения степени инвазии, распространенности процесса на окружающие органы и ткани, наличия метастатического поражения регионарных лимфатических узлов (особенно тазовой области), уточнения характера изменений в костях при положительных данных радионуклидной сцинтиграфии, очаговой гиперфиксации препарата, уточнения наличия отдаленных метастазов (голова, легкие и др.);
— планирование лучевой терапии;
— динамический мониторинг эффективности лечения.
Крайне сложно оценить при КТ инфильтрацию перипростатической клетчатки. Увеличение тазовых лимфоузлов более 1–1,5 см при верифицированном РПЖ указывает на высокую вероятность их метастатического поражения. Конгломераты лимфатических узлов в 2 см и более однозначно указывают на злокачественное поражение. Следует подчеркнуть, что при появлении увеличенных тазовых лимфоузлов обязательно исследование парааортальной и паракавальной зон для исключения метастазирования в эти области. Однако если тазовые лимфоузлы не выявлены при РПЖ, метастатическое поражение ретроперитонеальных лимфоузлов не наблюдается.
Аксиальные срезы дают представление о топографо-анатомическом положении предстательной железы, окружающих тканей. Патогномоничных КТ признаков РПЖ практически не существует. К ограничениям метода относится трудноразличимость различных мягкотканных структур малого таза. Даже трехмерная реконструкция на современных аппаратах далеко не всегда позволяет дифференцировать жировую клетчатку, соотношение предстательной железы и прямой кишки, однозначно судить об инфильтрации стенок мочевого пузыря.
Магнитно-резонансная томография
МРТ имеет целый ряд преимуществ при диагностике РПЖ по сравнению с РКТ. Благодаря различной интенсивности сигнала от мягких тканей таза возможна дифференциация его различных структур: предстательной железы, мочевого пузыря, семенных пузырьков, прямой кишки, окружающей жировой клетчатки. МРТ позволяет оценить вовлечение в процесс уретры, различных отделов предстательной железы, мочевого пузыря, клетчатки, мышцы, поднимающей наружный сфинктер прямой кишки, семенных пузырьков и лимфатических узлов. Преимущество МРТ по сравнению с РКТ заключается в лучшей визуализации структур малого таза, их взаимоотношения, возможности выбора проекции: аксиальной, сагиттальной и коронарной. Наиболее информативны Т2-взвешенные изображения в аксиальной, фронтальной плоскостях.
МРТ дает детальное изображение шейки мочевого пузыря и положения предстательной железы; с ее помощью можно определить инфильтрацию РПЖ мышцы, поднимающей задний проход, прямой кишки, стенки мочевого пузыря; оценить прорастание опухоли в перипростатические ткани и метастазирование в регионарные лимфатические узлы.
Кроме того, МРТ имеет значение в оценке костных метастазов, особенно при наличии компрессии спинного мозга. Однако не всегда можно дифференцировать метастаз от скопления жировой ткани, выявить остеобластические вторичные поражения. В данных ситуациях предпочтительнее РКТ.
Позитронная эмиссионная томография
ПЭТ имеет обнадеживающие перспективы применения в онкоурологии. Данный метод позволяет одновременно оценить степень вовлечения в опухолевый процесс различных органов и тканей и всех групп лимфатических узлов. Хотя опыт применения ПЭТ при РПЖ невелик, перспективы его развития очевидны.
Проведено несколько исследований, в которых изучали ПЭТ при локализованном и местнораспространенном РПЖ. При локализованном процессе ПЭТ показал неудовлетворительные результаты, прежде всего, из-за низкого уровня гликолиза в опухоли, и, следовательно, низкого накопления радиоактивной 2-дезокси–2-(18F)фтор-D-глюкозы (ФДГ). Кроме того, ФДГ накапливается в мочеточниках и мочевом пузыре, что затрудняет оценку прилежащих структур, таких как предстательная железа и тазовые лимфатические узлы. Накопление радиоизотопа при РПЖ трудно отличить от доброкачественной гиперплазии предстательной железы. С этой же проблемой сталкиваются при дифференциальной диагностике рецидива после простатэктомии и послеоперационных рубцовых изменений. Hofer et al. (1999) показали, что два этих состояния при использовании ПЭТ отображаются идентично.
Опухоли с бóльшим показателем Глисона накапливают бóльшее количество ФДГ. Это дает возможность выявлять агрессивные формы локализованного РПЖ и применять определенную лечебную тактику.
ПЭТ может оказаться перспективным методом в дооперационном исследовании состояния лимфоузлов и отдаленных метастазов. Hellicapell et al. (1999) оценивали состояние лимфоузлов при помощи ПЭТ у 17 больных с впервые выявленным РПЖ и потом сравнивали эти данные с послеоперационными результатами. Метод точно определил поражение лимфатических узлов у 4 из 6 больных. Ложноположительных результатов при этом не отмечено. Два ложноотрицательных результата связывали с небольшими размерами метастазов (менее 5 мм).
ПЭТ эффективна в диагностике отдаленных метастазов РПЖ. Seltzer et al. (1999) исследовали 45 больных после простатэктомии, лучевой терапии или криотерапии, которым при появлении биохимического рецидива проводили ПЭТ. У 6 из 9 больных положительные результаты ПЭТ коррелировали с метастатическим поражением, подтвержденным биопсией.
Экскреторная урография
Этот метод позволяет оценить выделительную функцию почек и уродинамику верхних мочевых путей. Уретероэктазия и уретерогидронефроз являются следствием сдавления тазовых отделов мочеточников опухолью. Такие изменения часто бывают односторонними. При полной обструкции мочеточника происходит выключение почки, при этом тень рентгеноконтрастного вещества на стороне сдавления отсутствует.
Цистоскопия
Является вспомогательным методом диагностики при РПЖ. При проведении цистоскопии может отмечаться девиация мочеиспускательного канала опухолевыми узлами и удается обнаружить асимметричную деформацию шейки мочевого пузыря. В месте прорастания опухолью предстательной железы стенки мочевого пузыря определяются разрыхленность слизистой оболочки, фибриновые налеты, язвы или опухолевые разрастания.
Сцинтиграфия костей
Как правило, выполняется в случае вновь выявленного РПЖ для оценки исходного состояния. Однако этот метод при стандартном обследовании стали использовать реже, т.к. было доказано, что уровень ПСА является более надежным диагностическим критерием при метастазах в кости, кроме того, последний метод дешевле. Таким образом, в 50% случаев РПЖ при уровнях ПСА ниже 20 нг/мл сцинтиграфия костей считается не показанной. Характерные изменения определяют при рентгенографии костей таза и поясничного отдела позвоночника, при их метастатическом поражении, которые носят чаще остеобластический, реже остеолитический или смешанный характер. Вследствие чередования остеобластических и остеолитических участков кости таза имеют пятнистый, мраморный вид.
Несмотря на применение всех современных методов диагностики РПЖ, в установлении стадии заболевания все же допускается большой процент ошибок (47%). Как видно из таблицы 1, из 3170 больных правильное определение стадии имело место лишь у 1497 (47%). После операции установлена стадия рТЗ у 1339 больных (42%), метастазы в лимфатические узлы — у 334 пациентов (11%), и опухоль по линии разреза была выявлена у 770 (24%) больных. В основном ошибки допускались в клинических стадиях Т2b и Т2с, хотя ошибки были и при опухоли размерами Т1а и Т1b. В большом проценте случаев клинически имеет место занижение стадии болезни.
Таблица 1
Ошибки стадирования 3170 больных, перенесших радикальную простатэктомию по поводу клинически локализованного РПЖ (стадииТ2с и меньше)
| Клиническая стадия | Число больных, % | Патологоанатомическая стадия | |||
| pТ1-2 | рТ3 | pN+ | Опухоль по линии резекции | ||
| Т1а | 49 (1,5%) | 44 (88%) | 4 (8%) | 1 (2%) | 2 (4%) |
| Т1b | 177 (5,6%) | 120 (68%) | 46 (16%) | 11 (6%) | 35 (20%) |
| Т2а | 897 (28%) | 512 (57%) | 330 (37%) | 55 (6%) | 140 (16%) |
| Т2b,c | 2047 (65%) | 82 (40%) | 959 (47%) | 267 (13%) | 593 (29%) |
| Всего | 3170 (100%) | 1497 (47%) | 1339 (42%) | 334 (11%) | 770 (24%) |
Для снижения ошибок дооперационной диагностики учитывают строение опухоли, степень ее дифференцировки, показатель Глисона, плоидность опухолевых клеток. При анализе этих данных у больных после простатэктомии в зависимости от показателя Глисона выявилась прямая закономерность: чем меньше показатель Глисона, тем меньше вероятность большого распространения опухоли. И наоборот, чем больше показатель Глисона, тем больше вероятность распространения опухоли за пределы капсулы и больше вероятность рецидива опухоли.
Скрининг рака предстательной железы
В настоящее время программы скрининга, направленные на раннее выявление опухолевых заболеваний, рассматриваются как основные составляющие борьбы против рака. Успех скрининга зависит от таких факторов, как биологические особенности и клиническое течение опухолевого процесса, методы исследования, их чувствительность, специфичность и правильный выбор критериев эффективности.
РПЖ I и II стадии клинически не проявляется, поэтому заболевание можно выявить только активными профилактическими обследованиями мужского населения. Мнения о ценности массовых обследований мужчин для выявления РПЖ противоречивы (табл. 2). Во-первых, локализованный РПЖ может протекать в латентной форме и длительное время не проявлять себя. В этой связи раннее выявление рака пока еще не предоставило убедительных доказательств увеличения выживаемости. А у пожилых мужчин положительный эффект скрининга может быть не столь значительным, как у более молодых, т.к. как вероятность значительного прогрессирования заболевания в течение жизни у них меньше.
Таблица 2
Скрининг РПЖ
| Преимущества | Недостатки |
| 1. Наличие простых методов обследования (ПСА, пальцевое исследование прямой кишки) 2. Выявление опухоли на ранних стадиях, когда возможно полное излечение 3. Благоприятное психологическое действие на мужчин при отрицательных результатах скрининга 4. Возможное снижение частоты осложнений и смертности от РПЖ |
1. Высокая вероятность выявления латентных опухолей, которые никогда не перерастут в заболевание с клиническими проявлениями 2. Эффективность скрининга в отношении снижения смертности не доказана 3. Ложноположительные результаты настораживают больных 4. Дорогостоящие методы, требующие больших временных затрат 5. Биопсия под контролем трансректального УЗИ осложняется инфекцией в 2% случаев |
Скрининг РПЖ в последние годы рассматривается как возможный путь снижения смертности от этого заболевания. В настоящее время наиболее эффективными методами раннего выявления РПЖ являются комбинация пальпаторного исследования через прямую кишку, определения ПСА и трансректального УЗИ. Чувствительность трансректального УЗИ значительно выше, чем при пальцевом исследовании.
Сторонники и критики скрининга признают, что с помощью ПСА можно обнаружить ранние формы рака, но убедительных доказательств снижения смертности в настоящее время не существует. Кроме того, пока нет и единой точки зрения, что считать успехом скрининга и каковы должны быть критерии целесообразности скрининга.
Проведенные в последнее время исследования продемонстрировали, что определение ПСА в качестве скринингового теста способствует увеличению степени обнаружения РПЖ по сравнению с уровнем выявления, достигнутым при помощи пальцевого метода. Cohen J.K. et al. (1997) организовали исследование по определению уровня ПСА у 1653 здоровых мужчин 50 лет и старше. В данном исследовании частота обнаружения РПЖ составила 2,2%. В другом исследовании Catalona W.J. et al. (1994) показали, что скрининг с применением ПСА приводит к выявлению значительного числа локальных форм рака по сравнению, например, с применением только пальцевого метода.
В связи с этим возникает вопрос, имеет ли клиническое значение обнаружение непальпируемых опухолей или это микроскопические образования, не имеющие биологического значения для пациента? В результате патоморфологических исследований было установлено, что опухоли предстательной железы меньше 0,5 см3 в объеме не являются угрожающими для жизни больного и к ним применима выжидательная тактика.
Ряд патологических процессов в предстательной железе, таких как доброкачественная гиперплазия, острый и хронический простатит и др., могут вызвать повышение уровня ПСА. Фактически около 25% мужчин с гистологически подтвержденным диагнозом доброкачественной гиперплазии предстательной железы имеют показатель ПСА выше принятой нормы 4,0 нг/мл. Partin A.W. et al. (1993) проанализировали истории болезни 703 мужчин, перенесших радикальную простатэктомию, и разработали таблицы вероятного предсказания морфологической стадии. Исходя из результатов данной работы, сочетание трех предоперационных переменных (клиническая стадия, градация Глисона, уровень ПСА) оказалось более точным для предсказания окончательной морфологической стадии, чем использование каждой из них в отдельности.
В последние годы большой интерес в скрининговых программах представляет проблема определения отдельных форм ПСА, т.к. этот маркер существует как в свободной, так и в связанной форме. Было показано, что у больных с доброкачественной гиперплазией предстательной железы в сыворотке крови присутствует больше свободного ПСА по отношению к общему ПСА (общий ПСА = свободный ПСА + связанный ПСА). У больных РПЖ данный маркер в большем количестве присутствует в связанной форме.
В ГУ РОНЦ им. Н.Н. Блохина РАМН была проведена 5-летняя скрининговая программа по раннему выявлению РПЖ.
С момента начала исследования 1129 здоровых мужчин в возрасте от 40 до 80 лет прошли полное обследование, и было выявлено 64 (5,7%) случая РПЖ, причем в первом раунде скрининга, т.е. в течение года после включения в исследование, было выявлено 54 (4,8%) случая, во втором — 6 (0,5%), в третьем — 3 (0,25%), в четвертом — 1 (0,09%), в пятом раунде, т.е. через 5 лет наблюдения, больных не выявили.
Что же продемонстрировал первый раунд скрининга? Анализ полученных данных показал, что уровень ПСА до 4 нг/мл отмечен лишь у 689 мужчин (61,0%). Результаты представлены в таблице 3.
Таблица 3
Результаты первого раунда скрининга РПЖ
| Состояние | Группы скрининга пациентов с различным уровнем ПСА, число больных (%) | |||
| От 0 до 4 нг/мл | От 4 до 10 нг/мл | От 10 до 30 нг/мл | От 30 нг/мл и выше | |
| Норма | 179 (26,0%) | 42 (15,6%) | 7 (5,2%) | — |
| Доброкачественная гиперплазия предстательной железы (ДГПЖ) | 142 (20,6%) | 123 (45,6%) | 67 (49,6%) | 5 (14,3%) |
| Простатит | 189 (27,4%) | 26 (9,6%) | 6 (4,4%) | — |
| Сочетание ДГПЖ и простатита | 153 (22,2%) | 62 (23,0%) | 26 (19,3%) | 6 (17,1%) |
| Подозрение на рак | 22 (3,2%) | 11 (4,1%) | 7 (5,2%) | 2 (5,7%) |
| Рак предстательной железы | 4 (1.46%) | 6 (2,2%) | 22 (16,3%) | 22 (62,9%) |
Полученные данные не дают возможности с уверенностью говорить о высокой диагностической ценности ПСА как специфического метода диагностики РПЖ. Подтверждением может служить тот факт, что при уровне ПСА свыше 20 нг/мл у 15 из 61 (24,6%) пациентов при детальном обследовании рака выявлено не было.
При пальцевом ректальном исследовании подозрение на рак возникло у 88 (8%) осмотренных мужчин, из них у 29 (33%) больных диагноз РПЖ был подтвержден морфологически. Необходимо отметить, что в 53 случаях (60,2%) подозрение на рак возникло как при ректальном исследовании, так и при трансректальном УЗИ.Только по данным трансректального УЗИ подозрение на наличие рака было высказано в 79 случаях. У 35 обследуемых пациентов диагноз РПЖ был морфологически верифицирован, у остальных тщательное морфологическое исследование не подтвердило этот диагноз.
Необходимость проведения биопсии предстательной железы среди первично обследуемых 1129 мужчин возникла у 172 человек. Дважды биопсия проводилась 8 обследуемым. Общее число проведенных в рамках программы скрининга (в течение пяти лет) биопсий составляет 180, рак был верифицирован у 64 мужчин (у 54 в первом раунде — при первичном осмотре, у 6 — во втором, у 3 — в третьем и у 1 — в четвертом). В 79,6% выявлена аденокарцинома предстательной железы, в остальных — смешанные опухоли.
На основании полученных результатов скрининга был осуществлен сравнительный анализ с контрольной группой, в которую вошли мужчины, самостоятельно обратившиеся за консультацией к урологу в поликлинику ГУ РОНЦ им. Н.Н. Блохина РАМН. Всего за пять лет в поликлинику обратилось 943 мужчины по поводу заболеваний предстательной железы. Большую часть обследуемых, а именно 76,6%, составляли мужчины в возрасте от 60 до 79 лет. У 489 мужчин был установлен диагноз РПЖ. Изучение распределения больных РПЖ по стадиям в двух сравниваемых группах показало следующее: больные РПЖ, выявленные при скрининге на стадии Т1 и Т2, составили 77,7%, а при обращении в поликлинику больные РПЖ на стадии Т3, Т4 и T1–3N0M1 — 79%.
На основе полученных результатов можно констатировать, что скрининг позволил за период 1996–2000 гг. выявить в 5,7% случаев РПЖ у “здоровых” мужчин, что почти в 1,5–2 раза превышает известные литературные данные. Ранние стадии РПЖ при скрининге выявлены в 77,7% случаев, в то время как при анализе обращаемости в поликлинику за тот же период времени это число составило лишь 22%. Полученные данные подтверждают необходимость проведения профилактических осмотров не реже одного раза в год, что способствует более раннему выявлению РПЖ. Так, больные РПЖ из группы скрининга получили радикальное лечение в 48,4% случаев, а в группе по обращению в поликлинику — лишь в 25%.
Литература
Бельчиков И.С. ...Профилактика злокачественных новообразований.— Рига, 1986.— C. 164–166.
Голдобенко Г.В. и др. ...Вопр. онкологии.— 1999.— Т. 45.— № 6.— С. 696–701.
Маринбах Е.Б. Рак предстательной железы.— М.: Медицина., 1980.— 160 с.
Свиридова Т.В. ...Пленум Всеросс. общ. урологов.— Саратов, 1994.— С. 170–171.
Трапезников Н.Н. и др. Статистика злокачественных новообразований в России и странах СНГ (состояние онкологической помощи, заболеваемость и смертность).— М., 2001.
Шолохов В.Н. Роль и место ультразвуковой томографии в диагностике рака предстательной железы/ Материалы Европейской школы онкологов “Рак простаты”.— М., 1997.
Adolfsson J. ...J. Urol.— 1993.— V. 149.— P. 326–329.
Armstrong В. Et al. ...Int. J. Cancer.— 1975.— V. 15.— P. 617–631.
Babaian R.J. et al. ...Cancer.— 1995.— V. 752.— P. 153–2158.
Bagshaw M.A. et al. ...Radiology.— 1965.— V. 85.— P. 121–129.
Bangma C.H. et al. ...Br. J. Urol.— 1995.— V. 76.— P. 595–599.
Basaria S. et al. ...Сlin. Endocrinol. (Oxf.).— 2002.— V. 56 (6).— P. 779–786.
Bauer J.J. et al. ...J. Urol.–1998.— V. 156.— P. 1511–1516.
Benson N.C. et al. ...J. Urol.— 1992.— V. 147.— P. 815.
Bergan R.C. et al. ...Proc. Am. Soc. Clin. Oncol.— 1995.— V. 14.— P. A637.
Bey P. ...Radiother. Oncol.— 2002.— V. 64 (suppl. 1).— P. 104.
Bishoff J.T. et al. ...Urol.— 1995.— V. 45 (2).— P. 270–274.
Blasko J.C. et al. ...Int. J. Rad. Oncol., Biol., Phys.— 1996.— V. 36.— P. 198.
Bluestein D.L. et al. ...J. Urol.— 1994.— V. 151.— P. 13, 15.
Boccardo F. et al. ...J. Clin. Oncol.— 1999.— V. 17.— P. 2027–2038.
Boccon-Gibod L. et al. ...Eur. Urol.— 1994.— V. 24 (suppl. 2).— P. 77–80.
Bonney W.W. et al. ...Urology.— 1983.— V. 22.— P. 8–15.
Borland R.N. et al. ...J. Urol.— 1992.— V. 41.— P. 437–443.
Brawer M.K. et al. ...J. Urol.— 1992.— V. 147.— P. 841.
Breen S.L. et al. ...J. Nucl. Med.— 1992.— V. 33 (7).— P. 1316–1320.
Catalona J.E. ...J. Urol.— 1991.— V. 145.— P. 907.
Catalona W.J. et al. ...J. Urol.— 1994.— Vl. 151.— P. 1283— 1290.
Catalona W.J. et al. ...N. Engl. J. Med.— 1991.— V. 324.— P. 1156.
Chaussy C. et al. ...Eur. Urol.— 1998.— V. 33 (suppl. 1).— P. 54.
Chauvet B. et al. ...Cancer Radiother.— 2002.— V. 6 (3).— P. 141–146.
Cohen J.K. et al. ...J. Urol.— 1997.— V. 157.— P. 419A.
Crawford D. ...New Perspectives in Prostate Cancer.— Ed. by Belldegrun A.— Oxfordd, 1998.— P. 255–273.
Crawford E.D. et al. ...N. Engl. J. Med.— 1989.— V. 321.— P. 419–424.
Crook J. et al. ...Int. J. Radiat. Oncol., Biol., Phys.— 2000.— V. 48 (1).— P. 355–367.
Crook J. et al. ...Int. J. Radiat. Oncol., Biol., Phys.— 1993.— V. 27.— P. 31–37.
Eskew L.A. et al. ...J. Urol.— 1997.— V. 157.— P. 199–203.
Fourcade R.O. et al. ...Eur. Urol.— 1990.— V. 18 (suppl. 3).— P. 45–47.
Fransson P. et al. ...Cancer.— 2001.— V. 92. (12).— P. 3111–3119.
Furr B.J.A. et al./Motta M., Serio M. (eds.) Sex Hormones and Antihormones in Endocrine-Depedent pathology: Basic and Clinical Aspects.— Amsterdam: Elsever, 1994.
Gervasi L.A. et al. ...J. Urol.— 1989.— V. 142.— P. 332–336.
Gonder M.H. et al. ...Invest. Urol.— 1964.— V. 1.— P. 610–618.
Gray C.L. et al. ...J. Urol.— 2001.— V. 166.— P. 116–118.
Haldar S. et al. ...Cancer Res.— 1997.— V. 57.— P. 229–233.
Hamalaisnen E. et al. ...J.stern’ Biochem.— 1984.— V. 20.— 459–464 (1984).
Hammerer P. et al. ...J. Urol.— 1994.— V. 151.— P. 99–102.
Hanks G.E. ...Monogr. Natl. Cancer Ins. 1988.— V. 7.— P. 75–84.
Hara T. et al. ...J. Nucl. Med.— 1998.— V. 39.— P. 990–995.
Hautman R.E. et al. ...Urol.— 1994.— V. 43.— P. 47–51.
Hedican S.P. et al. ...J. Urol.— 1994.— V. 152.— P. 1181–1183.
Heicappell R. et al. ...Eur. Urol.— 1999.— V. 36.— P. 582–587.
Hill P. et al. ...Prev. Med.— 1980.— V. 9.— P. 657–666.
Hodge K.K. et al. ...J. Urol.— 1989.— V. 142.— P. 71–74.
Hofer C. et al. ...Eur. Urol.— 1999.— V. 36.— P. 31–35.
Horninger W. et al. ...J. Urol.— 1998.— V. 159 (suppl.).— P. 180.
Hudson M.A. et al. ...J. Urol.— 1989.— V. 142.— P. 1011–1017.
Iversen P et al. .../Urology.— 1998.— V. 51.— P. 389–396.
Iversen P et al. ...Urology.— 2000.— V. 164.— P. 1579–1582.
Johansson J.E. et al. ...JAMA 1992, 267:2191–2196.
Jong F.H. et al. Peripheral hormone levels in controls and patients with prostatic cancer or benign prostatic hyperplasia: results from the Dutch-Japanese case-control study.Submitted (1990).
Kabalin J.N. et al. ...J. Urol.— 1989.— V. 141.— P. 1091.
Kallakur B.V. et al. ...J. Clin. Oncol.— 1998.— V. 16.— P. 1302–1309.
Kantoff P.W. et al. ...J. Clin. Oncol.— 1999.— V. 17.— P. 2506–2513.
Kassem N.Y. et al. ...Cl. Pharmacol. And Therapeutics.— 1982.— V. 31.— P. 238.
Kleer E. et al. ...Urology.— 1993.— V. 40.— P. 207.
Klotz L.H. et al. ...Can. J. Urol.— 1996.— V. 3.— P. 246–250.
Labrie F. et al. ...Prostate.— 1983.— V. 4.— P. 579–594.
Labrie F. et al. ...Ann. endocr.— 1983.— V. 44 (5).— P. 343–344.
Lee W.R. et al. ...Cancer.— 1995.— V. 75.— P. 1909–1913.
Lerner S.E. et al. ... Oncol.— 1995.— V. 9.— P. 379–382.
Litwin M.S. et al. ...JAMA.–1995.— V. 273.— P. 129–135.
Lund F. et al. ...British J. of Urol.— 1988.— V. 61.
Mandelson M. et al. ...Ann. Rev. of Public Health.–1995.— V. 16.— P. 283–306.
McDonnel T.J. et al. ...J. Urol.— 1997.— V. 157.— P. 569–574.
McNeal J.E. et al. ...Am. J. Surg. Pathol.— 1990.— V. 14.— P. 240–247.
Mettlin С. et al. ...Cancer.— 1991.— V. 67.— P. 2949–2958.
Meyers F.J. et al: ...Cancer.— 1998.— V. 15.— P. 2534–2539.
Middleton R.G.. et al. ...J. Urol.— 1986.— V. 136.— P. 422–424.
Millin T. Retropubic urinary surgery.— London: Livingstone, 1947.
Nag S. et al. ...Radiother. Oncol.— 2002.— V. 64 (1).— P. 279.
Neumann F. et al. ...J. Steroid. Biochem.— 1983.— V. 19 (1A).— P. 391–402.
Partin A.W. et al. ...J. Urol.— 1993.— V. 150.— P. 110.
Partin A.W. et al. ...J. Urol.— 1993.— V. 150.— P. 110.
Per-Anders Abrahamsson ...Scand. J. Urol. Nephrol.— 1999.— Suppl. 203.— P. 45–49.
Perez C.A. et al. ...Mo. Med.— 1995.— V. 82.— P. 696–704.
Peters J. ...Questions and Uncertainties about prostate cancer.— London: Blackwell Science Ltd, 1996.— P. 198–215.
Petrylak D. Pathways of apoptosis as a target of therapy. The Genolier-Geneva-MSKCC Cancer Conferense, Prostate cancer.— 2001.— P. 47–49.
Porter A.T. et al. ...CA Cancer J.— 1995.— V. 45.— P. 165–178.
Price P. et al. ...Radiother. Oncol.— 1986.— V. 6.— P. 247–255.
Ramanath R.B. et al. ...J. Steroid Biochem.— 1988.— V. 31 (4).— P. 731–737.
Raynaud J.P. et al. ...J. Steroid Biochem.— 1986.— V. 25 (5B).— P. 811–833.
Richie J.P. ...Urol.— 1997.— V. 49.— P. 35–37.
Rossler D. et al. ...Prostate Cancer.— 1987.— V. 34.— P. 232–234.
Scardino P.T. et al. ...Monogr. Natl. Cancer Inst.— 1988.— V. 7.— P. 95–103.
Schellhammer H.F. et al. ...Abstr. From the XIII th congress of the EAU.— Barselona, 1998.— P. 184.
Sciarra A. et al. Hormone-refractory prostate cancer//Scand. J. Urol. Nephrol.— 1999.— V. 33.— P. 211–216.
Seay T.M. et al. ...J. Urol.— 1998.— V. 159.— P. 357–364.
Seltzer M.A. et al. ...J. Urol.— 1999.— V. 162.— P. 1322–1328.
Serviado C. et al. ...Urology.— 1991.— V. 38.— P. 342–345.
Sgrignoli A.R. et al. ...J. Urol.— 1994.— V. 152.— P. 1077–1081.
Shmidt J.D. et al. ...Urology.— 1976.— V. 7.— P. 602–610.
Smith D.C. et al: ...Urology.— 1998.— V. 52.— P. 257–260.
Sogani P.C. et al. ...Clin. Bull.— 1979.— V. 9.— P. 24–31.
Steiner M.C. ...Urol.— 1994.— V. 44.— P. 530–534.
Terris M.K. ...Urology.— 2000.— V. 55.— P.457— 460.
Thorpe S.C. et al. ...Eur. Urol.— 1996.— V. 29.— P. 47–54.
Thorpe S.C. et al. A prospective, randomised study to compare goserelin acetate (Zoladex) vs Cyprostat (cyproterone acetate) vs a combination of the two in the treatment of metastatic prostatic carcinoma. In press (Eur Urol).
Tyrrell C.J. et al. ...J. Urol.— 1991.— V. 146.— P. 1321–26.
Walsh P.C. ...J. Urol.— 1998.— V. 160.— P. 2418–2424.
Walsh P.C. et al. ...J. Urol.— 1982.— V. 128.— P. 492.
Waymont B. et al. ...Br. J. Urol.— 1992.— V. 69.— P. 614–620.
Young H.H. ...John Hopkins Bull.— 1905.— V. 16.— P. 315–321.
Zagars G.K. et al. ...Cancer.— 1993.— V. 72.— P. 538–548.
Zaridze D.G. et al. ...Br. J. Urol.— 1987.— V. 59.— P. 493–502.
Zelefsky M.J. et al. ...Int. J. Radiat. Oncol., Biol., Phys.— 1994.— V. 29.— P. 755–761.
Zhao H.E. et al. ...Mol. Carcinogen.— 1992.— V. 5.— P. 320–327.
Zietman A.L. et al. ...Int. J. Radiat. Oncol., Biol., Phys.— 1995.— V. 32.— P. 287–2902.
Zincke H. et al. ...J. Urol.— 1994.— V. 152.— P. 1850–1857.
Описание проверено экспертом
Оцените статью:
- Рак предстательной железы
- Карцинома предстательной железы
- Местнораспространенный рак предстательной железы
- Злокачественная опухоль предстательной железы
- Злокачественное новообразование простаты
- Местно-распространенный рак предстательной железы
- Местно-распространенный неметастатический рак предстательной железы
- Гормонозависимый рак предстательной железы
- Рак простаты
- Распространенный рак предстательной железы
- Аденокарцинома предстательной железы
- Неметастатический рак предстательной железы
- Гормонорезистентный рак предстательной железы
- Тестостерон-зависимый рак предстательной железы
- Метастазирующая карцинома предстательной железы
- Метастазирующий рак предстательной железы
- Метастатический гормонорезистентный рак предстательной железы
- Неоперабельный рак предстательной железы
Полужирным шрифтом выделены лекарства, входящие в справочники текущего года. Рядом с названием препарата может быть указан ежегодный уровень индекса информационного спроса (показатель, который отражает степень интереса потребителей к информации о лекарстве).
рак предстательной железы
При лечении неоперабельного рака предстательной железы, рак предстательной железы, андрогензависимой карциномой предстательной железы, карцинома предстательной железы, Гормонзависимый рак предстательной железы, гормононезависимая карцинома предстательной железы, метастазами рака предстательной железы, гормононезависимым раком предстательной железы, раком предстательной железы,


